Académique Documents
Professionnel Documents
Culture Documents
Moteur de Stirling
Transféré par
Riheb MoncerTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Moteur de Stirling
Transféré par
Riheb MoncerDroits d'auteur :
Formats disponibles
Partie II : Thermodynamique et mécanique des fluides
Rappels de thermodynamique
Correction – DM 5 – Étude du cycle du moteur de
Stirling
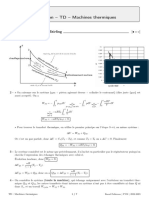
1 - On a le cycle schématisé ci-dessous.
´
Il est parcouru dans
´ le sens horaire, s’agit donc d’un cycle moteur ( pdV sur un cycle est positive, donc
le travail reçu = − pdV est négatif, c’est donc que pendant un cycle le fluide fournit du travail au milieu
extérieur).
3
reçoit Q34 de la part de la source chaude
chauffage isochore dé
te
nt
re e iso
la çoit th
2 ré par Q23 er
gé t d de m
né u e(
ra
te 3)
T
co mp
ur cèd
e
rég - Q4
res éné 1 au 4
s ion rate
ur
iso refroidissement isochore
the
rm 1
e(
T1 )
cède -Q12 à la source froide V
2 - Posons le problème :
• Système : {gaz contenu dans le cylindre}, c’est un système fermé (donc n = cst).
• Transformation : compression isotherme réversible d’un gaz supposé parfait, entre les états :
T1 = 300 K T2
isotherme, réversible, GP
État initial p1 −−−−−−−−−−−−−−−−→ État final p2
V1 V2 = V1 /ρ
Pour calculer le travail, on effectue :
ˆ 2 ˆ 2 ˆ 2 ˆ 2
W12 = − pext dV = − pdV = − nRT1 dV = −nRT1 dV = −nRT1 ln(V2 /V1 ).
1 1 1 1
On a utilisé pour la 2e égalité le fait que p = pext à tout instant car la transformation est réversible, pour la
3e égalité la loi des gaz parfait, et pour la 4e le fait que n et T sont constants (système fermé, et évolution
isotherme). Le calcul donne donc : W12 = nRT1 ln ρ .
Ensuite, pour un gaz parfait la variation d’énergie interne est ∆U = Cv ∆T = 0 ici car l’évolution est
isotherme.
On applique donc le premier principe au système {gaz} pour avoir : 0 = ∆U = W12 + Q12 . On en déduit
Q12 = −nRT1 ln ρ .
Comme ρ > 1, on a W12 > 0 et Q12 < 0.
On s’y attendait puisqu’il s’agit d’une compression du gaz, pour laquelle il faut effectivement fournir du
travail (pour comprimer) (d’où W > 0), et qui a pour effet d’échauffer le gaz et donc de produire un
transfert thermique du gaz vers l’extérieur (d’où Q < 0).
3 - Posons le problème :
• Système : {gaz contenu dans le cylindre}, c’est un système fermé (donc n = cst).
Correction – DM 5 – Moteur de Stirling 1/2 Pierre de Coubertin | TSI 2 | 2017-2018
• Transformation : échauffement isochore réversible d’un gaz supposé parfait, entre les états :
T2 = T1 = 300 K T3 = 600 K
isochore, réversible, GP
État initial p2 −−−−−−−−−−−−−−−→ État final p3
V2 V3 = V2
´
La transformation est isochore donc le travail des forces de pression est W23 = − pext dV = 0.
On peut donc applique le premier principe pour trouver le transfert thermique Q23 : on a ∆U = W23 +
nR
Q23 = Q23 , et comme il s’agit d’un gaz parfait on a ∆U = (T3 − T1 ).
γ−1
nR
D’où finalement : Q23 = (T3 − T1 ) (on a utilisé T2 = T1 ). Comme T3 > T1 , on a Q23 > 0. C’est
γ−1
normal puisqu’il s’agit d’un échauffement, donc le gaz reçoit effectivement de la chaleur.
4 - Il s’agit, tout comme à la question 2, d’une transformation isotherme réversible. Cette fois la température
est T3 , et il faut inverser le rapport des volumes car on passe de V3 = V2 à V4 = V1 (alors qu’en 2 on
passait de V1 à V2 ). On trouve donc cette fois W34 = −nRT3 ln ρ et Q34 = nRT3 ln ρ .
On a W34 < 0 et Q34 > 0. Il s’agit d’une détente, donc le gaz fournit du travail au milieu extérieur
(W34 < 0) et se refroidit donc reçoit un transfert thermique venant de l’extérieur (Q34 > 0).
5 - Tout comme à la question 3, il s’agit d’un refroidissement isochore, cette fois de la température T1 à la
nR
température T4 = T3 . On trouve donc cette fois Q41 = (T1 − T3 ) . Comme T3 > T1 , on a Q41 < 0.
γ−1
C’est normal puisqu’il s’agit d’un refroidissement, donc le gaz fournit effectivement de la chaleur au milieu
extérieur
6 - La grandeur coûteuse est à rechercher dans les transferts thermiques Q, puisque ce sont eux que l’on doit
produire pour faire tourner le moteur.
Ici on indique que le régénérateur assure un transfert parfait entre l’énergie Q41 perdue par le système
lors de l’étape 4-1 et l’énergie Q23 reçue par le système lors de l’étape 2-3. Cette énergie thermique reçue
Q23 ne coûte donc rien.
De plus, Q12 < 0 est de la chaleur perdue par le système. Le seul transfert thermique qui coûte est donc
Q34 , qui est positif donc bien reçu par le système.
La grandeur d’intérêt est ici le travail récupéré au cours d’un cycle, c’est-à-dire le travail cédé au milieu
extérieur.
C’est l’opposé du travail W reçu par le gaz au cours d’un cycle : Wcédé = −W .
On peut calculer W à l’aide du premier principe appliqué au système {gaz} lors d’un cycle : 0 = ∆U =
W + Q = W + Q12 + Q23 + Q34 + Q41 = W + Q12 + Q34 . On a donc Wcédé = −W = Q12 + Q34 .
utile Q12 + Q34 −T1 + T3
Le rendement est donc η = = = car les facteurs nR ln ρ se simplifient. On a
coût Q34 T3
T1
donc η = 1 − = 0.500 .
T3
Le commentaire attendu est que l’expression obtenue pour η est la même que pour le cycle de Carnot
réversible.
Correction – DM 5 – Moteur de Stirling 2/2 Pierre de Coubertin | TSI 2 | 2017-2018
Vous aimerez peut-être aussi
- Exercices Premier Et Deuxieme PrincipeDocument4 pagesExercices Premier Et Deuxieme PrincipeTaoufikAghrisPas encore d'évaluation
- Thermodynamique Exercices T5 - Machines ThermiquesDocument2 pagesThermodynamique Exercices T5 - Machines ThermiquesIhsan Mokhlisse84% (19)
- Thermodynamique Exercices T4 - Second PrincipeDocument4 pagesThermodynamique Exercices T4 - Second PrincipeIhsan Mokhlisse100% (5)
- Procédure Évacuation IncendieDocument5 pagesProcédure Évacuation IncendieKenza AouzeniaPas encore d'évaluation
- Pylones FRDocument16 pagesPylones FRxenaman17Pas encore d'évaluation
- Exercices Et Devoir-Thermodynamique IDocument4 pagesExercices Et Devoir-Thermodynamique Iapi-291918152Pas encore d'évaluation
- CHAP 5 Martin Gariepy v3Document29 pagesCHAP 5 Martin Gariepy v3Anonymous petYlAYPas encore d'évaluation
- l2 en TDDocument36 pagesl2 en TDSissi Dadi100% (2)
- Chap5 TD Machines Thermiques CorrDocument7 pagesChap5 TD Machines Thermiques CorrSennahPas encore d'évaluation
- Exos Thermodynamiques+SolutionsDocument80 pagesExos Thermodynamiques+SolutionsibrahimPas encore d'évaluation
- DS5 Chaleur MachineDocument4 pagesDS5 Chaleur Machineridhajamel100% (1)
- Annales ThermodynamiqueDocument47 pagesAnnales ThermodynamiqueAlami GhitaPas encore d'évaluation
- Stirling Motor PDFDocument15 pagesStirling Motor PDFomar el ghamri100% (1)
- td-CH1-18-2120190518-115415-1xvxuayDocument4 pagestd-CH1-18-2120190518-115415-1xvxuaygladys.ayengPas encore d'évaluation
- CTRL VFSB S3 2016 TH2Document4 pagesCTRL VFSB S3 2016 TH2Aminos MaPas encore d'évaluation
- CHAPITRE III - 2è Principe de La Thermodynamique PDFDocument19 pagesCHAPITRE III - 2è Principe de La Thermodynamique PDFBilal Bouakrif100% (1)
- Corrigé de Chimie 2022Document6 pagesCorrigé de Chimie 2022chakir mohammed0% (1)
- Ex Thermo 1Document10 pagesEx Thermo 1ArthurpetitPas encore d'évaluation
- Exercice Pompe À ChaleurDocument6 pagesExercice Pompe À ChaleurĶhadija KhadijaPas encore d'évaluation
- Thermo CorrectionDocument34 pagesThermo CorrectionLilia BennaceurPas encore d'évaluation
- DM28 1213Document7 pagesDM28 1213iraoui jamal (Ebay)Pas encore d'évaluation
- Série de TD #3 Deuxième Principe de La Thermodynamique: Exercice 1Document5 pagesSérie de TD #3 Deuxième Principe de La Thermodynamique: Exercice 1Imran OlaofePas encore d'évaluation
- Corrigé Du TD N°2Document4 pagesCorrigé Du TD N°2saidihakima87Pas encore d'évaluation
- TD Chap III - Turbines À Gaz Et À Vapeur - TextMarkDocument9 pagesTD Chap III - Turbines À Gaz Et À Vapeur - TextMarkait el hadi mohamed messaoud50% (2)
- Corrigé de La Série 1 - 2014Document8 pagesCorrigé de La Série 1 - 2014Riadh ChouaibiPas encore d'évaluation
- Ds PhysiqueDocument11 pagesDs Physiqueroua.benyoussefPas encore d'évaluation
- Moteur Stirling ESIB MPSIDocument9 pagesMoteur Stirling ESIB MPSIDakhlaouiPas encore d'évaluation
- Physique Du Froid FCDocument3 pagesPhysique Du Froid FCYanick leufa100% (1)
- P Bts98 CorrDocument3 pagesP Bts98 CorrGueye OusmanePas encore d'évaluation
- 06 - Cours - Master - Turbine A GazDocument8 pages06 - Cours - Master - Turbine A Gazislam mohammedPas encore d'évaluation
- Solution TD2 ThermoDocument5 pagesSolution TD2 ThermoIbrahim TaniPas encore d'évaluation
- Série de TD N°2 Avec Corrigé THERMO 2019-2020Document8 pagesSérie de TD N°2 Avec Corrigé THERMO 2019-2020amel100% (1)
- Exercice D Application MSE - 2Document2 pagesExercice D Application MSE - 2Abdelkhalek SaidiPas encore d'évaluation
- Test Premier Principe-Esp Corrige PDFDocument10 pagesTest Premier Principe-Esp Corrige PDFmednourPas encore d'évaluation
- 80633785 Cours TurbineDocument11 pages80633785 Cours TurbineElie koumbaPas encore d'évaluation
- TD t3 2nd-PpeDocument9 pagesTD t3 2nd-PpeEric Bienvenu TiomoPas encore d'évaluation
- THER 1A 2-CorrDocument4 pagesTHER 1A 2-Corroussama azouiPas encore d'évaluation
- BTS MI 1998 ExamenDocument5 pagesBTS MI 1998 ExamenAbderrahim BoulanouarPas encore d'évaluation
- Test Premier Principe-Esp PDFDocument4 pagesTest Premier Principe-Esp PDFmednourPas encore d'évaluation
- Chap5 TD Suite Machines Thermiques CorrDocument2 pagesChap5 TD Suite Machines Thermiques CorrSennahPas encore d'évaluation
- ReacteurBrayton LaserEffetThermiqueDocument45 pagesReacteurBrayton LaserEffetThermiqueNoureddine BoxePas encore d'évaluation
- TD N°1 Thermodynamique 2 (LGM)Document6 pagesTD N°1 Thermodynamique 2 (LGM)Mohamed GuelaiPas encore d'évaluation
- Td+Corrigé s6 Benami p648 Stockage Denrgies RenouvelablesDocument12 pagesTd+Corrigé s6 Benami p648 Stockage Denrgies RenouvelablestariqPas encore d'évaluation
- Travaux Dirigés de Transferts Thermiques 20-21Document3 pagesTravaux Dirigés de Transferts Thermiques 20-21ange nathanael kakouPas encore d'évaluation
- CTRL Rattr 2017 SB Th2 VF1Document4 pagesCTRL Rattr 2017 SB Th2 VF1Aminos MaPas encore d'évaluation
- MDF CompressibleDocument14 pagesMDF CompressibleАпцгдк Ьфш БгднчллPas encore d'évaluation
- Stirling Motor PDFDocument9 pagesStirling Motor PDFomar el ghamriPas encore d'évaluation
- A. Applications Des Principes de La Thermodynamique: A. I. Étude Des Systèmes FermésDocument14 pagesA. Applications Des Principes de La Thermodynamique: A. I. Étude Des Systèmes FermésMihnea GamanPas encore d'évaluation
- Série #2 - S4 2021 - SolutionDocument9 pagesSérie #2 - S4 2021 - SolutionEsperance TchibindaPas encore d'évaluation
- 06 Cours Master Turbine A GazDocument8 pages06 Cours Master Turbine A GazimenePas encore d'évaluation
- Série N°1 - CorrigéeDocument7 pagesSérie N°1 - CorrigéeFatima Zohra El GharbaouiPas encore d'évaluation
- Machines Thermiques I - SérieTD 2023Document3 pagesMachines Thermiques I - SérieTD 2023El alaoui Fatimazahrae0% (1)
- 2 Principe PDFDocument4 pages2 Principe PDFAnonymous 80p9OVPas encore d'évaluation
- TD Premier Deuxieme PrincipesDocument5 pagesTD Premier Deuxieme Principessamim1971Pas encore d'évaluation
- TD01 Calorifugeage Enoncé Et CorrigéDocument5 pagesTD01 Calorifugeage Enoncé Et Corrigémohammed medPas encore d'évaluation
- Travaux Dirigés de Transferts Thermiques 21-22Document4 pagesTravaux Dirigés de Transferts Thermiques 21-22ange nathanael kakouPas encore d'évaluation
- Exo ThermoDocument13 pagesExo ThermoSeydouba BANGOURAPas encore d'évaluation
- PyrolyseDocument77 pagesPyrolysehmidiameurPas encore d'évaluation
- Poly SV3 Biophysique 2023Document26 pagesPoly SV3 Biophysique 2023CHAIMAE AFIF100% (1)
- Cours 02 - Diode Et DEL EleveDocument6 pagesCours 02 - Diode Et DEL EleveBrah SaminouPas encore d'évaluation
- Evaluation Encadreme, T Du 06 05 22 PC Tle DDocument4 pagesEvaluation Encadreme, T Du 06 05 22 PC Tle DFadila OuattaraPas encore d'évaluation
- TleD PHY L10 Auto InductionDocument11 pagesTleD PHY L10 Auto InductionGniguin Yasmine OuattaraPas encore d'évaluation
- P 790 FR tcm13 6778Document11 pagesP 790 FR tcm13 6778Rafraf EzdinePas encore d'évaluation
- Thorn Europhane PDFDocument180 pagesThorn Europhane PDFYao SanianPas encore d'évaluation
- DC - DC ChoppersDocument18 pagesDC - DC Choppersrasta aloe vera100% (1)
- Dipole RC 2bacfr Prof - Sbiro (WWW - Pc1.ma)Document6 pagesDipole RC 2bacfr Prof - Sbiro (WWW - Pc1.ma)lahcen essPas encore d'évaluation
- M Elec - Mec 2020 06Document104 pagesM Elec - Mec 2020 06faroukPas encore d'évaluation
- DM 1 Potentiel Chimique Diagrammes BinairesDocument3 pagesDM 1 Potentiel Chimique Diagrammes BinairesDonguiPas encore d'évaluation
- Plan Developpement MT 2016-2026Document6 pagesPlan Developpement MT 2016-2026zineddine regadPas encore d'évaluation
- Gids Installation de Refrigeration FRDocument15 pagesGids Installation de Refrigeration FRRivo RoberalimananaPas encore d'évaluation
- Thermo App - Chap2Document33 pagesThermo App - Chap2Fatima Zahra ChakirPas encore d'évaluation
- Exercices HacheurDocument3 pagesExercices HacheurelbachPas encore d'évaluation
- IT10160DDocument2 pagesIT10160DRalf MaurerPas encore d'évaluation
- Comité D'entreprise Européen Du Groupe EDF: Janvier 2013Document4 pagesComité D'entreprise Européen Du Groupe EDF: Janvier 2013api-180860423Pas encore d'évaluation
- VK 36-4-1 XeDocument22 pagesVK 36-4-1 XeMarin VlahovićPas encore d'évaluation
- BAC Math Tunisie 2015 Corrections de La Session ControleDocument17 pagesBAC Math Tunisie 2015 Corrections de La Session ControleChafik AhmadiPas encore d'évaluation
- Equations de LAGRANGEDocument66 pagesEquations de LAGRANGEaaaboudaPas encore d'évaluation
- TP11 Gradateurs Mono Et Tri 2Document2 pagesTP11 Gradateurs Mono Et Tri 2mhys3710Pas encore d'évaluation
- Avant Projet 1Document5 pagesAvant Projet 1Søü Søü TaPas encore d'évaluation
- Serenity 150 Manuel Utilisateur FR V2Document10 pagesSerenity 150 Manuel Utilisateur FR V2angelbuenoherasPas encore d'évaluation
- Poly TD L1 Optique SPM 2014-2015 PDFDocument48 pagesPoly TD L1 Optique SPM 2014-2015 PDFAbdelkader Faklani DouPas encore d'évaluation
- الفرض الثالث مادة اللغة الفرنسية المستوى السادس -النموذج 7 -موقع اسهام تربويDocument4 pagesالفرض الثالث مادة اللغة الفرنسية المستوى السادس -النموذج 7 -موقع اسهام تربويsanaa.hamaliiPas encore d'évaluation
- La Géopolitique de La RussieDocument19 pagesLa Géopolitique de La RussieYassinePas encore d'évaluation