Académique Documents
Professionnel Documents
Culture Documents
2019 Asie Exo3 Correction Formaldehyde 5pts
2019 Asie Exo3 Correction Formaldehyde 5pts
Transféré par
ahmedmoctarmahmoudCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2019 Asie Exo3 Correction Formaldehyde 5pts
2019 Asie Exo3 Correction Formaldehyde 5pts
Transféré par
ahmedmoctarmahmoudDroits d'auteur :
Formats disponibles
Bac S 2019 Asie http://labolycee.
org
EXERCICE III. LE FORMALDÉHYDE : UN POLLUANT DOMESTIQUE (5 points)
1. À propos du formaldéhyde
1.1. (Le formaldéhyde CH2O fait partie de la famille des aldéhydes, il possède un groupe
carbonyle.)
H–C–H méthanal
||
O
1.2. Le spectre présente les pics caractéristiques de la famille des aldéhydes à savoir :
- un pic relatif à la liaison C=O entre 1720 et 1740 cm–1,
- un pic relatif aux liaisons Ctri–H entre 2700 et 2900 cm-1.
Remarque : lorsqu’un atome de carbone est lié à trois autres atomes on dit qu’il est trigonal : Ctri.
2. Dosage du formaldéhyde dans un solide par spectrophotométrie
2.1. En chauffant, la température augmente ; or la température est un facteur cinétique. Ce
chauffage permet de réduire la durée de la transformation entre l’acide chromotropique et le
formaldéhyde.
2.2. Le spectrophotomètre est réglé de telle sorte que le composé coloré B absorbe un maximum
de lumière. S’il absorbe préférentiellement la radiation de longueur d’onde λ = 580 nm, alors il
apparaît de la couleur complémentaire qui est diamétralement opposée sur le cercle
chromatique fourni.
Le composé B est de couleur violette ou bleu-violette.
2.3. Chaque échantillon contient V0 = 0,3 mL d’acide chromotropique de concentration massique
minimale notée Cm0.
m Cm 0 .V0
On peut exprimer la quantité de matière d’acide chromotropique : nchro = = .
M Mchro
L’échantillon témoin le plus concentré contient V = 3,0 mL de solution à Cm = 5,0 mg/L en
formaldéhyde.
C .V
Soit une quantité de matière de formaldéhyde : nfor = m .
Mfor
D’après l’équation de la réaction chimique, il faut 2 mol d’acide chromotropique pour consommer
1 mol de formaldéhyde, ainsi pour que les réactifs soient en proportions stœchiométriques, il faut
n
que chro = nfor .
2
Cm 0 .V0 C .V
= m
2Mchro Mfor
2Mchro .Cm .V
Cm 0 =
Mfor .V0
2 320 5,0 3,0
Cm 0 = = 1067 mg/L, en ne conservant que deux chiffres significatifs (en toute
30 0,3
rigueur 1 seul…), on obtient Cmo = 1,1 g/L.
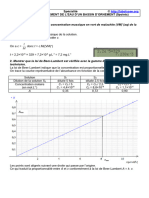
2.4. Exploitation du dosage
2.4.1. Une feuille de papier millimétré n’étant pas fournie avec le sujet, il est difficile de tracer la
courbe d’étalonnage (courant dans les sujets de BAC).
A
On peut vérifier que la loi de Beer-Lambert A = k.Cm est vérifiée en calculant le rapport k =
Cm
pour chaque mesure.
Cm 0 0,1 0,5 2,0 3,0 5,0
A 0 0,03 0,17 0,67 1,00 1,67
A
k= 0,03 0,17 0,67 1,00 1,67
Cm = 0,3 = 0,34 = 0,335 = 0,33 = 0,334
-1
0,1 0,5 2 3,0 5,0
(L.mg )
On vérifie que ce rapport est quasiment constant.
On calcule la moyenne k = (0,3+0,34+0,335+0,333+ 0,334) /5 = 0,328 L.g-1
A 1,34
Pour le filtrat, A = 1,34 or Cm = donc Cm = = 4,1 mg.L−1 de formaldéhyde
k 0,328
2.4.2. La norme E1 impose une teneur inférieure ou égale à 8 mg pour 100 g de matériau.
L’expérience a été réalisée avec 30,0 g de matériau broyé dans 300 mL d’eau.
Calculons la masse m30 de formaldéhyde présente dans le filtrat de 300 mL.
m30= Cm.V
m30 = 4,1×0,300 = 1,2 mg de formaldéhyde pour 30,0 g de matériau.
Par proportionnalité, on peut calculer la teneur dans 100 g de matériau.
1,2 mg → 30,0 g
m100 ? → 100 g
m100 = 1,2×100 / 30,0 = 4,1 mg
L’échantillon possède une teneur inférieure à 8 mg, il respecte la norme E 1.
Vous aimerez peut-être aussi
- TD 1 Avec Corrigé de Chimie Des SolutionsDocument6 pagesTD 1 Avec Corrigé de Chimie Des SolutionsETUSUP100% (3)
- PC GENE 014 CORRECTION Exo1 Chi BleuMBeer - 0Document3 pagesPC GENE 014 CORRECTION Exo1 Chi BleuMBeer - 0Amine DelmiPas encore d'évaluation
- Corrigé+sDocument7 pagesCorrigé+sMOHAMMEDMEJDOUBI100% (2)
- Inbound 5566480752698915028Document11 pagesInbound 5566480752698915028BouchraPas encore d'évaluation
- 2018 AmSud Exo2 Correction ChewingGumFraise 9pts 2Document3 pages2018 AmSud Exo2 Correction ChewingGumFraise 9pts 2Kabinet CamaraPas encore d'évaluation
- Copie de TP AdsorptionDocument7 pagesCopie de TP AdsorptionFerahtia HindPas encore d'évaluation
- 2017 Metropole Exo3 Spe Correction 5ptsDocument2 pages2017 Metropole Exo3 Spe Correction 5ptsantoineheude78Pas encore d'évaluation
- L3 TAA Toutes Les Series TD TABCorrigésDocument27 pagesL3 TAA Toutes Les Series TD TABCorrigésIbtissam HmPas encore d'évaluation
- Serie 0 P71 CorrDocument2 pagesSerie 0 P71 CorrMy profilePas encore d'évaluation
- Adsorption Du de Méthylène Sur La Sciure de Bois FinDocument10 pagesAdsorption Du de Méthylène Sur La Sciure de Bois Finعبد الكريمPas encore d'évaluation
- Adsorption Du de Méthylène Sur La Sciure de Bois FinDocument10 pagesAdsorption Du de Méthylène Sur La Sciure de Bois Finhamza layachi100% (6)
- Corrige Serie 1Document2 pagesCorrige Serie 1nouhaouali11100% (1)
- Correction DST12015 16Document4 pagesCorrection DST12015 16cavabPas encore d'évaluation
- DS2 Molécules AbsorbanceDocument4 pagesDS2 Molécules AbsorbanceFlorence Clerc ZaninPas encore d'évaluation
- TD 1 - UV Vis 2020-ConvertiDocument2 pagesTD 1 - UV Vis 2020-ConvertihadilPas encore d'évaluation
- Correction Absorption RayonnementsDocument2 pagesCorrection Absorption Rayonnementsbienvenuetumbae3Pas encore d'évaluation
- Corrigé de La Série Des Exercices 3eme Chime OrganiqueDocument5 pagesCorrigé de La Série Des Exercices 3eme Chime Organiquekadere83Pas encore d'évaluation
- td1 SMPC s2Document7 pagestd1 SMPC s2Mohamed Ait KabirPas encore d'évaluation
- Série 1 Ingemat-Tacqi - 2020-21-1Document9 pagesSérie 1 Ingemat-Tacqi - 2020-21-1Andrés Tobías Mba MICHA ALENEPas encore d'évaluation
- Série TD N°2 Chimie Des Surfaces Plus CorrectionDocument10 pagesSérie TD N°2 Chimie Des Surfaces Plus CorrectionKawthar100% (7)
- Correction de Serie Dexercices 1Document4 pagesCorrection de Serie Dexercices 1LAHCIENE ELHOUCINEPas encore d'évaluation
- TP PSC Final1Document12 pagesTP PSC Final1Malek SaidaouiPas encore d'évaluation
- Gym ch2df Auto Corr14Document2 pagesGym ch2df Auto Corr14Robinou ÀlvaroPas encore d'évaluation
- Annalee 214Document16 pagesAnnalee 214Zineb KhadranePas encore d'évaluation
- Annale Chimie 1Document16 pagesAnnale Chimie 1Sinem SinemPas encore d'évaluation
- 1Document6 pages1leilalargate_3780929Pas encore d'évaluation
- TM1 TP2 Les Bonbons Schtroumpf CDocument2 pagesTM1 TP2 Les Bonbons Schtroumpf ClenormandPas encore d'évaluation
- PC GENE 014 SUJET Exo1 Chi BleuMBeerDocument3 pagesPC GENE 014 SUJET Exo1 Chi BleuMBeerElias AthanassiadisPas encore d'évaluation
- Corrigé Des Contrôles de Thermodynamique Chimique S4 2012-2019Document120 pagesCorrigé Des Contrôles de Thermodynamique Chimique S4 2012-2019Mohamed Ait alla100% (1)
- Copie de Hicham Isotherme D'adsorptionDocument13 pagesCopie de Hicham Isotherme D'adsorptioncélia ferPas encore d'évaluation
- Correction DS N°1 SpécialitéDocument2 pagesCorrection DS N°1 Spécialitédavid Bentouza100% (1)
- CR TP EauDocument7 pagesCR TP Eau[AE]Pas encore d'évaluation
- Devoir de Sciences Physiques N°4: Exercice 1: Dosage D'un CollyreDocument5 pagesDevoir de Sciences Physiques N°4: Exercice 1: Dosage D'un CollyreRyan BoucettaPas encore d'évaluation
- TP1 AdsorptionDocument8 pagesTP1 AdsorptionTaouti Mohamed BelkacemPas encore d'évaluation
- 95p3w td1Document4 pages95p3w td1abdellah elghebouli100% (1)
- TD 1Document4 pagesTD 1Abdou HajjajiPas encore d'évaluation
- TD RedoxDocument3 pagesTD RedoxBamonPas encore d'évaluation
- TP Charbon ActifDocument9 pagesTP Charbon Actifasma amira nadoulPas encore d'évaluation
- Correction Des ExercicesDocument4 pagesCorrection Des ExercicesR2K100% (1)
- Corrige Td1 Uv Visible TsaDocument5 pagesCorrige Td1 Uv Visible TsaELAssaliAziz100% (4)
- Compte Rednu Du TP 122-2Document9 pagesCompte Rednu Du TP 122-2asma amira nadoulPas encore d'évaluation
- 2011 11 Amsud Exo3 Correction DosageEtalonnageAlu 4ptsDocument2 pages2011 11 Amsud Exo3 Correction DosageEtalonnageAlu 4ptsAmina EnnPas encore d'évaluation
- Chap N 6C ELEVE Exercices Conductimetrie Correction 0Document3 pagesChap N 6C ELEVE Exercices Conductimetrie Correction 0Samira ElAllaoui100% (2)
- TP GDH BonDocument8 pagesTP GDH Bonnhu19Pas encore d'évaluation
- Es1 CorrectionDocument2 pagesEs1 CorrectionShirley HePas encore d'évaluation
- Exercice 1Document56 pagesExercice 1la physique selon le programme Français100% (1)
- Chimie TP5 Quotient de ReactionDocument2 pagesChimie TP5 Quotient de Reactionoxford33Pas encore d'évaluation
- DS 3 B - CorrigéDocument11 pagesDS 3 B - Corrigéhedidbz38Pas encore d'évaluation
- TP 2 Tda l3 Gdp-1Document3 pagesTP 2 Tda l3 Gdp-1Mål ÆkPas encore d'évaluation
- Calcul Du Surface Specifique Et de Masse Volumique ReelDocument3 pagesCalcul Du Surface Specifique Et de Masse Volumique ReelAmine MHPas encore d'évaluation
- TP 2 Tda L3 GDPDocument3 pagesTP 2 Tda L3 GDPMål ÆkPas encore d'évaluation
- Université Batna 2 Département D'électroniqueDocument4 pagesUniversité Batna 2 Département D'électroniqueAbdealaziz BouhoreiraPas encore d'évaluation
- Série TD 1Document3 pagesSérie TD 1Čœür Dê MįēlPas encore d'évaluation
- 1ers DS3 Corrigé Chap 5 Et 6Document3 pages1ers DS3 Corrigé Chap 5 Et 6imane.asbai.23Pas encore d'évaluation
- Spécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Document7 pagesSpécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Mamadou Lamine NianePas encore d'évaluation
- Exo 1S ConductimetrieDocument1 pageExo 1S ConductimetriePatrick RAzafimahaleoPas encore d'évaluation
- Corrigé de La Serie1.SMPC by ExoSupDocument6 pagesCorrigé de La Serie1.SMPC by ExoSupPedro Redréguez Doctorant MeiPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Introduction A La Thermodynamique IndustrielleDocument8 pagesIntroduction A La Thermodynamique Industriellehadil.souafPas encore d'évaluation
- Électricité Calcul Diamètre FilDocument5 pagesÉlectricité Calcul Diamètre FilDidier FiotPas encore d'évaluation
- Doc1 Energie ADocument15 pagesDoc1 Energie AOUMAIMA CHIBANEPas encore d'évaluation
- TP BioDocument2 pagesTP BiojhgytrezPas encore d'évaluation
- Exercices Moment Force Bep Industriel PDFDocument4 pagesExercices Moment Force Bep Industriel PDFMohamedLabiodPas encore d'évaluation
- CHAPITR2Document8 pagesCHAPITR2maachi imad eddinePas encore d'évaluation
- tp17 Synthese Savon PDFDocument5 pagestp17 Synthese Savon PDFDelano TseffPas encore d'évaluation
- 4 Liaison ChimiqueDocument8 pages4 Liaison ChimiqueAzumi ChanPas encore d'évaluation
- 23 1spe G dst1BDocument3 pages23 1spe G dst1BnasrotesnimePas encore d'évaluation
- LG - WKEX200HBA (Laveuse+Sécheuse Wash Tower)Document108 pagesLG - WKEX200HBA (Laveuse+Sécheuse Wash Tower)TheArrow53Pas encore d'évaluation
- Actes Adoptés Par Des Instances Créées Par Des Accords InternationauxDocument90 pagesActes Adoptés Par Des Instances Créées Par Des Accords InternationauxzannierdenisPas encore d'évaluation
- Synthèse Bts MSDocument6 pagesSynthèse Bts MSspectrum66Pas encore d'évaluation
- Solaire PhotovoltaiqueDocument46 pagesSolaire Photovoltaiquei k100% (1)
- Diapo Cours - MF - Froid Industriel - ENSAM - 2020-21 - Partie-1 - Généralités - V4 - SuiteDocument25 pagesDiapo Cours - MF - Froid Industriel - ENSAM - 2020-21 - Partie-1 - Généralités - V4 - SuitehfjbbhjbPas encore d'évaluation
- Chimie de SurDocument57 pagesChimie de SurLaiadhi DjemouiPas encore d'évaluation
- Nomenclature Modules MIP BCGDocument2 pagesNomenclature Modules MIP BCGJounid AyoubPas encore d'évaluation
- Cours STU4-20-21Document94 pagesCours STU4-20-21AHMED HAMDIPas encore d'évaluation
- BBA - Chapitre 1 Et 2 Chimie Organique - Bahloul Ahmed - L2Document16 pagesBBA - Chapitre 1 Et 2 Chimie Organique - Bahloul Ahmed - L2Imene Aoun SeghirPas encore d'évaluation
- TD 31 PhysStatDocument3 pagesTD 31 PhysStatAIMAD ESSAKHIPas encore d'évaluation
- Cours Isolation ThermiqueDocument32 pagesCours Isolation ThermiqueSebastien MENARDPas encore d'évaluation
- UV VisibleDocument15 pagesUV VisibleAli ZouaouiPas encore d'évaluation
- + L'épuration Biologique Des EauxDocument153 pages+ L'épuration Biologique Des EauxAstronaute Ahmed50% (2)
- Fiche de TD 2Document2 pagesFiche de TD 2assanePas encore d'évaluation
- Titrage Conductim TriquegDocument4 pagesTitrage Conductim Triquegsidi mohamed el amine nekkalPas encore d'évaluation
- La Reproduction Chez Les AngiospermesDocument2 pagesLa Reproduction Chez Les AngiospermesAabid AdilPas encore d'évaluation
- QuesAn3 QuesAn3 - Rapport de Laboratoire # 1Document3 pagesQuesAn3 QuesAn3 - Rapport de Laboratoire # 1Yeg HenPas encore d'évaluation
- Activité Réaction NucléaireDocument4 pagesActivité Réaction NucléairesdfghjPas encore d'évaluation
- Devoir de Physique - Chimie TC 1Document3 pagesDevoir de Physique - Chimie TC 1Christophe NemlinPas encore d'évaluation
- Emissivite Materiaux PDFDocument6 pagesEmissivite Materiaux PDFNQT243Pas encore d'évaluation
- Serie La Gravitation Universelle TCSbiofDocument2 pagesSerie La Gravitation Universelle TCSbiofmeriem elhina100% (1)