Académique Documents
Professionnel Documents
Culture Documents
AD22 Spectroscopie IR-4
Transféré par
mustapha a0 évaluation0% ont trouvé ce document utile (0 vote)
42 vues3 pagesTitre original
AD22 spectroscopie IR-4
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
42 vues3 pagesAD22 Spectroscopie IR-4
Transféré par
mustapha aDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 3
Spé1ere Activité: La spectroscopie infrarouge – panique au laboratoire
Kylian travaille dans un laboratoire de chimie. Il souhaite faire du rangement et remarque trois flacons dont
les étiquettes sont partiellement effacées. Il réalise alors le spectre infrarouge des trois flacons inconnus
pour les identifier.
Problème posé : Attribuer à chaque flacon son étiquette.
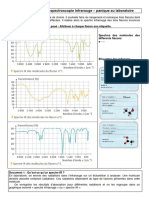
Spectres des molécules des
différents flacons
Etiquettes des 3 flacons
Document 1 : Qu’est-ce qu’un spectre IR ?
En laboratoire, on envoie des radiations dans l’infrarouge sur un échantillon à analyser. Une molécule
donnée absorbe certaines radiations. Ces radiations dépendent du type de liaisons présentes dans cette
molécule.
On enregistre les résultats d’absorption pour différentes radiations et on les regroupe dans un
graphique nommé « spectre infrarouge » ou « spectre IR ».
En ordonnée figure la transmittance T ou intensité lumineuse transmise par l’échantillon analysé. Cette
transmittance s’exprime en pourcentage. En abscisse est porté le nombre d’ondes σ, inverse de la
longueur d’onde, exprimé en cm-1.
Un spectre IR renseigne sur la nature des liaisons présentes dans la molécule : les bandes
d’absorption associées à chacune des liaisons rencontrées en chimie organique correspondent à un
domaine de nombre d’ondes bien précis.
Doc 1 Spectre IR du pentane
On distingue deux zones dans un spectre IR :
Nombre d’ondes compris entre 1500 et 4000 cm-1 : ne contient qu’un nombre limité de bandes
correspondant à des types de liaisons particuliers.
Nombre d’ondes compris entre 400 et 1500 cm-1 : est une zone très riche en bandes d’absorption
(relatives à la liaison C-C) pour les molécules organiques possédant plusieurs atomes de carbone.
Elle n’est généralement pas exploitée : c’est l’empreinte digitale de la molécule.
Document 2 : spectres IR de quelques liaisons
Travail :
Comprendre un spectre IR
1) Que signifie une transmittance de 100% ? de 0 % ? Justifier alors pourquoi les bandes d’absorption
d’un spectre IR pointent vers le bas.
2) Vérifier que le spectre IR fourni ci-dessus a bien été réalisé à des longueurs d’onde appartenant au
domaine de l’IR.
3) Ecrire la formule développée du pentane.
4) D’après vous, à quelle liaison correspond la bande d’absorption située à 3000 cm-1 ?
Reconnaissances de quelques liaisons
Au doc2 sont représentés les spectres IR de quatre composés.
1) En comparant ces différents spectres, identifier la nature de la liaison responsable de la bande
d’absorption commune à tous les spectres. Est-ce cohérent avec votre réponse à la question I.4 ?
2) Déduire de la comparaison des spectres les valeurs approchées des nombres d’onde caractéristiques
des absorptions relatives aux liaisons C-H ; C=O et O-H. Rassembler vos résultats dans le tableau ci-
dessous.
Préciser dans chaque cas, si la bande d’absorption est fine ou large.
O-H O-H
Liaison C-H C=O (en phase (en phase
gazeuse) liquide)
Nombre d’onde (en cm-1)
Largeur de la bande
(fine ou large ?)
Spectre(s) et bande(s)
correspondantes
Ci-dessous est représenté le spectre IR du butan-1-ol en phase gazeuse et en phase liquide.
3) Quelle est l’influence de l’état physique de l’échantillon sur la bande d’absorption attribuée à la
liaison O-H ? Compléter la dernière colonne du tableau précédent.
4) Quelle interaction, présente en phase condensée mais peu ou pas en phase gazeuse, pourrait être
à l’origine de ce phénomène ?
Phase liquide phase gazeuse
Réponse au problème posé
1) Compléter chaque étiquette donnée en introduction..
2) Recopier chaque formule semi-développée. Entourer et nommer les groupes
caractéristiques. Préciser la famille fonctionnelle de chaque molécule.
3) A l’aide des modèles moléculaires, préciser la géométrie autour de l’atome de carbone
fonctionnel (c’est-à-dire l’atome de carbone qui porte le groupe caractéristique).
4) Aider Kylian dans l’identification des trois flacons.
Pour s’entraîner faire: ex 16 p 132
Vous aimerez peut-être aussi
- TP19-Spectroscopie IRDocument4 pagesTP19-Spectroscopie IRSouhila Benkhaled100% (1)
- Chapitre 7 Spectroscopie InfrarougeDocument8 pagesChapitre 7 Spectroscopie InfrarougeRafael V. Tolentino HdzPas encore d'évaluation
- 2.spectres Infrarouge PDFDocument6 pages2.spectres Infrarouge PDFkimmik100% (1)
- PR Charef N Cours 1 Physicochimique Des MacromoléculesDocument14 pagesPR Charef N Cours 1 Physicochimique Des MacromoléculesMiskine FilsPas encore d'évaluation
- Analyse de Spectres Ir Et RMN: Capacité(s) Contextualisée(s) Mise(s) en Jeu Durant L'activitéDocument15 pagesAnalyse de Spectres Ir Et RMN: Capacité(s) Contextualisée(s) Mise(s) en Jeu Durant L'activitéOualid EzzaharPas encore d'évaluation
- Chapitre 3 Spectroscopie Infrarouge (IR)Document8 pagesChapitre 3 Spectroscopie Infrarouge (IR)Hocine Amrane100% (1)
- Lycee Louis Payen ReunionDocument12 pagesLycee Louis Payen ReunionAnasPas encore d'évaluation
- Eoc 1-1Document4 pagesEoc 1-1WilfriedPas encore d'évaluation
- Chapitre IVDocument8 pagesChapitre IVIma NePas encore d'évaluation
- Ts Chi 9 Spectro IrDocument6 pagesTs Chi 9 Spectro IrSoulef ZemzoumPas encore d'évaluation
- Cours IR TableauxDocument27 pagesCours IR TableauxMojinPas encore d'évaluation
- TD1-6 SMDocument7 pagesTD1-6 SMمريم الإسبانيهPas encore d'évaluation
- TP 2 Analyse ChimiqueDocument3 pagesTP 2 Analyse ChimiqueNadji Fenichi100% (1)
- TP3 Spectro PDFDocument34 pagesTP3 Spectro PDFtktmec57Pas encore d'évaluation
- 4 SpectrometrieDocument50 pages4 SpectrometriedoncuolyPas encore d'évaluation
- Fiche TD 2 IR PDFDocument2 pagesFiche TD 2 IR PDFIk RamPas encore d'évaluation
- Expose CHM 3146 Groupe 1-3Document29 pagesExpose CHM 3146 Groupe 1-3GERVAIS AZANGA AYISSIPas encore d'évaluation
- Ch4 Analyse SpectraleDocument7 pagesCh4 Analyse SpectraleLahoucine GhourchanePas encore d'évaluation
- Cour 3-Spectrophotométrie IR20-21Document6 pagesCour 3-Spectrophotométrie IR20-21youcef benaissaPas encore d'évaluation
- Tapc IrDocument9 pagesTapc IrVeronika PrymPas encore d'évaluation
- Sommaire 2. But de L'expérience. 3. Principe.: 1. Interaction Rayonnement-MatièreDocument20 pagesSommaire 2. But de L'expérience. 3. Principe.: 1. Interaction Rayonnement-Matièreghamoudraid90Pas encore d'évaluation
- Cours - IRDocument41 pagesCours - IRيوسف حجوPas encore d'évaluation
- Identification Des Molecules Organiques Par Spectroscopie IrDocument3 pagesIdentification Des Molecules Organiques Par Spectroscopie IrpuyoPas encore d'évaluation
- Chap2-Analyser Un Systeme Chimique Par Des Methodes Physiques EleveDocument7 pagesChap2-Analyser Un Systeme Chimique Par Des Methodes Physiques Eleve659k4n59nxPas encore d'évaluation
- M2 Agroécologie Cours Méthodologie Expérimentale 1Document27 pagesM2 Agroécologie Cours Méthodologie Expérimentale 1Aisaoua BuobouPas encore d'évaluation
- Fiche TD 2 MPCA 2023 2024Document4 pagesFiche TD 2 MPCA 2023 2024Clash of Clans Bilal DzPas encore d'évaluation
- Cours N4 C511 (Méthodes D'analyse I) - 221021 - 225546Document28 pagesCours N4 C511 (Méthodes D'analyse I) - 221021 - 225546Jaafar ChirigPas encore d'évaluation
- LICENCE PROFESSIONNELLE INDUSTRIES CHIMIQUES ET PHARMACEUTIQUES Option DM PDFDocument9 pagesLICENCE PROFESSIONNELLE INDUSTRIES CHIMIQUES ET PHARMACEUTIQUES Option DM PDFTaouil MohamedPas encore d'évaluation
- Chapitre 7 Suite Et FinDocument5 pagesChapitre 7 Suite Et Findjaelaudinet67Pas encore d'évaluation
- Cours D'infra RougeDocument8 pagesCours D'infra RougeRã DîäPas encore d'évaluation
- Cours Chap.2 Spectrométrie InfrarougeDocument16 pagesCours Chap.2 Spectrométrie InfrarougeAissa TlbPas encore d'évaluation
- 05 Spectroscopie Dans UltravioletDocument6 pages05 Spectroscopie Dans UltravioletBibi BibaPas encore d'évaluation
- Ta Chap 3Document28 pagesTa Chap 3islam ooPas encore d'évaluation
- Rapport L3Document10 pagesRapport L3Amina BenPas encore d'évaluation
- UV VisibleDocument15 pagesUV VisibleAli ZouaouiPas encore d'évaluation
- TP C3: Spectrophotometrie: Capacités ExigiblesDocument5 pagesTP C3: Spectrophotometrie: Capacités Exigiblesimene ali smailPas encore d'évaluation
- PC Physique CCP 2 2005.extraitDocument4 pagesPC Physique CCP 2 2005.extraitNada HhsPas encore d'évaluation
- Cours TA IRDocument4 pagesCours TA IRNourelhouda AbdelazizPas encore d'évaluation
- DS 1 S1 - 2SP BIOF Prof - Razkaoui (WWW - Pc1.ma)Document3 pagesDS 1 S1 - 2SP BIOF Prof - Razkaoui (WWW - Pc1.ma)douaarachid2006rajaPas encore d'évaluation
- DS 1 S1 - 2SP BiofDocument3 pagesDS 1 S1 - 2SP BiofBa HassanPas encore d'évaluation
- RamanDocument39 pagesRamanrodrigue yan100% (1)
- L'absorbance Comment Rendre Sa Compréhension Plus Lumineuse Aux Yeux Des Apprenant - EsDocument17 pagesL'absorbance Comment Rendre Sa Compréhension Plus Lumineuse Aux Yeux Des Apprenant - EsMezouar AbdennacerPas encore d'évaluation
- Syn 5Document5 pagesSyn 5Hisham Nice-lionPas encore d'évaluation
- Comprendre La Spectroscopie Infrarouge Principes eDocument7 pagesComprendre La Spectroscopie Infrarouge Principes eChabane HamegPas encore d'évaluation
- TD O4 Spectroscopie IR Et RMNDocument8 pagesTD O4 Spectroscopie IR Et RMNMEed E-tanPas encore d'évaluation
- COURS SPECTROSCOPIEdocxDocument25 pagesCOURS SPECTROSCOPIEdocxAboubacar Sidiky TraoréPas encore d'évaluation
- SPC TLDocument15 pagesSPC TLNemir MimirPas encore d'évaluation
- Cours DRX 2Document8 pagesCours DRX 2Houda MaâtiPas encore d'évaluation
- Spectroscopie IR 3Document45 pagesSpectroscopie IR 3hind bioPas encore d'évaluation
- CHM 3146 - Récapitulatif Des TechniquesDocument36 pagesCHM 3146 - Récapitulatif Des Techniquesmichelakon1Pas encore d'évaluation
- TP 1, 2 Et 3 Méthodes PH CH D'analyseDocument8 pagesTP 1, 2 Et 3 Méthodes PH CH D'analyseTaki EddinePas encore d'évaluation
- La Spectrophotomètrie InfrarougeDocument21 pagesLa Spectrophotomètrie Infrarougefellah aminaPas encore d'évaluation
- Exos4 Optique1Document7 pagesExos4 Optique1Hamza benjouadPas encore d'évaluation
- II Spectroscopie Uv Visible EnonceDocument4 pagesII Spectroscopie Uv Visible Enonceelhidhab2014Pas encore d'évaluation
- Série TD N°2 2019-2020Document2 pagesSérie TD N°2 2019-2020Samar ZedamPas encore d'évaluation
- Série TD N°2 2019-2020-1Document2 pagesSérie TD N°2 2019-2020-1Malki imanePas encore d'évaluation
- Support Cours SPECTRO UV VISIBLE 2022 2023Document31 pagesSupport Cours SPECTRO UV VISIBLE 2022 2023qabilelaiyachi2000Pas encore d'évaluation
- Cours Complet Chap7Document25 pagesCours Complet Chap7mustapha aPas encore d'évaluation
- DS4 3Document3 pagesDS4 3mustapha aPas encore d'évaluation
- Act 5 Production D Électricité Sans Combustion-2Document3 pagesAct 5 Production D Électricité Sans Combustion-2mustapha aPas encore d'évaluation
- NomenclatureDocument2 pagesNomenclaturemustapha aPas encore d'évaluation
- Act 2 Niveaux Dintensité Sonore CORRECTIONDocument5 pagesAct 2 Niveaux Dintensité Sonore CORRECTIONmustapha aPas encore d'évaluation
- 1er S - DS 4 - Chap 7 Et 8Document2 pages1er S - DS 4 - Chap 7 Et 8mustapha aPas encore d'évaluation
- TPN°2 Transformateur Mono 2023Document8 pagesTPN°2 Transformateur Mono 2023mustapha aPas encore d'évaluation
- Polycopié de Cours Bentabet NesrineDocument90 pagesPolycopié de Cours Bentabet NesrineJoseph 27Pas encore d'évaluation
- Interaction Rayons X MatièreDocument30 pagesInteraction Rayons X Matièreisam-eddine.babouriPas encore d'évaluation
- Spectro Kmno4Document1 pageSpectro Kmno4sihem ayadiPas encore d'évaluation
- AD22 Spectroscopie IR-4Document3 pagesAD22 Spectroscopie IR-4mustapha aPas encore d'évaluation
- Effet PhotoélectriqueDocument14 pagesEffet Photoélectriquealibeats44Pas encore d'évaluation
- I - Spectres Atomiques: Sources LumineusesDocument6 pagesI - Spectres Atomiques: Sources Lumineusesmabroukanas69Pas encore d'évaluation
- Icp AesDocument19 pagesIcp AesRim AbouttiPas encore d'évaluation