Académique Documents
Professionnel Documents
Culture Documents
Piles Et Accus
Transféré par
El Mehdi AkhatarCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Piles Et Accus
Transféré par
El Mehdi AkhatarDroits d'auteur :
Formats disponibles
Piles Accumulateurs page1 Claude Lahache
PILES ET ACCUMULATEURS
Piles et accumulateurs sont des gnrateurs lectriques qui stockent lnergie sous forme chimique
et mettent en jeu une raction chimique pour produire de llectricit.
La diffrence fondamentale entre ces 2 types de composants est la rversibilit de cette raction :
- Une pile est dote dun capital nergtique (elle est charge) sa fabrication ;
ce capital est consomm par lutilisation de la pile.
Lorsquil est puis, cette pile est hors dusage (elle est dcharge).
On ne peut que procder son recyclage, afin de rcuprer certains de ses constituants.
- Un accumulateur neuf ne peut en gnral pas produire dlectricit ; il doit dabord tre charg par
lutilisateur (1
re
gnration du capital nergtique, grce une source lectrique extrieure).
Laccumulateur produit ensuite de llectricit en se dchargeant ; quand la dcharge semble maximale, il
peut de nouveau tre recharg pour utilisation ultrieure.
Un accumulateur fonctionne ainsi par cycles de charge dcharge ; sa dure de vie est lie au nombre de
cycles quil peut subir.
- En rsum, la raction chimique au sein dune pile est irrversible, alors quelle est parfaitement rversible
au sein dun accumulateur.
Un bref historique :
Linvention de la pile est attribue Alessandro Volta vers 1800.
Sinspirant des travaux de Luigi Galvani sur la nature lectrique de linflux nerveux (1786), il empila des
disques de zinc et de fer, alterns et spars par des disques de feutrine imbibs deau sale.
La premire pile tait ne !
Le fer rouillant rapidement au contact de leau sale, Volta remplaa les disques de fer par des disques de
cuivre.
Galvani et Volta nanalysaient pas les choses de la mme faon : Pour Galvani, llectricit tait dorigine
animale dans linflux nerveux, alors que pour Volta, elle tait lie la prsence de 2 mtaux diffrents et
dun milieu humide ; les 2 savants avaient en fait tous les 2 raison !!
Le comte Alessandro Volta
(1745 1827)
La pile de Volta
(environ 60 couples de disques cuivre zinc)
Piles Accumulateurs page2 Claude Lahache
Un peu de chimie.
Un courant lectrique correspond un dplacement dlectrons dans un conducteur.
Pour produire chimiquement un tel phnomne, on va mettre en jeu une raction entre 2 espces qui
saccompagne dun change dlectrons. Il ne restera ensuite qu dtourner ces lectrons dans un circuit
extrieur
Une telle raction porte le nom de raction doxydo rduction
La disposition la plus simple consiste en lutilisation de 2 lectrodes faites de 2 mtaux diffrents, M1 et M2.
Ces lectrodes plongent dans un lectrolyte (liquide ou gel renfermant des ions, par exemple des ions des mtaux
constituant les lectrodes)
On vite le mlange des ions des 2 mtaux grce une membrane poreuse
Un voltmtre plac entre les 2 lectrodes dtecte une tension, dont la valeur est lie au choix des 2 mtaux.
Si maintenant on ralise un circuit extrieur, muni dun dtecteur de courant, on constate le passage dun flux
dlectrons, qui saccompagne de ractions aux lectrodes :
Dans notre exemple, des atomes de mtal M2 passent en solution sous forme dions, en librant des lectrons.
On crit, llectrode M2 : M2 M2
P
+
+ pe
-
Ce qui se traduit par : Un atome de mtal M2 donne un cation M2
P
+
ainsi que p lectrons libres
Le mtal M2 a ainsi subi une oxydation (perte dlectrons) ; llectrode correspondante porte le nom danode.
Ces lectrons traversent le circuit extrieur ; arrivs sur llectrode M1, ils ragissent avec des ions du mtal M1,
pour aboutir des atomes mtalliques qui se dposent sur llectrode.
On crit , llectrode M1 : M1
n
+
+ n e
-
M1
Ce qui se traduit par : Un cation du mtal M1 capte n lectrons libres pour donner un atome de
mtal M1.
Les cations du mtal subissent une rduction (gain dlectrons) ; llectrode correspondante est nomme cathode.
Dans le circuit extrieur, le flux dlectrons va de lanode vers la cathode :
Lanode sera le pole ngatif de la pile, la cathode sera son ple positif.
Etant donne la dissolution progressive dune lectrode, on conoit aisment que le capital nergtique de notre
gnrateur lectrochimique soit limit : Le fonctionnement cesse avec la disparition de lanode !
Piles Accumulateurs page3 Claude Lahache
Caractristiques essentielles dune pile.
Forme.
On trouve essentiellement sur le march 3 formats de piles :
Les piles bton les piles rectangulaires les piles bouton (Cf. photo)
Leurs usages sont diffrents : Les piles btons sont destines aux applications pouvant ncessiter des intensits
apprciables mais intermittentes (quelques dizaines de mA ou plus) , comme par exemple dans lclairage portatif.
A linverse, les piles boutons seront ddies la gnration de courants trs faibles, mais pendant la plus longue
dure possible ; cest le cas typique de la pile de montre.
Capacit.
Cest le capital nergtique : La capacit (en Ah) reprsente la charge lectrique que la pile peut mettre en jeu.
Elle est lie aux dimensions et la qualit des produits quelle renferme. Les fabricants de piles sont trs discrets
sur ce paramtre ; il nest possible de donner que des estimations.
LR3 (AAA) : 500 1000 mAh
LR6 (AA) : 1000 2500 mAh
LR20 (D) : 5 20 Ah
Piles bouton : 30 300 mAh
(sources diverses dont Wikipdia, avec les rserves dusage)
Si on ramne la capacit aux dimensions, lnergie massique dune pile se situe entre 100 et 300 Wh / kg ; lnergie
volumique peut tre value 0,25 1,5 Wh / cm
3
.
Tension vide ; tension de service ; courbe de dcharge.
La tension vide est la classique f..m dun gnrateur.
Les valeurs les plus courantes sont 1,5 V pour un lment bton, 1,5 V ou 3 V pour un lment bouton et 9 V pour
les piles rectangulaires telles que celles de la photo ci-dessus.
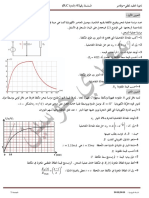
La tension de service de la pile dpend bien sur de lintensit du courant quelle doit dbiter. La caractristique
courant-tension dune pile a lallure suivante :
Le comportement est sensiblement linaire aux faibles dbits (relation classique de type U = E - RI) ; quand le
dbit augmente, la rsistance interne saccrot (phnomne li la cintique des ractions chimiques internes).
On peut retenir que la rsistance interne dune pile bton (aux faibles dbits) est de lordre de quelques diximes
dohms.
Tension (V)
U = E - R I
Courant (A)
0
Piles Accumulateurs page4 Claude Lahache
La courbe de dcharge dune pile reprsente la tension ses bornes en fonction du temps, pour un dbit fix.
Dans lexemple qui suit on a relev cette courbe pour diffrents lments 1,5 V, sur une charge de 4,7 .
En considrant une tension limite de 1 V, lautonomie dun lment R3 atteint environ 1H, celle dun lment R6
un peu plus de 3H, quant llment R14, il peut fonctionner pendant 10H dans ces conditions.
Les piles actuelles.
1. La pile Leclanch (dite pile saline)
Mise au point vers 1866 (brevet) par Georges Leclanch (1839 1892), elle constitue lentre de gamme des piles
btons .
Un lment est caractris par une f..m de 1,5 V.
Lanode (ple -) est en zinc
Llectrolyte est constitu dun gel (amidon) renfermant
du chlorure de zinc et du chlorure dammonium.
La cathode (ple +) comprend un bton de graphite servant
de collecteur de courant, ainsi quun mlange doxyde de
manganse, rendu conducteur par adjonction de poudre de
carbone.
Fonctionnement :
A lanode, le zinc mtal se dissout Zn Zn
2
+
+ 2e
-
Llectrolyte acide permet la rduction du dioxyde de
manganse MnO
2
+ H
+
+ e
-
MnO(OH)
Lquation globale du fonctionnement est ainsi
Zn + 2MnO
2
+ 2H
+
Zn
2+
+ 2MnO(OH)
Inconvnients : La cintique de formation de lhydroxyde de manganse est assez lente ; dans le cas de forts dbits,
il peut y avoir formation intermdiaire dhydrogne gazeux (prsence une chambre de surpression).
Dautre part, le dioxyde de manganse est en dfaut, afin quil disparaisse en totalit avant le zinc, vitant ainsi le
percement du botier ; en consquence, la capacit de cette pile nest pas optimise.
(Lnergie massique de cette pile se situe aux environs de 80 Wh/kg)
chambre de
surpression
Piles Accumulateurs page5 Claude Lahache
2. La pile alcaline .
Initialement mise au point pendant la seconde guerre mondiale par Samuel Ruben et Philipp Rogers Mallory, elle
contenait au dpart du zinc et de loxyde de mercure ; pour sa commercialisation grande chelle (cot de loxyde
mercurique), Ruben reprit les constituants de la pile Leclanch, en modifiant toutefois llectrolyte et lassemblage.
La pile alcaline telle que nous la connaissons est en fait apparue la fin des annes 50 sur le march.
Lanode (ple -) est constitue dun clou en acier
qui plonge dans du zinc en poudre.
(Lemploi de zinc pulvrulent augmente la surface
ractionnelle, et par la mme le dbit maximal
de ce type de pile)
Llectrolyte est basique (alcalin) ; cest un gel de
potasse (KOH).
La cathode est constitue de dioxyde de manganse,
rendu conducteur par de la poudre de carbone.
Le collecteur de courant est form par le boitier
acier de la pile.
Fonctionnement :
A lanode, le zinc soxyde en milieu alcalin Zn + 4OH
-
Zn(OH)
4
2-
+ 2e
-
A la cathode, le dioxyde de manganse est rduit MnO
2
+ H
2
O + e
-
MnO(OH) + OH
Lquation globale du fonctionnement est :
Zn + 2MnO
2
+ 2H
2
O + 2OH
-
Zn(OH)
4
2
-
+ 2MnO(OH)
Avantages par rapport la pile Leclanch :
Capacit et performances suprieures car le zinc en poudre soxyde plus aisment que sous forme de plaque.
La quantit de MnO2 est suprieure volume gal ; lnergie massique est meilleure (environ 100 Wh/kg)
Plus faible autodcharge (3% par an contre 5 6% pour la pile Leclanch, dans les mmes conditions)
Les courbes de dcharge de ces 2 piles diffrent :
(Voir droite lexemple schmatis pour un lment 1,5 V)
Pour la pile Leclanch, la dcharge saccompagne dune
baisse progressive de la tension ses bornes.
Pour la pile alcaline, la tension aux bornes dcrot dabord
jusquenviron 1,2 V, puis elle sy stabilise un certain temps
avant de chuter franchement en fin de vie.
imbibe de potasse
Tension (V)
Temps (s)
1,5
1,2
0
alcaline
Leclanch
Piles Accumulateurs page6 Claude Lahache
Ple ngatif
Anode
Joint isolant
Ple positif
Sparateur
Cathode
(Oxyde dargent)
lectrolyte
(potasse)
Ple positif
Orifice pour passage de lair
Languette de protection
Ple ngatif
Anode (zinc)
Joint isolant
Sparateur
Membrane hydrophobe
Cathode (oxygne)
Papier diffuseur
3. Pile loxyde dargent
Cest une variante de la pile alcaline dans laquelle
la cathode est constitue doxyde dargent (Ag
2
O).
Fonctionnement :
A lanode, le zinc soxyde
Zn + 4OH
-
Zn(OH)
4
2-
+ 2e
-
A la cathode, loxyde dargent est rduit
Ag
2
O + H
2
O + 2e
-
2Ag + 2 OH
-
Do lquation globale
Zn + Ag
2
O + H
2
O + 2OH
-
Zn(OH)
4
2-
+ 2Ag
Cette pile est majoritairement diffuse sous forme bouton.
La tension typique dun lment est denviron 1,55 V.
Lnergie massique est environ 30% suprieure
celle dune pile alcaline (130 Wh/kg contre
100 Wh/kg pour une alcaline)
En rgime de dcharge, la tension disponible reste
remarquablement constante,pratiquement jusqu
la fin de vie de la pile.
(Cf. illustration ci-contre)
4. La pile zinc air.
Cest encore une variante de la pile
alcaline, dans laquelle la cathode est
constitue par loxygne de lair.
(Llectrolyte est de la potasse)
Essentiellement sous forme bouton,
cette pile est majoritairement ddie
pour les aides auditives.
Sa f..m est de 1,4 V par lment.
Lnergie massique est leve (250 400 Wh/kg)
Raction lanode Zn + 2OH
-
ZnO + H
2
O + 2e
-
Raction la cathode O
2
+ 2H
2
O + 4e
-
4OH
-
La pile doit tre utilise, ds louverture de la languette de protection.
Courbes de dcharge typiques dune pile bouton
loxyde dargent (format 115,4 mm)
Source : http://www.houseofbatteries.com
Tension (V)
Dure (h)
Piles Accumulateurs page7 Claude Lahache
Ple ngatif
Anode (lithium)
Sparateur
Cathode : Dioxyde de manganse
ou autre (voir texte)
Joint isolant
Ple positif
5. La pile au lithium.
Les piles au lithium grand public peuvent se prsenter sous forme bouton (cf. illustration) ou bton ; dans ce
cas, les lectrodes sont gnralement spirales.
Lanode est toujours constitue de lithium, un des mtaux les plus lgers, mais extrmement ractif avec leau
(ncessit de salles anhydres pour la fabrication)
La raction lanode est Li Li
+
+ e
-
Llectrolyte est un sel de lithium dans un solvant organique .
Pour la cathode, diverses possibilits existent :
- Oxydes de plomb ou de bismuth pour une tension de service de 1,2 V 1,5 V
- Dioxyde de manganse (MnO
2
)
(Tension de service 2,8 V, densit dnergie 250 Wh/kg)
- Dioxyde de soufre (lectrode de carbone poreux, rempli dune solution de dioxyde de soufre SO
2
)
(Tension de service 2,8 V, densit dnergie 250 400 Wh/kg)
- Chlorure de thyonile (lectrode de carbone poreux rempli dune solution de chlorure de thyonile SOCl
2
)
(Tension de service de 3,6 V)
De faon gnrale, les piles lithium sont caractrises par une forte nergie massique et peuvent fonctionner dans
une large gamme de tempratures (-40 +60C, do leur emploi dans certaines expditions polaires)
Elles supportent des stockages prolongs (5 10 ans) expliqus par leur trs faible autodcharge (moins de 1% par
an 20C)
(sources :
http://www.saftbatteries.com
http://www.uclouvain.be/cps/ucl/doc/emediasciences/documents/Les_piles(1).pdf )
Piles Accumulateurs page8 Claude Lahache
Les Accumulateurs
La premire pile rechargeable a t mise au point vers 1860 par Gaston Plant (1834 1889) ;
ctait lanctre de nos classiques accumulateurs au plomb. Elle a t amliore par Henri Tudor (1859 1928)
vers la fin du 19
me
sicle.
Cette technologie a exist seule, pratiquement jusquau milieu du 20
me
sicle o la filire cadmium nickel sest
petit petit diffuse.
(Linvention de laccumulateur cadmium nickel, attribue Junger et Edison date cependant de 1900 !)
Au dbut des annes 1990, sont apparus des accumulateurs NiMH pour Nickel Mtal Hydrure, puis la
filire des accumulateurs au lithium, trs prometteuse, est apparue depuis le dbut des annes 2000.
Aprs avoir rappel les principales caractristiques dun accumulateur, nous examinerons les spcificits de
chacune des technologies actuelles.
La filire lithium tant en permanente volution, lexpos ne peut que faire un point sur son tat actuel.
1. Les donnes caractristiques.
Les principales caractristiques dun accumulateur sont:
- La tension disponible entre les deux lectrodes de la batterie.
- La capacit, mesure en ampre-heure (Ah), correspondant la charge maximale pouvant tre fournie par
laccumulateur, entre le moment o il est charg sa pleine capacit et le moment o il est compltement
dcharg.
- Selon la technologie, la capacit diminue plus ou moins vite avec le nombre de cycles de fonctionnement.
De la mme faon, le mode de charge diffre avec le type daccumulateurs utiliss. (Profils de tensions et de
courants, dure)
Les performances dun accumulateur, quelle que soit la technologie utilise, sont dfinies par trois critres :
La densit dnergie massique (ou volumique), en wattheure par kilogramme, Wh/kg (ou en wattheure par litre,
Wh/l), correspond la quantit dnergie stocke par unit de masse (ou de volume) daccumulateur.
Elle va dfinir son autonomie.
La densit de puissance massique, en watt par kilogramme (W/kg), reprsente la puissance (nergie fournie par
unit de temps) que peut dlivrer lunit de masse daccumulateur.
Ce critre donne une ide de la conductivit intrinsque de l'accumulateur, qui doit offrir le moins de rsistance
possible au courant.
La cyclabilit, exprime en nombre de cycles, caractrise la dure de vie de laccumulateur, cest--dire le
nombre de fois o il peut restituer un niveau dnergie suprieur 80 % de son nergie nominale, cette valeur
tant celle la plus souvent demande pour les applications mobiles.
gauche, Gaston Plant
droite, Henri Tudor
Piles Accumulateurs page9 Claude Lahache
lectrolyte : Solution
aqueuse dacide sulfurique
Plaque positive
(dioxyde de plomb PbO
2
)
Plaque ngative
( plomb Pb)
2. Accumulateurs au plomb.
La cellule lmentaire est forme dune plaque positive
recouverte de dioxyde de plomb, dun lectrolyte constitu
par une solution dacide sulfurique, dune plaque ngative
recouverte de plomb.
Les ractions chimiques aux lectrodes
sont rversibles.
Au ple positif :
Les ions sulfate, en milieu acide rduisent loxyde de plomb en sulfate (solide) la dcharge
PbO
2
+ SO
4
--
+ 4H
+
+ 2e
-
PbSO
4
+ 2H
2
O
Au ple ngatif:
Les ions sulfate oxydent le plomb en sulfate de plomb (solide) la dcharge
Pb + SO
4
--
PbSO
4
+ 2e
-
Ces 2 ractions sont connues sous le nom de double sulfatation. Elles ne sont parfaitement rversibles que si le
dpt de sulfate de plomb sur chaque lectrode reste limit.
Les accumulateurs au plomb quipent la quasi-totalit des automobiles moteur thermique. Ils servent surtout pour
leur dmarrage et comme source dnergie dappoint, moteur larrt.
Afin dobtenir de fortes intensits et une rsistance interne la plus faible possible, on groupe plusieurs cellules
lmentaires en parallle (de lordre de la dizaine) afin de raliser un lment 2V (Cf. illustration ci-dessous)
Il existe 2 variantes principales :
- Batteries lectrolyte liquide. Les plus anciennes, peu chres, mais qui doivent fonctionner lhorizontale.
Elles peuvent dgager de loxygne (au +) et de lhydrogne ( au -) gazeux dans certaines conditions, do
un risque (trs faible) dexplosion.
- Batteries lectrolyte glifi ou stabilis. Llectrolyte est pig dans une sorte de papier buvard nomm
glifiant et la structure des lectrodes assure (en thorie) llimination des gaz oxygne et hydrogne. Ces
batteries peuvent ainsi tre tanches et fonctionner dans toutes les positions.
Leur caractristique la plus marquante est leur poids lev, qui limite lnergie massique quelques dizaines de Wh
par kg !
dcharge
charge
dcharge
charge
Piles Accumulateurs page10 Claude Lahache
Fonctionnement pratique
Dcharge.
Trs rapidement, la tension par
lment se stabilise vers 2V.
En fin de dcharge la chute de tension
sacclre, correspondant un dbut de
sulfatation irrversible des plaques.
Il est impratif de stopper la dcharge
pour une tension de 1,8 V.
Cette valeur est nomme tension darrt.
Cette tension darrt dpend de la rapidit de dcharge : plus la dcharge est lente est plus il faudra choisir une
tension darrt leve.
(En dcharge lente, le sulfate produit est trs fin et pntrant ; lirrversibilit de la chimie est atteinte plus tt)
Au cours de la dcharge, la densit de llectrolyte liquide dcrot de 1,2 1,15 environ.
Intensit disponible : Elle peut tre extrmement leve pendant une courte dure ; cest la configuration dmarrage
o des intensits suprieures 100 A sont courantes.
Capacit restitue : Le constructeur affiche la capacit thorique de son accumulateur.
La capacit indique n'est en aucun cas sa capacit rellement utilisable sans dtrioration. Suivant le type de
batteries, on pourra utiliser de 80% (batteries stationnaires pour panneaux solaires) 10% (batteries de dmarrage)
de cette capacit.
Dautre part, leffet Peukert limite la capacit en fonction du courant dbit :
Pour une capacit thorique C
TH
, la capacit pratique de Peukert C
P
sexprime en fonction du courant de dcharge I
et de la dure de dcharge T
D
par :
D
xT
n
I
P
C = ; n, sans dimensions, est toujours suprieur 1 (1,1 1,5)
Plus le courant de dcharge est important et plus la capacit restitue sera faible devant C
TH
.
Charge.
A la recharge, il faut limiter la tension aux bornes de laccumulateur, afin dviter llectrolyse de lacide et le
dgagement gazeux abondant qui en rsulterait.
Les chargeurs daccus au plomb actuels travaillent en 3 temps :
- Phase 1 : Charge courant constant
(rgul I 1/5. de la valeur de capacit)
La tension augmente petit petit ; cette phase cesse lorsque
la tension par lment atteint 2,35V
- Phase 2 : : La tension de charge est rgule 2,35V par
lment. Le courant de charge diminue alors jusqu'
devenir infrieur C/100.
Cette phase doit durer au maximum 20 heures,
la tension ne doit pas rester au dessus de 2,26V plus
longtemps.
La batterie est charge l'issue de cette phase
- Phase 3 :Une fois la batterie charge (aprs environ
20h de charge) on passe en mode charge d'entretien
(Floating) pour la maintenir 100% de charge.
La tension alors applique la batterie sera de lordre
de 2,26V par lment.
Les phases 2 et 3 peuvent tre combines en limitant ds le dbut la tension 2,26V par lment. (Cas des
chargeurs anciens ou bas de gamme) La batterie ne pourra ainsi tre charge plus de 95% .
2,4V
2,2V
2,0V
1,8V
tension
2 4 6 8 10 temps (h)
0
dcharge
1,6V
risque de sulfatation
charge
dgagement gazeux
Courbes de charge et dcharge typiques dun lment au plomb
Piles Accumulateurs page11 Claude Lahache
2. Accumulateurs au nickel ou alcalins.
Il en existe 2 sous familles :
Les accumulateurs cadmium-nickel (NiCd), dont les jours sont compts, car une directive europenne bannit
lusage du cadmium dans les accumulateurs grand public. (2002 / 95 / CE)
Les accumulateurs nickel-mtal-hydrure (NiMH)
Leurs structures sont trs voisines :
Pour les accus bton (ci-contre)
les lectrodes sont spirales.
A ltat charg, llectrode positive est
constitue dun oxyhydroxyde de nickel
(NiO(OH)) ;
llectrode ngative est forme, soit de
cadmium, soit dun hydrure mtallique.
(Un hydrure mtallique est un alliage de
type AB
n
o A est une terre rare et B un
mtal de transition. Le plus connu est
LaNi
5
, capable dabsorber plus dun atome
dhydrogne par atome mtallique.
Labsorption dhydrogne est un phnomne
exothermique. Les lecteurs intresss trouveront
davantage dinformation http://pem.utbm.fr/materiaux_2002/file/pdf/CM14021.PDF )
Llectrolyte est base de potasse (KOH)
Ractions chimiques aux lectrodes.
Accumulateurs NiCd
lectrode positive : NiO(OH) + H
2
0
+ e
-
Ni(OH)
2
+ OH
-
lectrode ngative : Cd + 2OH
-
Cd(OH)
2
+ 2e
-
Remarque : La raction de charge dun accu NiCd est endothermique. Un chauffement pendant la charge est
synonyme de surcharge.
Accumulateurs NiMH
lectrode positive : NiO(OH) + H
2
0
+ e
-
Ni(OH)
2
+ OH
-
lectrode ngative : MH + OH
-
M + H
2
O
+ e
-
Remarque : La raction de charge dun accumulateur NiMH est exothermique. Un chauffement pendant la charge
est ici tout fait normal.
La tension de service dun lment est de 1,2V
Les accus NiMH ont une rsistance interne un peu suprieure (200 300 m) celle des accus NiCd (50 200
m).
Inconvnient des accus au nickel :Leffet mmoire.
La lgende veut que la capacit baisse si les accus au nickel ne sont pas compltement dchargs chaque cycle.
Cependant, la chute de tension en dessous de 0,8 V peut en provoquer la destruction.
En fait, la perte de capacit peut tre aussi due une recharge non suffisamment contrle, laquelle peut
endommager galement laccumulateur ! (Voir plus loin)
dcharge
charge
Joint tanche
Borne +
Chambre gaz
Contact au +
lectrode > 0 (NiOOH)
Sparateur imbib KOH
lectrode < 0 (Cd ou MH)
Botier (borne - )
Enveloppe
dcharge
charge
dcharge
charge
dcharge
charge
Piles Accumulateurs page12 Claude Lahache
Les accus au nickel embarquent une nergie massique suprieure aux accumulateurs au plomb :
Environ 60 Wh / kg pour les accus NiCd et 80 Wh / kg pour les accus NiMH. (40 Wh / kg pour les accus au
plomb)
Fonctionnement pratique.
A la dcharge, la tension par lment est stable 1,2 V, puis se
met chuter rapidement en fin de cycle.
A ce moment, la rversibilit des ractions chimiques est mise en
cause ; il faut viter de descendre en dessous de 0,8 V.
A la charge, la tension se stabilise galement vers 1,2 V.
La fin de charge est caractrise par le passage de la tension
par un maximum situ aux environs de 1,5 V.
Au-del, la tension aux bornes de llment diminue
nouveau et on entre en rgime de surcharge, accompagn dun
chauffement.
Les chargeurs de qualit pour accus au nickel vont dtecter
le pic de tension (dv / dt = 0) et stopper la charge.
Les chargeurs bas de gamme se contentent dindiquer une dure
de charge, quil ne faut pas excder !
Que se passe-t-il lorsquun accu au nickel a subi des dcharges
ou des charges trop profondes ? Certaines ractions chimiques
sont devenues partiellement irrversibles, et une partie du
potentiel nergtique initial nest plus utilisable.
Ceci correspond leffet mmoire , qui peut se traduire par
une courbe de dcharge semblable celle donne droite.
Il apparat une chute de tension anticipe en dessous de 1,2 V,
suivie dun second palier de tension une valeur infrieure.
Si lappareil qui est aliment par cet accu est muni dune mise
hors tension automatique, on peut assister un arrt prcoce
qui laisse une partie de lnergie de laccumulateur inutilise.
Il faut cependant noter que les accus type NiMH sont bien moins
sensibles leffet mmoire que les accus type NiCd.
Par contre, les accus NiMH sont affects dune auto-dcharge
non ngligeable (15 20% par mois).
Cyclabilit : Dure de vie denviron 1500 cycles pour la filire NiCd et denviron 500 1000 cycles pour la filire
NiMH.
Piles Accumulateurs page13 Claude Lahache
2. Accumulateurs au lithium.
Cest la technologie la plus rcente.
Le lithium est un mtal alcalin trs lger (0,54 g / cm
3
) , mais extrmement ractif avec lair et leau. La chimie des
accumulateurs au lithium ncessite quelques prcautions (salles anhydres notamment).
Il y a 2 sous familles : La filire lithium ion et la filire lithium polymre . Une 3
me
vient dapparatre :
La famille lithium phosphate .
Filire lithium ion
Un accumulateur aux ions lithium comporte une lectrode ngative de graphite, dans laquelle le lithium sinsre de
faon rversible, un lectrolyte non aqueux (sel de lithium dans un solvant organique) immobilis dans un
sparateur poreux et une lectrode positive en oxyde mtallique, dans laquelle du lithium sinsre de faon
rversible.
Les botiers sont de forme cylindrique ou paralllpipdique et rigides.
Pour llectrode positive, il est surtout fait appel trois types doxydes mtalliques : les oxydes de lithium-cobalt
(LiCoO
2
), les oxydes de lithium-nickel (LiNiO
2
) et les oxydes de lithium-manganse (LiMn
2
O
4
)
Ractions chimiques : (exemple avec un oxyde de cobalt)
lectrode positive : Li
1-x
CoO
2
+xLi
+
+ xe
-
LiCoO
2
(Les ions lithium de llectrolyte sont rduits ltat mtal et viennent sinsrer dans loxyde mixte)
lectrode ngative : Li
x
C
6
6C + xLi
+
(s) + xe
-
(Le lithium mtal pig dans le graphite est oxyd en ion lithium et passe dans llectrolyte)
Filire Lithium polymre
La diffrence de constitution est minime : Llectrolyte est ici un sel de lithium, diffus dans une matrice polymre.
Llectrolyte est dans un tat intermdiaire entre un gel et un solide ; il fait lui-mme office de sparateur.
Les botiers sont souples, le plus souvent de forme plate.
Principales caractristiques :
- Tension de service typique dlivre par un lment : 3,6 V.
- nergie massique suprieure 100 Wh / kg (soit une nergie volumique de plus de 200 Wh / l)
- Capacit spcifique leve, de 170 220 Ah / kg.
- Cyclabilit de plus de 1000 cycles.
- Faible autodcharge, pas deffet mmoire
- Large plage de temprature de fonctionnement ( -30C +60C)
dcharge
charge
dcharge
charge
Schma des dplacements de lion lithium dans un lment Li-ion
Source : http://pegase.scd.inpl-nancy.fr/theses/2009_URBAIN_M.pdf
Piles Accumulateurs page14 Claude Lahache
Dcharges dun lment au lithium de 800 mAh, de 160 mA
(courbe du haut) 1,6A (courbe du dessous)
Tension (V)
Capacit (mAh)
Courant (mA) Tension (V)
Profils de charge dun lment au lithium de 800 mAh
Phase 1
Charge I = C
TE
Phase 2
Charge U = C
TE
Arrt impratif
I = 0,03 C
Fonctionnement pratique.
Dcharge :
Courbe classique, avec un dpart 4,2 V et un palier assez peu marqu entre 3,6 et 3,8 V .
La fin de dcharge est marque par une rapide chute de tension.
Il ne faut en aucune faon appliquer des dcharges profondes en dessous de 2,8V 3V, sous peine de provoquer un
chauffement excessif .
Charge :
La charge seffectue en 3 temps.
On peut envisager des charges rapides ( valeur dintensit gale la valeur de capacit), ou plus lentes.
Examinons lexemple dune charge rapide sur un lment de 800 mAh .
1
re
phase : Le courant est rgul 800 mA et la tension aux bornes de llment croit.
Cette phase doit se terminer pour une tension de 4,2V (sinon risque dchauffement destructeur)
2
me
phase : La tension est rgule 4,2 0,05 V ; lintensit du courant absorb dcrot progressivement.
(Attention aux charges dlments en srie : Le chargeur doit tre capable de contrler la tension aux bornes de
chaque lment)
3
me
phase : Arrt de charge, lorsque le courant atteint la valeur de 0,03 fois la capacit.
Attention ne pas redmarrer une charge avant usage : Le chargeur enverrait un courant important, provoquant l
aussi un chauffement inacceptable.
Vous aimerez peut-être aussi
- Piles Et Accus PDFDocument14 pagesPiles Et Accus PDFOmar CharifPas encore d'évaluation
- Les Pile Et Les AccumulateursDocument13 pagesLes Pile Et Les Accumulateursch abdePas encore d'évaluation
- Pourquoi Eteindre Ses PharesDocument5 pagesPourquoi Eteindre Ses PharesAbreu CabralPas encore d'évaluation
- Pile ÉlectriqueDocument19 pagesPile ÉlectriqueAnne PotsPas encore d'évaluation
- Hiba PresentationDocument36 pagesHiba Presentationmostapha lamchichiPas encore d'évaluation
- Pil Acccu NereADocument3 pagesPil Acccu NereASection Maintenance LP-BlériotPas encore d'évaluation
- La, PileDocument7 pagesLa, PileBoukhelif BoualemPas encore d'évaluation
- Chapitre-7 - Transformations Spontanés Dans Les PilesDocument7 pagesChapitre-7 - Transformations Spontanés Dans Les Pilesa houssPas encore d'évaluation
- Pile DaniellDocument16 pagesPile DaniellYassir IbralPas encore d'évaluation
- ZN ZN +2E: (ZNCL) (NH CL)Document4 pagesZN ZN +2E: (ZNCL) (NH CL)q68dtggbqjPas encore d'évaluation
- Fonctionnement Du SEDocument6 pagesFonctionnement Du SEq68dtggbqjPas encore d'évaluation
- PCMterm Seq04 Exercices PDFDocument5 pagesPCMterm Seq04 Exercices PDFProf OkhamPas encore d'évaluation
- Les PilesDocument4 pagesLes PilesHaider BouzidPas encore d'évaluation
- Chapitre 2 2011-2012 Les Piles ElectrochimiqueDocument8 pagesChapitre 2 2011-2012 Les Piles ElectrochimiqueHAMADA19720% (1)
- CollectionDocument10 pagesCollectionbeebac2009Pas encore d'évaluation
- Partie B Accumulateurs Au PlombDocument12 pagesPartie B Accumulateurs Au Plombmecanique.navale24Pas encore d'évaluation
- Présentation1 Les PilesDocument13 pagesPrésentation1 Les PilesItz SimoPas encore d'évaluation
- La Pile ElectrochimiqueDocument13 pagesLa Pile ElectrochimiqueRabihPas encore d'évaluation
- Partie B Accumulateurs Au PlombDocument11 pagesPartie B Accumulateurs Au PlombNedjm EldinnePas encore d'évaluation
- Piles Et AccumulateursDocument15 pagesPiles Et Accumulateursmechergui100% (3)
- Fiche Sur LélectrolyseDocument4 pagesFiche Sur LélectrolysechadaPas encore d'évaluation
- Programme de Technologie Terminale F3Document31 pagesProgramme de Technologie Terminale F3Bill Pitinguele95% (22)
- CHP 7 La Pile ElectrochimiqueDocument4 pagesCHP 7 La Pile ElectrochimiqueAida Ben ChaabenePas encore d'évaluation
- Cours 1 Les Piles Et Récupération D'énergieDocument6 pagesCours 1 Les Piles Et Récupération D'énergieBOURASSPas encore d'évaluation
- Electro Lys eDocument4 pagesElectro Lys eالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Cours Les Piles Elouarde 2biofDocument9 pagesCours Les Piles Elouarde 2biofabderrazak boubekriPas encore d'évaluation
- Piles C3a9lectrochimiquesDocument3 pagesPiles C3a9lectrochimiquesMohamed ElouakilPas encore d'évaluation
- RapportDocument7 pagesRapportMed Outaghjijte0% (1)
- Résumé de Cours Sur Les Piles Électrochimiques Pile DaniellDocument6 pagesRésumé de Cours Sur Les Piles Électrochimiques Pile DaniellchadaPas encore d'évaluation
- AE Fabrication d'une pile cuivre-zinc (1)Document4 pagesAE Fabrication d'une pile cuivre-zinc (1)socranedeoufPas encore d'évaluation
- Cours S5 Chapitre 5 Pile Daniel PDFDocument10 pagesCours S5 Chapitre 5 Pile Daniel PDFSabeur KhemakhemPas encore d'évaluation
- Chap 17Document4 pagesChap 17IssePas encore d'évaluation
- 1ers - Chap 15 - TP20 PilesDocument4 pages1ers - Chap 15 - TP20 PilesAmina EnnaboulsiPas encore d'évaluation
- PilesDocument6 pagesPilesJojo BoubPas encore d'évaluation
- Circuit ElectriqueDocument5 pagesCircuit Electriquecharef loumaPas encore d'évaluation
- Circuit Electrique EleveDocument5 pagesCircuit Electrique EleveThierry DucosPas encore d'évaluation
- Les PilesDocument7 pagesLes PilesDriss EL FadilPas encore d'évaluation
- Circuit ElectriqueDocument5 pagesCircuit ElectriquebisoldaPas encore d'évaluation
- Electricité: 1 Notions de CicuitDocument25 pagesElectricité: 1 Notions de CicuitDavePas encore d'évaluation
- Cours Piles Et Oxydorc3a9duction ExercicesDocument17 pagesCours Piles Et Oxydorc3a9duction ExercicesTony kougbaganPas encore d'évaluation
- Circuit Electrique ProfDocument5 pagesCircuit Electrique Profali kolliPas encore d'évaluation
- Cours 5 UE3 - Potentiel Electrochimique 2020Document21 pagesCours 5 UE3 - Potentiel Electrochimique 2020MDKPas encore d'évaluation
- MoodleDocument10 pagesMoodlemoustafa soudaniPas encore d'évaluation
- ElectrochimieDocument50 pagesElectrochimiejado thirlwallPas encore d'évaluation
- PCMterm FS04 PilesDocument3 pagesPCMterm FS04 PilesMohamed ElouakilPas encore d'évaluation
- Document Pédagogique Mis À La Libre DispositionDocument3 pagesDocument Pédagogique Mis À La Libre Dispositionchh1960Pas encore d'évaluation
- Transformation Spontanées Dans Les Piles Et Production (WWW - Pc1.ma)Document5 pagesTransformation Spontanées Dans Les Piles Et Production (WWW - Pc1.ma)Salma ElfaroukiPas encore d'évaluation
- Les Types de Pile À CombustibleDocument5 pagesLes Types de Pile À Combustibleslimane boutarbouchPas encore d'évaluation
- Courant Électrique - Cours - 5ème - Physique - Chimie - CollègeDocument3 pagesCourant Électrique - Cours - 5ème - Physique - Chimie - CollègePatchari DECOCKPas encore d'évaluation
- Chapitre 2 F Et MDocument44 pagesChapitre 2 F Et MGouasmia MustafaPas encore d'évaluation
- Phénomène DautoinductionDocument9 pagesPhénomène Dautoinductionernestadou7800Pas encore d'évaluation
- TC3 Cours PilesDocument2 pagesTC3 Cours PileszebiPas encore d'évaluation
- Exercices Sur Le Dipôle RLDocument8 pagesExercices Sur Le Dipôle RLMohieddine KhailiPas encore d'évaluation
- Cours - 3ème - Chap.1 La Conduction ÉlectriqueDocument4 pagesCours - 3ème - Chap.1 La Conduction ÉlectriqueFlavien PagnonPas encore d'évaluation
- Initiation A L Electricité PDFDocument5 pagesInitiation A L Electricité PDFhakimus2015Pas encore d'évaluation
- Atelier 1 NEW 4Document4 pagesAtelier 1 NEW 4SERATPas encore d'évaluation
- L'Électricité - Découvreurs et Inventeurs: Tome IVD'EverandL'Électricité - Découvreurs et Inventeurs: Tome IVÉvaluation : 3 sur 5 étoiles3/5 (2)
- Fermions: Les Grands Articles d'UniversalisD'EverandFermions: Les Grands Articles d'UniversalisPas encore d'évaluation
- Resolution Par Methode Norton Millman Kennely 14Document7 pagesResolution Par Methode Norton Millman Kennely 14chabane_148549100% (1)
- Chapitre 1 Controle Non Destructif GeneralitesDocument7 pagesChapitre 1 Controle Non Destructif GeneralitesmarzooPas encore d'évaluation
- Dispositif de Controle de L'état de L'huile MoteurDocument16 pagesDispositif de Controle de L'état de L'huile MoteurEl Mehdi AkhatarPas encore d'évaluation
- Le CND Par GC Et CGDocument2 pagesLe CND Par GC Et CGEl Mehdi AkhatarPas encore d'évaluation
- Notion de Base Electricite 11Document8 pagesNotion de Base Electricite 11zemabder100% (1)
- Corrige Exercices Conductimetrie Feuille Travaux DirigesDocument3 pagesCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- Presentation Des OndesDocument26 pagesPresentation Des OndesEl Mehdi AkhatarPas encore d'évaluation
- Automates Programmables IndustrielsDocument16 pagesAutomates Programmables IndustrielsEl Mehdi AkhatarPas encore d'évaluation
- 1S - DS4 PDFDocument2 pages1S - DS4 PDFEl Mehdi AkhatarPas encore d'évaluation
- Bac S 2013 Physique Chimie ObligDocument9 pagesBac S 2013 Physique Chimie ObligLETUDIANT100% (1)
- Tableau de Caractérisation Des Ions en Solutions.Document3 pagesTableau de Caractérisation Des Ions en Solutions.mohamed laghrib75% (4)
- Serie CondensateurDocument4 pagesSerie CondensateurEl Mehdi Akhatar100% (1)
- Exercices de Physique TSDocument116 pagesExercices de Physique TSerrairachid100% (4)
- Ex Blanc07-08Document2 pagesEx Blanc07-08El Mehdi AkhatarPas encore d'évaluation
- Bac S 2013 Physique Chimie ObligDocument9 pagesBac S 2013 Physique Chimie ObligLETUDIANT100% (1)
- Correction Physique Chimie S 2013Document8 pagesCorrection Physique Chimie S 2013El Mehdi AkhatarPas encore d'évaluation
- Fiche Methode Modele LewisDocument23 pagesFiche Methode Modele LewisEl Mehdi AkhatarPas encore d'évaluation
- Quantique CognitionDocument24 pagesQuantique CognitionEl Mehdi AkhatarPas encore d'évaluation
- Exercices de Physique TSDocument116 pagesExercices de Physique TSerrairachid100% (4)
- Physique Et PhilosophieDocument11 pagesPhysique Et PhilosophieeuaggPas encore d'évaluation
- Bac S 2013 Physique Chimie ObligDocument9 pagesBac S 2013 Physique Chimie ObligLETUDIANT100% (1)
- HeisenbergDocument28 pagesHeisenbergEl Mehdi Akhatar100% (1)
- Bac S 2013 Physique Chimie ObligDocument9 pagesBac S 2013 Physique Chimie ObligLETUDIANT100% (1)
- TraductionDocument57 pagesTraductionEl Mehdi AkhatarPas encore d'évaluation
- Comment Rediger Un Rapport Un Memoire Une TheseDocument100 pagesComment Rediger Un Rapport Un Memoire Une TheseAzzedine BakaPas encore d'évaluation
- Articolo Bitbol 1Document15 pagesArticolo Bitbol 1El Mehdi AkhatarPas encore d'évaluation
- Structures de LewisDocument4 pagesStructures de LewisEl Mehdi AkhatarPas encore d'évaluation
- TraductionDocument57 pagesTraductionEl Mehdi AkhatarPas encore d'évaluation
- TraductionDocument57 pagesTraductionEl Mehdi AkhatarPas encore d'évaluation
- Electron Affinity of Elements & Various MoleculesDocument8 pagesElectron Affinity of Elements & Various MoleculesYourMotherPas encore d'évaluation
- Analyse TechniqueDocument7 pagesAnalyse TechniqueMistermétis DavidPas encore d'évaluation
- Rot DDocument336 pagesRot DwalidPas encore d'évaluation
- Potentiel Minier Madagascar PrintDocument24 pagesPotentiel Minier Madagascar PrintNy Laza Alexias Randrianoelina100% (1)
- Carnet Atelier FFBDocument23 pagesCarnet Atelier FFBAbderrahmaneNajidPas encore d'évaluation
- CarrelageDocument39 pagesCarrelageHichem AllaliPas encore d'évaluation
- Charpente MetalliqueDocument55 pagesCharpente Metalliqueayouta rezguiPas encore d'évaluation
- Les PilesDocument17 pagesLes Pilesbrahim_mdPas encore d'évaluation
- Plomb Guide POCHE CompletDocument44 pagesPlomb Guide POCHE CompletAbdel IdrissiPas encore d'évaluation
- 1-Introduction:: 3-1-Procédé Par Hydrométallurgie: Procédé Actuellement Utilisé Par (Alzinc)Document4 pages1-Introduction:: 3-1-Procédé Par Hydrométallurgie: Procédé Actuellement Utilisé Par (Alzinc)Mahamat Nour Yaya AbakarPas encore d'évaluation
- Argent Au Maroc - Octobre 2016Document8 pagesArgent Au Maroc - Octobre 2016Saad SekkatePas encore d'évaluation
- De L'aluminium, Ses Propriétés, Sa Fabrication Et Ses Applications - Hi Sainte-Claire DevilleDocument197 pagesDe L'aluminium, Ses Propriétés, Sa Fabrication Et Ses Applications - Hi Sainte-Claire Devillebeey2001Pas encore d'évaluation
- Catalogue Tunisie Panneaux 2015Document22 pagesCatalogue Tunisie Panneaux 2015Triki SamirPas encore d'évaluation
- Soudure 2Document5 pagesSoudure 2Lola IbizaPas encore d'évaluation
- DuriteDocument4 pagesDuritegalati12345Pas encore d'évaluation
- C3Chim - Transformations - Limitees - Exercices - Sabatier PDFDocument5 pagesC3Chim - Transformations - Limitees - Exercices - Sabatier PDFAzizElheni0% (1)
- Cours Désignation Des Éléments FiletésDocument17 pagesCours Désignation Des Éléments Filetésntayoub100% (4)
- AbrasifsDocument36 pagesAbrasifslamiae loukiliPas encore d'évaluation
- Perennator FS 121Document2 pagesPerennator FS 121Brian QuesnelPas encore d'évaluation
- Liste Des FiguresDocument18 pagesListe Des FiguresKamanga Mbuyi EricPas encore d'évaluation
- Tube Cuivre 1Document9 pagesTube Cuivre 1benjaminlambert2006Pas encore d'évaluation
- Le CODE MINIER de La République Du Congo PDFDocument52 pagesLe CODE MINIER de La République Du Congo PDFLucas BelussiPas encore d'évaluation
- SAM-OUTILLAGE-promotion Indispensam 2016 Additif Ex PDFDocument12 pagesSAM-OUTILLAGE-promotion Indispensam 2016 Additif Ex PDFeuqehtbPas encore d'évaluation
- Fascicule N°2 - Clauses Techniques Communes Aux Divers Natures de TravauxDocument45 pagesFascicule N°2 - Clauses Techniques Communes Aux Divers Natures de Travauxabdou100% (1)
- Code Minier 2019Document44 pagesCode Minier 2019Izabela100% (2)
- TractionDocument35 pagesTractionamjadkreit100% (1)
- ElectroniqueDocument42 pagesElectroniqueMichel MaverickPas encore d'évaluation
- GIL Protection Cathodique V1 1Document41 pagesGIL Protection Cathodique V1 1walid lamiri100% (1)
- TP La Potentiométrie À Intensité NulleDocument6 pagesTP La Potentiométrie À Intensité NulleHakim KhenichePas encore d'évaluation