Académique Documents
Professionnel Documents
Culture Documents
Exemple D
Transféré par
Sahbi Mabrouki Yamen0 évaluation0% ont trouvé ce document utile (0 vote)
8 vues2 pagesTitre original
Exemple d
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
8 vues2 pagesExemple D
Transféré par
Sahbi Mabrouki YamenDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
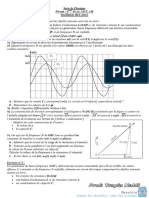
Suivi temporelle de l’avancement d’une transformation chimique
a) Exemple d'une transformation lente :
Plaçons dans un bêcher V = 50 mL d'une solution d'eau iodée (I 2) (solution brune), de
concentration C = 0,20 mol.L-1. Introduisons dans cette solution n' = 10 mmol de fer Fe.
La solution perd progressivement sa coloration brune. La solution est incolore au bout de
plusieurs minutes, car le diiode disparaît au cours de la transformation.
La réaction d'oxydoréduction met en jeu les couples I 2 / I- et Fe2+ / Fe.
L'équation de la réaction d'oxydoréduction s'écrit :
I2 (aq) + Fe (s) 2 I- (aq) + Fe2+(aq) .
b) Suivi de la transformation par plusieurs méthodes
Diverses méthodes permettent de suivre l'évolution temporelle du système :
• Le suivi par titrage, qui permet de déterminer l'évolution de la quantité de diiode I2 présente en
solution en fonction du temps.
• Le suivi par spectrophotométrie, qui permet de déterminer l'évolution de l'absorbance A de la
solution en fonction du temps.
• Le suivi par conductimétrie, qui permet de déterminer l'évolution de la conductance de la
solution en fonction du temps.
Remarque : une transformation chimique dans laquelle un gaz intervient peut être suivie
par pressiométrie (ou manométrie), ce qui permet de déterminer l'évolution de la pression du
gaz en fonction du temps.
Ces grandeurs physiques peuvent ensuite être reliées à la concentration en diiode, ou à
l'avancement x de la réaction.
2. Méthodes de suivi
a. Méthode 1 : suivi temporel de la réaction par titrage
Pour déterminer la quantité de diiode restant en fonction du temps, on procède à un dosage du
diiode dans un échantillon de la solution.
On prélève à une date t un échantillon de la solution, et on procède à une trempe (dilution et
refroidissement rapide de la solution) pour stopper la transformation.
Le prélèvement est introduit dans un bêcher.
On verse ensuite dans le bêcher une solution de thiosulfate de sodium contenue dans une
burette graduée, jusqu'à atteindre l'équivalence (repérée par une disparition de la couleur brune
de la solution).
Pour plus de commodité, on introduit dans le mélange, lorsque la solution est jaune pâle, de
l'empois d'amidon ; la coloration bleue que prend le mélange est plus visible que le jaune. Le
changement de couleur est plus net.
La transformation qui se produit est totale et rapide, c'est pourquoi elle peut servir de support
au dosage.
L'équation de cette transformation s'écrit :
I2(aq) + 2 S2O32-(aq) = 2 I-(aq) + S4O62-(aq) .
Le volume VE versé pour atteindre l'équivalence permet de calculer la quantité nI2 de diiode
présente dans l'échantillon, et donc dans la solution.
On a, à l'équivalence, à la date t :
En répétant la manipulation à différentes dates, on
peut ainsi tracer la courbe d'évolution de la quantité de
diiode formée en fonction du temps.
Vous aimerez peut-être aussi
- Les Forces Electromagnetiques La Loi de Laplace Exercices Non Corriges 2Document1 pageLes Forces Electromagnetiques La Loi de Laplace Exercices Non Corriges 2abdelhamid100% (3)
- Correction Du DS 2013-2014Document5 pagesCorrection Du DS 2013-2014jihenkPas encore d'évaluation
- Serie Avancement1Document2 pagesSerie Avancement1amine touatiPas encore d'évaluation
- SUIVI TEMPOREL de L'avancementDocument2 pagesSUIVI TEMPOREL de L'avancementSahbi Mabrouki YamenPas encore d'évaluation
- Ex11.Dosages Redoc 1Document9 pagesEx11.Dosages Redoc 1Chihab ÉddînePas encore d'évaluation
- G IodoDocument13 pagesG IodoAysan OgluPas encore d'évaluation
- Chimie TP3 DosageDocument2 pagesChimie TP3 DosageKhadija KabatiPas encore d'évaluation
- TP5 SuivicinetiquepartitrageDocument2 pagesTP5 Suivicinetiquepartitragekabid1964Pas encore d'évaluation
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Document14 pagesSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- Aide TP 9 S4 PDFDocument4 pagesAide TP 9 S4 PDFLou BalonPas encore d'évaluation
- 1 Exercices Vitesse de Reaction EleveDocument8 pages1 Exercices Vitesse de Reaction EleveYassine FerdoudiPas encore d'évaluation
- 12 Chimie TSe 1Document5 pages12 Chimie TSe 1foud18Pas encore d'évaluation
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniPas encore d'évaluation
- Chimie Classe: SV: Décomposition D'une Eau Oxygénée (7 Points)Document10 pagesChimie Classe: SV: Décomposition D'une Eau Oxygénée (7 Points)Le seul SauveurPas encore d'évaluation
- Chim 03 TP 1Document2 pagesChim 03 TP 1Mouhieddine KhailiPas encore d'évaluation
- tp05 Maiver 2Document14 pagestp05 Maiver 2kmeriemPas encore d'évaluation
- CH 1 ExostsDocument3 pagesCH 1 ExostsNajimou Alade Tidjani100% (1)
- TP ChlorationDocument10 pagesTP ChlorationVeronika Prym100% (1)
- Cours Chimie 20102011Document83 pagesCours Chimie 20102011Mohcine RickyPas encore d'évaluation
- TS2TDC42013Document4 pagesTS2TDC42013Najimou Alade TidjaniPas encore d'évaluation
- 01 Réaction Rapide Et Lente 2em BacDocument4 pages01 Réaction Rapide Et Lente 2em Bacmounir labib el idrissiPas encore d'évaluation
- TP Chimie 10 Titrage Eau JavelDocument4 pagesTP Chimie 10 Titrage Eau JavelLou BalonPas encore d'évaluation
- TD Dosages Directs 1Document1 pageTD Dosages Directs 1Youssef Arba100% (1)
- TP Benamara WDocument3 pagesTP Benamara Wabir ben100% (1)
- BCH 211 - 2Document7 pagesBCH 211 - 2todjoamelagbessiPas encore d'évaluation
- Partie Expérimentale I ChlorationDocument4 pagesPartie Expérimentale I ChlorationYa CinPas encore d'évaluation
- Exercices 1 Suivi TemporelDocument1 pageExercices 1 Suivi Temporelayoub himoune0% (1)
- 15chi1es E1Document6 pages15chi1es E1Hussein AbdallahPas encore d'évaluation
- Chap6 DosageDocument4 pagesChap6 DosageThomas Libérato100% (1)
- Eau de JavelDocument7 pagesEau de JavelHenadi GhomrianePas encore d'évaluation
- TP Chimie n1Document4 pagesTP Chimie n1Adel Laimeche100% (1)
- Exercice 1: (6 Points) La Soude Caustique NaohDocument7 pagesExercice 1: (6 Points) La Soude Caustique NaohAli RammalPas encore d'évaluation
- Reactions ComplexationDocument2 pagesReactions ComplexationRitaj-Rayane KarimPas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Reaction de BriggsDocument3 pagesReaction de BriggsLEGRAVEPas encore d'évaluation
- tp1 PhotoDocument6 pagestp1 Photoemanhdf904Pas encore d'évaluation
- Autoprotolyse Et Acide Fort Base Fort Londo AkademyDocument3 pagesAutoprotolyse Et Acide Fort Base Fort Londo AkademyAysatou LôPas encore d'évaluation
- Corrige TPchim8 Titrage Indirect 2009Document3 pagesCorrige TPchim8 Titrage Indirect 2009Kouki RkaPas encore d'évaluation
- Reaction Persulfate IodureDocument8 pagesReaction Persulfate Iodurelamis b-zPas encore d'évaluation
- Pour Cent Age Massique D Une Piece-2Document3 pagesPour Cent Age Massique D Une Piece-2abd3l13Pas encore d'évaluation
- Analyse D Une Eau MineraleDocument4 pagesAnalyse D Une Eau MineraleAyyoub DahbiPas encore d'évaluation
- SV Chim 2021 2 FRDocument7 pagesSV Chim 2021 2 FRanthony nehmePas encore d'évaluation
- 2006-2007 TP DétartrantpourcafetièreélectriqueDocument3 pages2006-2007 TP DétartrantpourcafetièreélectriqueDaniela DinicaPas encore d'évaluation
- tp7 (Chimie Dosage de 02)Document5 pagestp7 (Chimie Dosage de 02)Sabin SamPas encore d'évaluation
- TP Chimie N°6 - Dosage Indirect de L'eau de JavelDocument3 pagesTP Chimie N°6 - Dosage Indirect de L'eau de JavelNatty FREMONTPas encore d'évaluation
- Dosage de L'eau de JavelDocument3 pagesDosage de L'eau de JaveltoiliiPas encore d'évaluation
- DM Chimie RevisionDocument2 pagesDM Chimie RevisionMolka HarbaouiPas encore d'évaluation
- 2003 Asie Sujet Exo1 Savon 4ptsDocument2 pages2003 Asie Sujet Exo1 Savon 4ptstrenteastonPas encore d'évaluation
- Inbound 2445717137996175615Document17 pagesInbound 2445717137996175615emanelrefay79Pas encore d'évaluation
- C03 Cinetique ReactionDocument2 pagesC03 Cinetique ReactionmohPas encore d'évaluation
- Le Vin Et Ses Composants Exercice 1 Obligatoire 10 Points Asie Sujet 1 2022 Specialite Physique ChimieDocument6 pagesLe Vin Et Ses Composants Exercice 1 Obligatoire 10 Points Asie Sujet 1 2022 Specialite Physique Chimienoha Abdel bassetPas encore d'évaluation
- 2003 Asie Spe Sujet Exo1 JavelDocument2 pages2003 Asie Spe Sujet Exo1 JavelZakaria AIT EL CAIDPas encore d'évaluation
- TP MiniralDocument11 pagesTP MiniralAymene Salah Bendrihem100% (2)
- TP 3 Extraction Diiode Par Le CyclohexaneDocument2 pagesTP 3 Extraction Diiode Par Le CyclohexaneBouhadPas encore d'évaluation
- DésinfectionDocument5 pagesDésinfectionamel amoulPas encore d'évaluation
- Protocole Saé Dosage Du Vin BlancDocument4 pagesProtocole Saé Dosage Du Vin BlancNoélie BarrèrePas encore d'évaluation
- TP Chimie n1Document2 pagesTP Chimie n1Oussoufi Mze Kaanbi100% (2)
- TP N° 5 SolutionsDocument6 pagesTP N° 5 SolutionsMohamed EL AminePas encore d'évaluation
- Dev Synt2 1ereDocument3 pagesDev Synt2 1ereSahbi Mabrouki YamenPas encore d'évaluation
- Serie RevisionDocument2 pagesSerie RevisionSahbi Mabrouki YamenPas encore d'évaluation
- Série Energie CinetiqueDocument3 pagesSérie Energie CinetiqueSahbi Mabrouki Yamen100% (1)
- Dev Controle1 4scDocument4 pagesDev Controle1 4scSahbi Mabrouki YamenPas encore d'évaluation
- Série Physique Dipole RLC Forcé 2011 2012 (Trayia Nabil)Document4 pagesSérie Physique Dipole RLC Forcé 2011 2012 (Trayia Nabil)Iyed SEPas encore d'évaluation
- Serie RevisionDocument2 pagesSerie RevisionSahbi Mabrouki YamenPas encore d'évaluation
- Série Physique Dipole RLC Forcé 2011 2012 (Trayia Nabil)Document4 pagesSérie Physique Dipole RLC Forcé 2011 2012 (Trayia Nabil)Iyed SEPas encore d'évaluation
- Dev Synthese N°14scDocument6 pagesDev Synthese N°14scSahbi Mabrouki Yamen0% (1)
- Série Oscillations Mécaniques Libres Et AmortiesDocument3 pagesSérie Oscillations Mécaniques Libres Et AmortiesSahbi Mabrouki YamenPas encore d'évaluation
- Série Physique Dipole RLC Forcé 2011 2012 (Trayia Nabil)Document4 pagesSérie Physique Dipole RLC Forcé 2011 2012 (Trayia Nabil)Iyed SEPas encore d'évaluation
- Serie Gravitation2Document2 pagesSerie Gravitation2Sahbi Mabrouki YamenPas encore d'évaluation
- Serie Dipole RLDocument5 pagesSerie Dipole RLSahbi Mabrouki YamenPas encore d'évaluation
- Serie PilesDocument5 pagesSerie PilesSahbi Mabrouki YamenPas encore d'évaluation
- SERIE Le Champ Magnétique Creé Par Un Courant Prof - Elmnaouar (WWW - Pc1.ma)Document2 pagesSERIE Le Champ Magnétique Creé Par Un Courant Prof - Elmnaouar (WWW - Pc1.ma)Sahbi Mabrouki YamenPas encore d'évaluation
- Série Phénomène InductionDocument3 pagesSérie Phénomène InductionSahbi Mabrouki YamenPas encore d'évaluation
- Serie SpectreDocument5 pagesSerie SpectreSahbi Mabrouki YamenPas encore d'évaluation
- Les Forces Electromagnetiques La Loi de Laplace Resume de Cours 2Document3 pagesLes Forces Electromagnetiques La Loi de Laplace Resume de Cours 2abdelhamid100% (1)
- Serie Force de LaplaceDocument2 pagesSerie Force de LaplaceSahbi Mabrouki YamenPas encore d'évaluation
- Devoir de Contrôle N°1 (19-20)Document4 pagesDevoir de Contrôle N°1 (19-20)Sahbi Mabrouki YamenPas encore d'évaluation
- 11577535serie Force de LaplaceDocument2 pages11577535serie Force de LaplaceSahbi Mabrouki YamenPas encore d'évaluation
- Série D'exercices - Sciences Physiques Mouvement D'une Particule Dans Un Champ Électrique - Les Alcools - 3ème Technique (2010-2011) MR Adam Bouali-1Document2 pagesSérie D'exercices - Sciences Physiques Mouvement D'une Particule Dans Un Champ Électrique - Les Alcools - 3ème Technique (2010-2011) MR Adam Bouali-1Sahbi Mabrouki YamenPas encore d'évaluation
- Serie RCDocument4 pagesSerie RCSahbi Mabrouki YamenPas encore d'évaluation
- Corrigé Proposition 2 SC Phy 2019Document4 pagesCorrigé Proposition 2 SC Phy 2019Sahbi Mabrouki YamenPas encore d'évaluation
- Dev Controle2 4eme SCDocument4 pagesDev Controle2 4eme SCSahbi Mabrouki YamenPas encore d'évaluation
- Devsyntn°24sc 2021Document1 pageDevsyntn°24sc 2021Sahbi Mabrouki YamenPas encore d'évaluation
- Devc 14 SC 2020Document4 pagesDevc 14 SC 2020Sahbi Mabrouki YamenPas encore d'évaluation
- Devsyntn°24sc 2021Document1 pageDevsyntn°24sc 2021Sahbi Mabrouki YamenPas encore d'évaluation
- TD Fascicule RI 2020-2021Document118 pagesTD Fascicule RI 2020-2021Cookies TPas encore d'évaluation
- CCSA Rapid Access Models Substance Use Services Rapid Review Report 2020 FRDocument72 pagesCCSA Rapid Access Models Substance Use Services Rapid Review Report 2020 FRRémi Coignard-FriedmanPas encore d'évaluation
- Automatique 111Document17 pagesAutomatique 111laila AZZOUZIPas encore d'évaluation
- Rev2 Sa V10 13072022Document26 pagesRev2 Sa V10 13072022xx-marie-xxPas encore d'évaluation
- Concept Six SigmaDocument13 pagesConcept Six SigmaMed Ali MassoudiPas encore d'évaluation
- Cours GIL 1819Document44 pagesCours GIL 1819mohammedreda.hadiPas encore d'évaluation
- 2012 Belrose Nathalie Les Colonies Françaises de CubaDocument289 pages2012 Belrose Nathalie Les Colonies Françaises de CubaAime MontresorPas encore d'évaluation
- 2.intérêts ComposésDocument14 pages2.intérêts Composésmabisleona5Pas encore d'évaluation
- Accords de Partenariat Pour Une Pêche DurableDocument68 pagesAccords de Partenariat Pour Une Pêche DurableInspection Générale MPPHPas encore d'évaluation
- Cryoscopie AlmemaDocument9 pagesCryoscopie AlmemaCheikh Ismaïla BA0% (1)
- Les Aires Urbaines, Une Nouvelle Géogra... Sée - 3e - Cours Géographie - KartableDocument8 pagesLes Aires Urbaines, Une Nouvelle Géogra... Sée - 3e - Cours Géographie - KartableInfinityPas encore d'évaluation
- Du Pouvoir Histoire Naturelle de Sa Croissance by Bertrand de JouvenelDocument305 pagesDu Pouvoir Histoire Naturelle de Sa Croissance by Bertrand de JouvenelbooksPas encore d'évaluation
- Almaden Morocco FRDocument20 pagesAlmaden Morocco FRMakrani BrahimPas encore d'évaluation
- Texte Frédéric Epaud Bilan Charpente NDP PDFDocument6 pagesTexte Frédéric Epaud Bilan Charpente NDP PDFFrançois LeroyPas encore d'évaluation
- Memoire de Fin D'Etudes: ThèmeDocument84 pagesMemoire de Fin D'Etudes: ThèmeSaad ElfalahPas encore d'évaluation
- La CelluleDocument24 pagesLa CelluleMohammed CHENNAOUIPas encore d'évaluation
- Dictionnaire LAROUSSE Collège 6e-3e 11-15 Ans Chez Scoleo Livres Et Cahiers de VacancesDocument1 pageDictionnaire LAROUSSE Collège 6e-3e 11-15 Ans Chez Scoleo Livres Et Cahiers de Vacancesskvj88tww6Pas encore d'évaluation
- Application de APR Sur Notre EntrepotDocument3 pagesApplication de APR Sur Notre EntrepotSIHAM BELLAGNECHPas encore d'évaluation
- PFFACE Definition Et NotionDocument72 pagesPFFACE Definition Et Notionouedraogorahimcom373Pas encore d'évaluation
- Espions DocenseignantsDocument64 pagesEspions DocenseignantsJose FernandezPas encore d'évaluation
- Big Data Et Machine LearningDocument20 pagesBig Data Et Machine Learningpapa babacar DiagnePas encore d'évaluation
- 3ème 20 F1 Exercices + Correction Les Liens de Parenté Entre Les Êtres Vivants Et l' Évolution 3 PDFDocument1 page3ème 20 F1 Exercices + Correction Les Liens de Parenté Entre Les Êtres Vivants Et l' Évolution 3 PDFromydrai09Pas encore d'évaluation
- Cours Mathématiques IV-Chap.3Document12 pagesCours Mathématiques IV-Chap.3El-Kaber HachemPas encore d'évaluation
- 01 Régimes TransitoiresDocument64 pages01 Régimes Transitoiresoussama zairPas encore d'évaluation
- Correction D'erreur Directe (FEC) Dans La Transmission de Données 100G - FS CommunautéDocument5 pagesCorrection D'erreur Directe (FEC) Dans La Transmission de Données 100G - FS CommunautéChoubane LaminePas encore d'évaluation
- Délégations 2020Document2 pagesDélégations 2020Vincent LacourPas encore d'évaluation
- Praxematique 2771Document22 pagesPraxematique 2771Jaime Abad MontesinosPas encore d'évaluation
- Le Chef D'oeuvre 2023 2024Document8 pagesLe Chef D'oeuvre 2023 2024Adrien MiloudiPas encore d'évaluation
- Lettre de Motivation Demande de Bourse Talents: Pour Nous Encourager, Partagez Notre Site Sur Vos Réseaux SociauxDocument2 pagesLettre de Motivation Demande de Bourse Talents: Pour Nous Encourager, Partagez Notre Site Sur Vos Réseaux SociauxLilya OuarabPas encore d'évaluation