Académique Documents
Professionnel Documents
Culture Documents
TP Chimie 10 Titrage Eau Javel
Transféré par
Lou BalonTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TP Chimie 10 Titrage Eau Javel
Transféré par
Lou BalonDroits d'auteur :
Formats disponibles
Partie III : Chimie
TP
TP 10 : Dosage des ions hypochlorites d’une eau de Javel
Objectifs
• Comprendre le principe d’un dosage indirect et en réaliser un.
• Repérer une équivalence dans un titrage colorimétrique.
• Utiliser les diagrammes E-pH pour justifier des choix expérimentaux.
But du TP
• Déterminer la concentration en ions hypochlorites ClO− d’une eau de Javel commerciale afin de discuter
de sa conservation.
I Introduction
Position du problème
− − −
L’eau de Javel est une solution aqueuse de Na+ +
(aq) +Cl(aq) et Na(aq) +ClO(aq) . C’est l’ion hypochlorite ClO(aq)
qui a une action désinfectante. Il s’agit en effet d’un oxydant puissant, qui peut réagir avec des composés
organiques et les détruire.
On souhaite ici déterminer la concentration d’une eau de Javel en ions hypochlorites.
Liste du matériel à votre disposition
• Eau de javel commerciale
− − • Pipettes jaugées de 5 et 10 mL
(Na+ +
(aq) +Cl(aq) et Na(aq) +ClO(aq) ),
concentration c0 inconnue. • Fiole jaugée de 50 mL
• Burette graduée de 50 mL • Béchers de 50 mL et 100 mL
• Agitateur magnétique • Poubelle
• Eau distillée
−
• Solution d’iodure de potassium (K+
(aq) +I(aq) ), concentration 0.10 mol/L.
• Solution d’acide sulfurique (H2 SO4 (aq) ), concentration 1.0 mol/L (à manipuler avec gants et lu-
nettes).
• Solution de thiosulfate de sodium (2 Na+ 2−
(aq) +S2 O3 (aq) ), concentration en ion thiosulfate cB = 0.100 mol/L.
• Empois d’amidon (ou thiodène), utilisé pour repérer l’équivalence du titrage.
II Expérience
II.1 Dilution de l’eau de Javel
On souhaite diluer l’eau de Javel commerciale 10 fois (donc diviser la concentration des différents ions par
10). On veut un volume final V10 = 50 mL d’eau de Javel diluée. On notera α = 10 le rapport de dilution.
1 – Proposer un protocole pour effectuer cette dilution. On précisera en particulier le volume V0 d’eau de
Javel commerciale a prélever, et la verrerie à utiliser.
Appeler le professeur avant d’effectuer la dilution.
Dans la suite, on travaille avec la solution diluée. On note c1 sa concentration en ions hypochlorites ClO−
(que l’on cherche).
TP 10 1/4 Pierre de Coubertin | TSI 2 | 2018-2019
II.2 Titrage de l’eau de Javel
Le titrage procède en 3 étapes :
• Étapes 1 et 2 : il n’existe pas de réaction courante avec les ions ClO− qui soit totale, rapide, unique,
et dont on peut facilement repérer l’équivalence.
Les étapes 1 et 2 consistent donc à transformer tout ClO− en une espèce chimique facile à titrer, à
savoir le diiode I2 (aq) . Celui-ci sera titré dans l’étape 3, et comme sa quantité de matière est liée à la
quantité de matière de ClO− initiale, on en déduira cette dernière.
Étape 1 : Pour transformer ClO− en diiode, on le fait réagir avec des ions iodures I− introduits
en excès. La réaction a lieu en milieu basique car l’eau de Javel est basique, et implique les couples
d’oxydoréduction ClO− /Cl− et IO− − −
3 /I . Ceci “transforme” les ClO en IO3 .
−
Étape 2 : Pour atteindre l’objectif initial, il faut encore transformer les ions IO−3 en diiode I2 (aq) . On
−
réalise ceci en acidifiant la solution. Les ions IO3 réagissent alors avec les ions I− pour former I2 (aq) .
Les couples en jeu sont IO− −
3 /I2 et I2 /I .
Les étapes 1 et 2 peuvent se résumer en une équation bilan :
ClO− − + −
(aq) + 2I(aq) + 2H(aq) = Cl(aq) + I2 (aq) + H2 O(l) (1)
Cette réaction est rapide et quasi-totale.
On a donc transformé les n1 moles de ClO−
(aq) en n1 moles de I2 (aq) , que l’on va titrer.
• Étape 3 : titrage du diiode. On titre le diiode à l’aide d’une solution de thiosulfate de sodium
(2 Na+ 2−
(aq) +S2 O3 (aq) ), de concentration cB = 0.100 mol/L. Les couples d’oxydoréduction en jeu sont
I2 /I− et S4 O2− 2−
6 /S2 O3 . La réaction de titrage est
−
I2 (aq) + 2 S2 O2− 2−
3 (aq) = 2 I(aq) + S4 O6 (aq) . (2)
Elle est quasi-totale, rapide, unique, et l’équivalence se repère facilement car le diiode en solution
aqueuse est orange-brun. La couleur orange-brun disparaît donc lorsque l’équivalence est atteinte, car
alors tout le diiode est consommé.
Questions préliminaires
2 – On prélève un volume V1 de la solution diluée de Javel que l’on place dans un bécher. Donner l’expression
de la quantité de matière n1 d’ions hypochlorites dans ce prélèvement, en fonction de V1 et c1 .
Donner également la quantité de matière de diiode présente dans le bécher une fois les étapes 1 et 2
réalisées.
Protocole
3 – Suivre le protocole ci-dessous.
• Étapes 1 et 2 : introduire dans le bécher, dans l’ordre indiqué :
– V1 = 10.0 mL de la solution diluée.
– 30 mL environ de solution d’iodure de potassium de concentration 0.10 mol/L (c’est l’étape 1).
– 10 mL environ d’acide sulfurique de concentration 1.0 mol/L (c’est l’étape 2).
• Réaliser le titrage par une solution de thiosulfate de sodium de concentration cB = 0.100 mol/L.
À mesure que l’on verse la solution de thiosulfate de sodium depuis la burette, le bécher perd progres-
sivement sa coloration (car le diiode est consommé). Lorsqu’il devient jaune très pâle, ajouter quelques
gouttes d’empois d’amidon ou de thiodène. Ceci recolore la solution. Verser alors goutte à goutte le
contenu de la burette jusqu’à disparition de la coloration. Tout le diiode est alors consommé.
Relever le volume équivalent Véq , et l’incertitude associée.
TP 10 2/4 Pierre de Coubertin | TSI 2 | 2018-2019
III Exploitation de l’expérience
4.a – Rappeler la définition de l’équivalence. Quelle est la relation entre le volume équivalent Véq , le volume
V1 , et les concentrations c1 et cB ?
4.b – En déduire l’expression de la concentration initiale c0 en fonction de Véq , V1 , cB et du rapport de
dilution α.
Faire l’application numérique. Calculer également l’incertitude associée, à l’aide de la formule de pro-
pagation des incertitudes sur c0 .
∆cB
On prendra = 0.5% (qui dépend du matériel utilisé pour préparer la solution titrante), ∆V1 tel
cB
qu’indiqué sur le matériel que vous avez utilisé (à condition de l’avoir bien utilisé !), ∆Véq tel qu’estimé
avant, et ∆α/α = 0.5% (dépend de la précision du matériel utilisé pour la dilution et de votre habileté
lors de cette étape).
IV Comparaison avec la valeur annoncée par le fabriquant
5.a – On veut comparer à l’indication du fabricant. Celui-ci donne le degré chlorométrique de l’eau de Javel :
do = 18 degrés. Ceci correspond au volume (en litres) de dichlore gazeux que peut dégager 1 L d’eau
de Javel selon la réaction Cl− − +
(aq) + ClO(aq) + 2H(aq) = Cl2 (g) + H2 O(l) .
Quelle est l’expression de la quantité de matière n de dichlore que peut libérer un volume V0 = 1 L
d’une eau de Javel de concentration c0 en ClO− ?
Quelle est l’expression du volume V qu’occupe cette quantité de Cl2 (g) dans les CNTP (conditions
normales de température et de pression, soit T = 273 K et p = 1 atm), sachant que le volume molaire
des gaz parfaits dans les CNTP est Vm = 22.4 L/mol ?
En déduire la concentration c0 fab indiquée par le fabricant.
5.b – Comparer valeur fabricant et valeur expérimentale. Sont-elles compatibles ?
L’ion hypochlorite n’est en fait pas stable thermodynamiquement dans l’eau de Javel : il réagit avec
l’eau dans une réaction à la cinétique lente (temps de demi-réaction de l’ordre de plusieurs mois à 20°C
et dans l’obscurité).
Conclure.
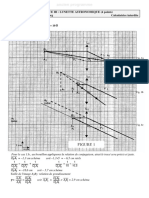
V Interprétation du protocole à l’aide de diagrammes E-pH
6 – Étape 1 : écrire l’équation de la réaction qui a lieu pendant cette étape. On écrira pour s’aider les
demi-équations correspondants aux deux couples en jeu.
Le pH initial de l’eau de Javel est autour de 11. Justifier à partir des diagrammes E-pH que la réaction
précédente est thermodynamiquement favorisée.
7 – Étape 2 : écrire l’équation de la réaction qui a lieu pendant cette étape. On écrira pour s’aider les
demi-équations correspondants aux deux couples en jeu.
D’après le diagramme E-pH, à partir de quel pH les ions I− et IO− 3 ne peuvent-ils plus coexister en
solution ? Que se passe-t-il lorsque l’on acidifie la solution en dessous de ce pH ? Comment s’appelle ce
type de réaction ?
8 – Étapes 1 et 2 : en additionnant les deux réactions précédentes, montrer que l’on retrouve bien l’équation
bilan 1.
9 – Étape 3 : Justifier à partir des diagrammes E-pH que la réaction de titrage est thermodynamiquement
favorisée.
10 – Question sur l’intérêt du dosage indirect : pourquoi n’a-t-on pas réalisé le titrage des ions ClO−
directement par les ions iodures I− ? pourquoi est-ce plus pratique de transformer ClO− en diiode puis
de titrer le diiode ?
TP 10 3/4 Pierre de Coubertin | TSI 2 | 2018-2019
Diagrammes E-pH. La concentration de tracé est de 0.1 mol/L.
TP 10 4/4 Pierre de Coubertin | TSI 2 | 2018-2019
Vous aimerez peut-être aussi
- TP Chimie 12 Titrage Eau de JavelDocument3 pagesTP Chimie 12 Titrage Eau de Javelnasa nasaPas encore d'évaluation
- TP Chimie N°6 - Dosage Indirect de L'eau de JavelDocument3 pagesTP Chimie N°6 - Dosage Indirect de L'eau de JavelNatty FREMONTPas encore d'évaluation
- Eau de JavelDocument7 pagesEau de JavelHenadi GhomrianePas encore d'évaluation
- Dosage de L'eau de JavelDocument3 pagesDosage de L'eau de JaveltoiliiPas encore d'évaluation
- TPC Spé - Eau de JavelDocument2 pagesTPC Spé - Eau de Javeltoma2602Pas encore d'évaluation
- Exercice Corrigé L'eau de Javel, Produit Ménager CourantDocument10 pagesExercice Corrigé L'eau de Javel, Produit Ménager Courantالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- PC GENE 009 CORRECTION Exo1 Chi TitrageJavel - 0Document4 pagesPC GENE 009 CORRECTION Exo1 Chi TitrageJavel - 0Amine TerrabPas encore d'évaluation
- Prob 10Document10 pagesProb 10Dounia ChahidPas encore d'évaluation
- C2 JavelDocument3 pagesC2 JavelFoudil LaouiciPas encore d'évaluation
- Ex Chapitre 2Document8 pagesEx Chapitre 2الدعم الجامعيPas encore d'évaluation
- Partie Expérimentale I ChlorationDocument4 pagesPartie Expérimentale I ChlorationYa CinPas encore d'évaluation
- E3C 09 Corrige Partie1Document2 pagesE3C 09 Corrige Partie1Youssef AkrPas encore d'évaluation
- 2003 Asie Spe Sujet Exo1 JavelDocument2 pages2003 Asie Spe Sujet Exo1 JavelZakaria AIT EL CAIDPas encore d'évaluation
- Dosage Indirect Eau de JavelDocument6 pagesDosage Indirect Eau de JavelJean Leonardo100% (2)
- TP de Spécialité N°19 - Dosage Javel-PartielDocument2 pagesTP de Spécialité N°19 - Dosage Javel-PartielLou BalonPas encore d'évaluation
- Javel Par I2Document2 pagesJavel Par I2SALAA FahimaPas encore d'évaluation
- CB Physique Première Spé Février 2023Document6 pagesCB Physique Première Spé Février 2023Cédric GALLANDPas encore d'évaluation
- PDF JavelDocument3 pagesPDF JavelMahran BchatniaPas encore d'évaluation
- DS01Document11 pagesDS01baatoutmbPas encore d'évaluation
- JavelDocument5 pagesJavelmelxeroPas encore d'évaluation
- 2008 Antilles Exo2 Sujet EaudeJavel 6 5ptsDocument3 pages2008 Antilles Exo2 Sujet EaudeJavel 6 5ptsMed BriniPas encore d'évaluation
- Exercice Chimie 11Document2 pagesExercice Chimie 11salma maroufPas encore d'évaluation
- TP Géné 6 13x14 PDFDocument4 pagesTP Géné 6 13x14 PDFLou BalonPas encore d'évaluation
- TP Eau de Javel CorrectionDocument3 pagesTP Eau de Javel CorrectionLou BalonPas encore d'évaluation
- Eau de JavelDocument7 pagesEau de JavelBéchir GhorbélPas encore d'évaluation
- TP N 3 Chimie Sem1 2022 Sujet IodometrieDocument4 pagesTP N 3 Chimie Sem1 2022 Sujet IodometrieRaouf RamoulPas encore d'évaluation
- DM Chimie RevisionDocument2 pagesDM Chimie RevisionMolka HarbaouiPas encore d'évaluation
- TP Dosage Chlore Méthode Iodométrique 2019Document3 pagesTP Dosage Chlore Méthode Iodométrique 2019Bouz. TimaPas encore d'évaluation
- TP 1Document5 pagesTP 1alainPas encore d'évaluation
- TP Chimie 1 Rappels)Document2 pagesTP Chimie 1 Rappels)youma009Pas encore d'évaluation
- Test a – Electrochimie S7 FrC – Niveau ExpertDocument2 pagesTest a – Electrochimie S7 FrC – Niveau Expertrodrigue.gervaisePas encore d'évaluation
- G IodoDocument13 pagesG IodoAysan OgluPas encore d'évaluation
- CHAP - 02 ACT - EXP Dosage ChlorureDocument3 pagesCHAP - 02 ACT - EXP Dosage ChlorureChikh Mourad0% (1)
- Corrige TPchim8 Titrage Indirect 2009Document3 pagesCorrige TPchim8 Titrage Indirect 2009Kouki RkaPas encore d'évaluation
- EX1C1 L'eau de Javel, Précaution D'emploi, StabilitéDocument1 pageEX1C1 L'eau de Javel, Précaution D'emploi, StabilitéphytanjaPas encore d'évaluation
- Chlorures Charp VolharDocument2 pagesChlorures Charp VolharAmath FayePas encore d'évaluation
- 1495234058-cc11ee65528238d408730f17c1de3b20Document10 pages1495234058-cc11ee65528238d408730f17c1de3b20Le seul SauveurPas encore d'évaluation
- Chimie PharmacutiqueDocument12 pagesChimie PharmacutiqueYaSs MiinPas encore d'évaluation
- TP No07 Dosage Des Ions ChloruresDocument3 pagesTP No07 Dosage Des Ions Chlorureschérifa boulechfarPas encore d'évaluation
- Correction TP Olympiades Nitrates Dans EauDocument8 pagesCorrection TP Olympiades Nitrates Dans EausmiraniabderrahmenPas encore d'évaluation
- DM 11 ChimieDocument4 pagesDM 11 ChimieMustapha BelmuftiPas encore d'évaluation
- Dosage Iodometrique Du Chlore: Licence en Sciences Et Techniques Département de ChimieDocument8 pagesDosage Iodometrique Du Chlore: Licence en Sciences Et Techniques Département de ChimieManal Idali67% (3)
- Recueil de Chimie Tle CdeDocument27 pagesRecueil de Chimie Tle CdeKarma SambaPas encore d'évaluation
- Cours de VirologieDocument5 pagesCours de VirologieFrancisca AgboviPas encore d'évaluation
- TP N° 5 SolutionsDocument6 pagesTP N° 5 SolutionsMohamed EL AminePas encore d'évaluation
- 01 Réaction Rapide Et Lente 2em BacDocument4 pages01 Réaction Rapide Et Lente 2em Bacmounir labib el idrissiPas encore d'évaluation
- Chimie (2) - 1Document2 pagesChimie (2) - 1lolizepazePas encore d'évaluation
- 4 - Chimie TLeDocument52 pages4 - Chimie TLeAnas IsmailPas encore d'évaluation
- Concours Commun Marocain Session 1992: Extractions Liquide / LiquideDocument4 pagesConcours Commun Marocain Session 1992: Extractions Liquide / LiquideAbderrahman SrailPas encore d'évaluation
- Exercice 1: (6 Points) La Soude Caustique NaohDocument7 pagesExercice 1: (6 Points) La Soude Caustique NaohAli RammalPas encore d'évaluation
- Séance 10Document5 pagesSéance 10SantamitoPas encore d'évaluation
- Fiche Supp Dosage VolumetriqueDocument3 pagesFiche Supp Dosage VolumetriqueАли ИбрагимPas encore d'évaluation
- Brochure Dakin 2021Document5 pagesBrochure Dakin 2021Coquelicot Éphémère ÉphémèrePas encore d'évaluation
- Correction TP3 Dosage Ions ChlorureDocument4 pagesCorrection TP3 Dosage Ions ChlorureYancouba BadjiPas encore d'évaluation
- DS02Document9 pagesDS02baatoutmbPas encore d'évaluation
- Alcalimetrie TP N°4Document4 pagesAlcalimetrie TP N°4Diallo100% (1)
- Nouveau moyen de préparer la couche sensible des plaques destinées à recevoir les images photographiques Lettre à M. AragoD'EverandNouveau moyen de préparer la couche sensible des plaques destinées à recevoir les images photographiques Lettre à M. AragoPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- 2005 Liban Spe Correction LunetteAstro 4ptsDocument3 pages2005 Liban Spe Correction LunetteAstro 4ptsLou BalonPas encore d'évaluation
- Prerparation-Du-Chlorure-Dhydrogerne Aide TPDocument3 pagesPrerparation-Du-Chlorure-Dhydrogerne Aide TPLou BalonPas encore d'évaluation
- TP Eau de Javel CorrectionDocument3 pagesTP Eau de Javel CorrectionLou BalonPas encore d'évaluation
- TP Géné 6 13x14 PDFDocument4 pagesTP Géné 6 13x14 PDFLou BalonPas encore d'évaluation
- Aide tp1Document2 pagesAide tp1Lou BalonPas encore d'évaluation
- TSpe-TPC1-MesurespH-Fiche TPP Synthèse Du HCL GazeuxDocument6 pagesTSpe-TPC1-MesurespH-Fiche TPP Synthèse Du HCL GazeuxLou BalonPas encore d'évaluation
- Aide tp1Document2 pagesAide tp1Lou BalonPas encore d'évaluation
- Phenomenes de Corrosion Humide TPDocument4 pagesPhenomenes de Corrosion Humide TPLou BalonPas encore d'évaluation
- TP N°18 - Corrosion Et Protection Du FerDocument11 pagesTP N°18 - Corrosion Et Protection Du FerLou BalonPas encore d'évaluation
- TP de Spécialité N°19 - Dosage Javel-PartielDocument2 pagesTP de Spécialité N°19 - Dosage Javel-PartielLou BalonPas encore d'évaluation
- Aide TP 9 S4 PDFDocument4 pagesAide TP 9 S4 PDFLou BalonPas encore d'évaluation
- TP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrDocument15 pagesTP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrLawrence Mundene-timotheePas encore d'évaluation
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassi100% (1)
- analytique-1-Enregistré-automatiquementDocument8 pagesanalytique-1-Enregistré-automatiquementNadir AzizPas encore d'évaluation
- Modes OpératoiresDocument11 pagesModes OpératoiresAnaibar Tarik100% (1)
- Chimie Dosage - Dosage - Le PomeloDocument2 pagesChimie Dosage - Dosage - Le PomeloAbdel ElouaerPas encore d'évaluation
- F-Thermochimie Et ÉlectrochimieDocument51 pagesF-Thermochimie Et Électrochimiefelix richardPas encore d'évaluation
- TP Dosage PH MétriqueDocument2 pagesTP Dosage PH MétriqueAbidine CHAHIR100% (2)
- TP 05 Determination Du Degre Chlorometrique (Oxydo-Réduction)Document6 pagesTP 05 Determination Du Degre Chlorometrique (Oxydo-Réduction)Moume AmiraPas encore d'évaluation
- Cours Hadj YoucefDocument205 pagesCours Hadj Youcefdjassa djassa0% (1)
- MR Amara: Devoir de Contrôle N°1 ChimieDocument10 pagesMR Amara: Devoir de Contrôle N°1 ChimieFadhel Fourat BoughanmiPas encore d'évaluation
- 57FameckLStExuperyINNO2010 2 14Document3 pages57FameckLStExuperyINNO2010 2 14ayoub dahbiPas encore d'évaluation
- 2021 03 Metro Sujet1 ExoA ChouRouge 5pts CorrectionDocument3 pages2021 03 Metro Sujet1 ExoA ChouRouge 5pts CorrectionClémentine TakumiPas encore d'évaluation
- Chimie Générale4 PDFDocument50 pagesChimie Générale4 PDFTOUREPas encore d'évaluation
- TPC4Document2 pagesTPC4hhedfiPas encore d'évaluation
- 2015 CtresEtrangers Exo3 Correction Vin 5ptsDocument2 pages2015 CtresEtrangers Exo3 Correction Vin 5ptsRATIARIVELO Mamy FrédéricPas encore d'évaluation
- Fiche DosageDocument8 pagesFiche DosageaeroartonlinePas encore d'évaluation
- 15chi1es E1Document6 pages15chi1es E1Hussein AbdallahPas encore d'évaluation
- Rapport de Stage SAMAGRODocument22 pagesRapport de Stage SAMAGROsalmaoumghar9Pas encore d'évaluation
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Document14 pagesSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- 5 2011 09 Metropole Exo3 Sujet Chaufferette 4ptsDocument2 pages5 2011 09 Metropole Exo3 Sujet Chaufferette 4ptsalbert einschteinPas encore d'évaluation
- Acide BaseDocument19 pagesAcide Basehamzi0% (1)
- Degré Vinaigre 2008 DomiDocument3 pagesDegré Vinaigre 2008 DomiDaniela DinicaPas encore d'évaluation
- VERT DE BROMOCRÉSOL CorrectionDocument3 pagesVERT DE BROMOCRÉSOL CorrectionJuliette ALBANELPas encore d'évaluation
- Chimie A Chap3 Suivi - Temporel - TransformationDocument5 pagesChimie A Chap3 Suivi - Temporel - TransformationMohammed ElhlouPas encore d'évaluation
- Compte RendueDocument4 pagesCompte Renduelamiss yousfi0% (1)
- ds3 ts3 PDFDocument8 pagesds3 ts3 PDFSriguru ElumalaiPas encore d'évaluation
- TD 4 La ThermochimieDocument12 pagesTD 4 La ThermochimiekoumaPas encore d'évaluation
- Actchim2 Reperage Equiv AcidobasiqueDocument3 pagesActchim2 Reperage Equiv AcidobasiqueYoussef HalloumiPas encore d'évaluation
- 2022 NelleCaledo J1 Sujet OriginalDocument19 pages2022 NelleCaledo J1 Sujet Originalredatwitch2006Pas encore d'évaluation
- P Titrage Conductimetrique CorDocument2 pagesP Titrage Conductimetrique CorEngwataPas encore d'évaluation