Académique Documents
Professionnel Documents
Culture Documents
Série D'exercices Sur Dosage Acide - Base - Ts - Sunudaara
Série D'exercices Sur Dosage Acide - Base - Ts - Sunudaara
Transféré par
bouba cissokhoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Série D'exercices Sur Dosage Acide - Base - Ts - Sunudaara
Série D'exercices Sur Dosage Acide - Base - Ts - Sunudaara
Transféré par
bouba cissokhoDroits d'auteur :
Formats disponibles
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
Accueil Cours Exercices Devoirs Vidéo QCM Nous contacter Créer un compte Fascicule des partenaires
Nous soutenir
Accueil» Série d'exercices sur Dosage Acide - Base - Ts
Série d'exercices sur Dosage Acide - Base - Ts
Télécharger
maintenant
Démarrer le téléchargement
Classe: Terminale
Playweez
Exercice 1 Ouvrir
On mélange un volume VA d'une solution d'acide chlorhydrique (H3 O+ −
aq + Claq ) de
concentration molaire CA ayant un pHA avec un volume VB d'une solution d'hydrogène de
sodium (Na+ −
aq + OHaq ) de concentration molaire CB ayant un pHB .
CONNEXION UTILISATEUR
1) Réaliser le bilan de matière des ions hydronium et hydroxyde.
Nom d'utilisateur *
2) Calculer leur concentration molaire dans la solution après la réaction de neutralisation.
Montrer que celui-ci est :
Mot de passe *
⋅ pH = 7, dans le cas d'une réaction totale et stœchiométrique.
CA VA − CB VB
⋅ pH = − log( ), dans le cas d'un excès de la solution acide. Créer un nouveau compte
VA + VB Demander un nouveau mot de passe
CB VB − CA VA Se connecter
⋅ pH = 14 + log( ), dans le cas d'un excès de la solution Basique.
VB + VA
⋅ En déduire le pH de la solution obtenue.
COLLÈGE
On donne :
Sixième
Cours Math 6e
∙ VA = 200 mL , pHA = 2.0 et VB = 200 mL , pHB = 12.0.
Exo Maths 6e
Sciences de la Vie 6e
∙ VA = 800 mL , pHA = 2.0 et VB = 500 mL , pHB = 12.0. Cinquième
Sciences de la vie 5e
∙ VA = 300 mL , pHA = 2.0 et VB = 200 mL , pHB = 12.3. Sciences de la terre 5e
Math 5e
3) Calculer la concentration molaire des ions sodium et des ions chlorure qui sont resté dans la Cours Maths 5e
solution des trois cas. Exo Maths 5e
Quatrième
Exercice 2 Cours Maths 4e
Exo Math 4e
PC 4e
Pour déboucher les canalisations, on utilise des produits domestiques qui sont des solutions
Cours PC 4eme
concentrées d'hydroxyde de sodium, NaOHs , (soude).
Exo PC 4e
Histoire 4e
Sur l'étiquette de l'un de ces produits on lit :
SVT 4e
Science de La Vie 4e
− Densité d = 1.2 (masse volumique ρ = 1.2 g ⋅ cm−3 ) Science de la terre 4e
Exo SVT 4e
− Contient 20% en masse de soude. Exos Sciences de la Vie 4e
Exos sciences de la terre 4e
1) Montrer que la concentration molaire C de la solution commerciale est voisine de Troisième
6 mol ⋅ L−1 . PC 3e
Cours PC 3e
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 1 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
2) Quel volume de solution commerciale faut-il prélever pour obtenir 1 L de solution dilué de Cours Physique 3e
concentration molaire 3 ⋅ 10−2 mol ⋅ l−1 ? Cours Chimie 3e
Annonce Exo PC 3e
Exos Physique 3e
Exos chimie 3e
Signaler cette BFEM PC
annonce
Histoire
Maths 3e
Cours Maths 3e
Choisir sa pub Exos maths 3e
BFEM Maths
QCM Maths 3e
SVT 3e
Science de La Terre 3e
Cliquer ici
Science de La Vie 3e
Exo SVT 3e
BFEM SVT
Les solutions de soude sont des solutions de base forte.
3) a) Rappeler la définition d'une base forte.
Pour vérifier sa concentration, on dose 5 mL de la solution diluée par une solution d'acide LYCÉE
chlorhydrique de concentration CA = 1 ⋅ 10−2 mol ⋅ L−1 .
Seconde
4) a) Écrire l'équation bilan de la réaction. Math 2nd
Cours Maths 2nd
b) Pour obtenir l'équivalence, on doit verser 15 mL de la solution d'acide chlorhydrique. Exo maths 2nd
Devoir Maths 2nd
PC 2nd
Calculer la concentration de la solution diluée.
Cours PC 2nd
Exo PC 2nd
Retrouve-t-on la valeur souhaitée ?
Cours SVT Seconde
Première
Exercice 3 Maths 1ere
Cours Maths 1ere
On se propose de déterminer l'alcalimétrie d'une eau industrielle. Exos Maths 1ere
Devoir Maths 1ere
Pour ceci on réalise le dosage pH métrique de 50 mL d'eau par une solution d'acide PC Première
chlorhydrique de concentration molaire CA = 1 ⋅ 10−1 mol ⋅ L−1 . Cours PC 1ere
Exo PC Première
Cours SVT Première
Terminale
Maths Terminale
Cours Maths TS
Exos Maths Terminale
Devoir Maths Terminale
PC Terminale
Cours PC Terminale
Exo PC Terminale
SVT Terminale
Exos SVT Terminale
Philosophie
Cours Philo
Savoir-faire Philo
Texte Philo
Exo Philo
Histoire
Géographie
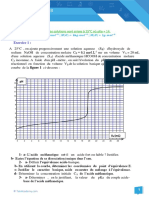
Les résultats des différentes mesures ont permis de tracer la courbe ci-dessus.
On admettra que l'alcalinité était due à la seule base faible : lion hydrogénocarbonate HCO−
3
Rechercher
1) Déterminer graphiquement :
Custom Search
a) les cordonnées du point d'équivalence.
b) le pKA de la base faible.
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 2 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
2) Écrire l'équation de la réaction de dosage, puis calculer la concentration molaire et la
Rechercher
concentration massique de la base.
Custom Search
(T . A. C) d'une eau s'exprimant par le même nombre que
3) Le titre alcali métrique complet
le volume exprimé en mL d'une solution acide telle que CA = 2 ⋅ 10−2 mol ⋅ L−1 nécessaire
pour doser 100 mL d'eau, déterminer le T . A. C de l'eau étudiée.
Exercice 4
A l'aide d'une pipette et à partir d'une solution aqueuse SA d'un monoacide AH de
concentration molaire CA , on prélève un volume VA = 20 mL qu'on verse dans un bécher.
Le dosage pH métrique de SA par une solution aqueuse SB d'hydroxyde de sodium NaOH
(base forte), concentration molaire CB = 0.2 mol ⋅ L−1 .
La révolution pour
votre salle de bain…
Éco-O Voir les offres
Une femme mange
du curcuma tous l…
Trucs et Astuces
1) a) Décrire comment varie le pH en fonction de volume de la base ajouté.
b) La forme de la courbe permet-elle de vérifier que l'acide AH dosé est un acide faible ?
Cellulite ? Gra
Justifier. amincissante
WonderPatch
2) Déterminer graphiquement en précisant la méthode utilisée :
a) La valeur du pH à l'équivalence.
b) La valeur de la constante d'acidité pKa du couple AH/A− .
3) Vérifier que le pH à l'équivalence E est donné par la relation
′ ).
pHE = (pKe + pKa + log CAE
-15% -15% -15% -23%
4) pour permettre une bonne immersion de l'électrode combinée du Ve d'eau pure au volume
Va = 20 mL de la solution SA à doser.
a) Préciser, en le justifiant, l'effet de cette dilution sur :
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 3 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
− Le pH initial de la solution acide.
− Le pH à demi-équivalence.
− Le volume VBE de base versée à l'équivalence.
− Le pH à l'équivalence.
b) Sachant que la valeur de pHE a varié de 0.15 de la valeur précédente.
Calculer le volume Ve d'eau.
5) Parmi les indicateurs colorés consignés dans le tableau ci-dessous,
a) Qu'appelle-t-on la teinte sensible d'un indicateur coloré ?
-15% -28% -15% -15%
Crea table basse ZALA Lit banquette
Spéciale armoire 3 contemporaine superposé capitonné TANA COFFE
portes coulissantes laquée blanc 120x6… sans matelas TABLE
459,020 FCFA 223,020 FCFA 223,020 FCFA 69,620 FCFA
b) Préciser l'indicateur le plus approprié pour réaliser ce dosage ?*
Justifier.
Indicateur coloré Zone de virage
Bleu de bromothymol 6.2 − 7.4
Hélianthine 3.1 − 4.4
Phénolphtaléine 8.2 − 10.0
Exercice 5
Dans un examen de travaux pratiques, un élève est chargé d'effectuer le dosage d'un volume
Va = 20 mL d'une solution d'acide AH inconnu par une solution aqueuse dhydroxyde de
sodium (base forte) de concentration molaire Cb afin d'identifier AH.
Au cours du dosage, l'élève suit à l'aide d'un pH−mètre l'évolution de pH du milieu
réactionnel en fonction du volume Vb de base versée, les résultats sont consignés dans le
tableau suivant :
Vb (mL) 0 2 4 6 8 9 9.5 10 10.5 12 14 16 18 20
pH 2.81 3.62 4.03 4.38 4.8 5.16 5.48 8.31 11.2 11.7 11.97 12.12 12.23 12.3
On donne une liste de pKa de quelques couples acide-base qui peuvent être utiles à
l'identification de l'acide.
Couple NH4+ /NH3 HCOOH/HCOO− C6 H5 COOH/C6 H5 COO− CH3 NH3+ /CH3 NH2
acide-base
pKa 9.2 3.8 4.2 10.7
Le candidat est appelé à :
1) Faire un schéma annoté du dispositif utilisé pour ce dosage.
2) Tracer la courbe représentative de pH = f(Vb ).
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 4 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
3) Prélever la valeur du pH :
a) à l'équivalence et à déduire le caractère de l'acide.
b) A la demi-équivalence et à identifier l'acide.
c) Initial de l'acide et à calculer sa concentration Ca en supposant que AH est un acide
faiblement ionisé.
4) Écrire l'équation de la réaction du dosage.
5) Calculer la concentration Cb de la base.
6) On dilue 10 fois la solution d'acide initial et on refait le dosage de l'acide AH par la soude,
tracer sue le même papier millimétrée l'allure de la nouvelle courbe de pH = f(Vb )
Exercice 6 Étude d'un produit d'entretien
Sur l'étiquette d'une solution commerciale d'ammoniac (NH3 ) on lit : % massique = 20%.
On prépare 100 mL d'une solution diluée, noté S au 20ième de la solution commerciale, noté
S0
Données :
H : 1.00 g ⋅ mol−1 ⋅ ; N : 14 g ⋅ mol−1 ; Ka = 6.3 ⋅ 10−3 ; pKa = 9.2
1) La mesure du pH à 25∘ de la solution diluée donne pH = 12.
a) Indiquer en justifiant la nature de cette solution.
b) Préciser le nom et la forme de son espèce conjuguée.
c) Écrire le couple acide-base auquel appartient l'ammoniac.
d) Donner le diagramme de prédominance, en fonction de pH , des espèces de ce couple et
en déduire l'espèce prédominante dans la solution S.
2) Pour vérifier les indications de l'étiquette on tire un volume V = 10.0mL par une solution
d'acide chlorhydrique de concentration CA = 5.00 ⋅ 10−1 mol ⋅ L−1 en présence de
quelques gouttes de BBT .
Le changement de teinte de la solution pour un volume VA = 10.8 mL de solution titrante.
a) Écrire l'équation de la réaction support du dosage en précisant toutes les caractéristiques
de cette transformation chimique.
b) Établir l'expression de la constante d'équilibre Kr en fonction de la constante d'acidité Ka.
Calculer sa valeur et conclure.
c) Déterminer la concentration molaire C de la solution ; en déduire la concentration C0 de la
solution commerciale.
d) La mesure de la masse volumique de la solution commerciale donne µ = 920 g ⋅ L−1 .
Déterminer l'expression du pourcentage massique de la solution commerciale en fonction de
C0 ; M et µ.
Calculer sa valeur et conclure.
3) Lors de ce titrage, la mesure du pH de la solution lorsqu'on a versé un volume
VA′ = 6.0 mL d'acide chlorhydrique donne pH = 9.0.
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 5 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
a) Déterminer de l'avancement final, l'avancement maximal à l'aide d'un tableau descriptif de
l'évolution du système chimique.
c) Montrer en calculant le taux d'avancement final que la transformation est quasi-totale.
Exercice 7 (Acide fort et acide faible)
On réalise le dosage pH métrique de 10 mL de deux acides AH1 et AH2 par une solution
d'hydroxyde de sodium versé.
L'un des deux acides est fort, l'autre est faible.
Acide AH1
VB1 0 2 4 6 8 9 9.9 10 10.1 12 15
pH 1 1.2 1.4 1.6 2 2.3 3.3 7 10.7 12 12.3
Acide AH2
VB2 0 1 2 3 4 5 6 7 8 9 9.9 10 10.1 11 12 15
pH 1 2.9 3.8 4.2 4.6 4.8 5 5.2 5.4 5.8 6.8 8.7 10.7 11.7 12 12.3
1) Faire un schéma annoté du dispositif expérimental.
2) Tracer pour les deux acides, sur un même graphique, les courbes pH1 = f(VB1 ) et
pH2 = f(VB2 ).
Échelle : 1 cm pour une unité pH et 1 cm pour 1 mL.
3) Identifier sur le graphique, l'acide fort et l'acide faible.
4) Calculer les concentrations molaires des deux acides.
5) déterminer le pKA et la constante d'acidité de l'acidité faible.
6) Vers quelle valeur tend le pH de la solution acide lorsqu'on continue à ajouter la solution
basique ?
Exercice 8
Pour déboucher les canalisations, on utilise des produits domestique qui sont des solutions
concentrées d'hydroxide de sodium, NaOHs , (soude).
Sur l'étiquette de l'un de ces produits on lit :
− densité d = 1.2 (masse volumique ρ = 1.2 g ⋅ cm−3 )
− contient 20% en masse de soude.
1) Montrer que la concentration molaire C de la solution commerciale est voisine de
6 mol ⋅ L−1 3.
2) Quel volume de solution commerciale faut-il prélever pour obtenir 1 L de solution diluée de
−3
concentration molaire 3 ⋅ 10 mol ⋅ L−1 ?
Les solutions de soude sont des solutions de base forte.
3) a) Rappeler la définition d'une base forte.
b) Calculer le pH de la solution diluée.
Pour vérifier sa concentration, on dose 5 mL de la solution diluée par une solution d'acide
−2
chlorhydrique de concentration CA = 1 ⋅ 10 mol ⋅ L−1 .
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 6 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
4) a) Écrire l'équation bilan de la réaction.
Calculer la concentration de la solution diluée.
Retrouve-t-on la valeur souhaitée ?
Exercice 9
On réalise différentes solutions en mélangeant à chaque opération une solution aqueuse S1
d'un acide carboxylique R − COOH de volume VA et une solution aqueuse S2 de
carboxylate de sodium (R − COONa) de volume VB .
Les concentrations molaires des solutions utilisées pour ces mélanges sont les memes pour
S1 et S2 et égales à C.
Les valeurs du pH de ces solutions pour les couples de valeurs (VA , Vb ) sont indiquées
dans le tableau suivant:
VB (mL) 10 10 10 10 10 20 30 40 50
VA (mL) 50 40 30 20 10 10 10 10 10
pH 3.1 3.2 3.3 3.5 3.8 4.1 4.3 4.4 4.5
VB
1) a) Représenter graphiquement pH = f(x) avec x = log ;
VA
Échelle :
− 10 cm sur l'axe horizontal correspond à l'unité de x.
− 10 cm sur l'axe vertical correspond à l'unité de pH.
b) Montrer que pH = f(x) peut se mettre sous la forme pH = a + bx ; a et b étant deux
constantes que l'on déterminera graphiquement.
3) L'acide R − COOH étant supposé faible, montrer que dans le mélange obtenu on a :
[R − COO− ]
.
[R − COOH]
3) a) Établir l'expression du pH du mélange obtenu en fonction du pKa du rapport
[R − COO− ]
.
[R − COOH]
b) En déduire le pKa de l'acide.
Exercice 10
On propose d'étudier deux solutions aqueuses S1 et S2
1. La solution S1 est obtenue en faisant dissoudre dans 1 L d'eau pure une masse m d'acide
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 7 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
éthanoique.
1.1 Écrire l'équation-bilan entre l'acide éthanoique et l'eau .
1.2 Le pH de cette équation à 25∘ C est 3.4 et le pKa du couple acide/base est 4.78
[CH3 COO− ]
1.2.1 Donner l'expression du pH et calculer le rapport
[CH3 COOH]
1.2.2 Calculer les concentrations molaires des espèces chimiques présentes dans S1
1.2.3 En déduire la concentration CA de la solution S1
1.2.4 Déterminer la masse m introduite.
2. La solutionS2 est une solution d'éthanoate de sodium de concentration molaire
CB = 10−2 mol ⋅ L−1 et de pH = 8.4 à 25∘ C
2.1 Recenser les espèces chimiques présentes dans S2
2.2 Calculer les concentrations molaire de celle-ci
2.3 Calculer la valeur pKa du couple acide/base et la composer à celle donnée au 1.2
3. On ajoute à la solution S1 de concentration molaire CA = 10−2 mol ⋅ L−1 et de volume
VA = 20 mL, la solution S2 de concentration CB = 10−2 mol ⋅ L−1 et de volume
VB = 20 mL pour obtenir une solution S.
3.1 A partir des équations d'électroneutralité et de conservation de la matière, montrer que :
[CH3 COOH] = [CH3 COO−1 ] (On négligera les concentrations des ions H3 O+ et OH −
devant celle des ions Na+ et on ne fera pas de calcul)
3.2 En déduire le pH de la solution S
3.3 Donner le nom et les propriétés de la solution.
Exercice 11
On veut préparer une solution tampon à partir d'une solution commerciale d'acide éthanoique
1) On dispose d'une bouteille commerciale d'acide éthanoique sue laquelle on lit les indications
suivantes :
masse molaire : 60 g ⋅ mol−1
Masse volumique : ρ = 1050 kg/m3
Pureté : 99%
1.1 Déterminer le volume V0 de la solution commerciale qu'il faut prélever pour préparer un
volume Va = 1 L de solution d'acide étha,oique concentration Ca = 0.1 mol ⋅ L−1
1.2 Écrire l'équation bilan de la réaction de l'acide éthanoique avec l'eau.
2. On dispose également d'un flacon d'éthanoate de sodium en poudre portant l'indication
suivante : masse molaire : 82 g/mol
2.1 Déterminer la masse mb d'éthanoate de sodium qu'il faut peser pour préparer un volume
Vb = 500 ml de solution d'éthanoate de sodium de concentration Cb = 0.3 mol/L
2.2 Écrire l'équation de la dissociation de l'éthanoate de sodium dans l'eau.
2.3 Écrire l'équation de la réaction entre un ion éthanoate et l'eau.
3. Préparation de la solution tampon.
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 8 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
3.1 Donner les propriétés d'une solution tampon.
3.2 Donner l'expression de la constante d'acidité Ka du couple d'acide éthanoique ion/
éthanoate et en déduire la relation entre pH et pKa.
3.3 A quelle condition pH = pKa
3.4 On veut préparer un volume V = 100 mL d'une solution tampon à partir des solutions
d'acide éthanoique et d'éthanoate de sodium à Utiliser
4. Détermination expérimentale du pKa du couple acide éthnoique/ion éthanoate
On introduit dans un bécher Va = 20 mL de solution aqueuse d'acide éthanoique on verse
progressivement dans le bécher une solution aqueuse d'hydroxyde de concentration molaire
Cb = 0.1 mol/L.
On relève au fur et à mesure la valeur du pH et on obtient le tableau de mesure ci-dessous
Vb (mL) 2 4 6 8 12 14 16 18 19
pH 2.9 3 3.8 4.6 4.8 5 5.3 5.7 6
Vb (mL) 19.4 19.8 20 20.4 21 22 24 26 30
pH 6.4 6.8 8.8 10.5 11 11.3 11.6 11.8 12
4.1 Tracer la courbe pH = f(Vb
Échelle :
1 cm → unité de pH
1 cm → 2 mL
4.2 Déterminer graphiquement les cordonnées du point d'équivalence E
4.3 Retrouver la valeur de la concentration molaire Ca de la solution d'acide éthanoique
4.4 Déduire de la courbe la valeur du pKa du couple
CH3 COOH|CH3 COO−
Exercice 12
L'étiquette d'une bouteille contenant une solution S0 d'acide chlorhydrique porte les
indications suivantes : Acide chlorhydrique masse volumique µ = 1190 g ⋅ L−1 pourcentage
en masse d'acide chlorhydrique : 37%.
On introduit V = 4.2 mL de S0 dans une fiole jaugée de V0 = 500 mL contenant environ
100 mL d'eau distillée et l'on complète jusqu'au trait de jauge avec de l'eau distillée.
1) Déduire le prélèvement des 4.2 mL de S0 .
2) Pourquoi a-t-on introduit l'eau distillée dans la fiole jaugée avant d'introduire la solution
d'acide chlorhydrique ?
3) Déterminer l'ordre de grandeur de la concentration de la solution S ainsi préparé.
4) Afin de vérifier cette concentration on dose S par une solution B d'hydroxyde de potassium
de concentration CB = 4.00 ⋅ 10−2 mol/L.
Dans 20 mL de cette dernière solution on verse VS mL de la solution S et l'on mesure le pH
après chaque ajout.
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 9 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
On obtient les résultats suivants :
VS 0 1 2 3 4 5 6 7
pH 12.6 12.5 12.45 12.35 12.25 12.10 11.95 11.70
VS 8 8.5 9 10 11 12 13
pH 11.15 3.60 2.72 2.30 2.10 2.0 1.90
a) Faire un schéma annoté du dispositif utilisé pour le dosage.
b) Construire la courbe pH = f(VS ).
Déterminer le volume équivalent VSe .
c) En déduire la concentration de la solution S.
Conclure.
5) Choisir dans la liste ci-dessous un indicateur coloré adapté pour ce dosage et indiquer
l'évolution de teinte lors du virage.
Justifier la réponse.
Indicateur
a) Hélianthine
b) Bleu de bromophénol
c) Bleu de bromothymol
Zone de virage et couleur
− rouge 3.1 − 4.4 jaune
− jaune 3.0 − 4.6 bleu
− jaune 6.0 − 7.6 bleu
▶ Correction des exercices
Auteur: Amary Thiam & Sidy Mouhamed Ndiaye
Ajouter un commentaire
Commentaires
Ibrahim (non vérifié)
mer, 01/18/2023 - 11j07
Témoignage
permalien
Très satisfait des exercices proposés
répondre
Ajouter un commentaire
Votre nom
Objet
Comment *
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 10 sur 11
Série d'exercices sur Dosage Acide - Base - Ts | sunudaara 15/02/2023 22(15
Aucune balise HTML autorisée. Plus d'information sur les formats de texte
Les adresses de pages web et de courriels
sont transformées en liens automatiquement.
Enregistrer Aperçu
https://www.sunudaara.com/physique_chimie/série-dexercices-sur-dosage-acide-base-ts Page 11 sur 11
Vous aimerez peut-être aussi
- CHimie Terminale S Tome 1Document49 pagesCHimie Terminale S Tome 1Anna Guéye89% (9)
- Corr Exos Supp Chimie 6 Titrages PDFDocument5 pagesCorr Exos Supp Chimie 6 Titrages PDFDenis BurettePas encore d'évaluation
- TP #2 Dosage de L'acide Phosphorique Dans Une Boisson Au ColaDocument4 pagesTP #2 Dosage de L'acide Phosphorique Dans Une Boisson Au Colatitebin50% (2)
- La Consistance de SolDocument3 pagesLa Consistance de SolAbdelali Sol100% (1)
- Cours Chimie 02Document3 pagesCours Chimie 02imen dimessiPas encore d'évaluation
- TD Acide Faible-2024-Lsll - WahabdiopDocument2 pagesTD Acide Faible-2024-Lsll - Wahabdiopxydj5wh2wb100% (1)
- 1cm3jftoi 866968Document2 pages1cm3jftoi 866968bipPas encore d'évaluation
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- TD Acide Faible-2024-Lsll - WahabdiopDocument4 pagesTD Acide Faible-2024-Lsll - WahabdiopAmadou Oury DialloPas encore d'évaluation
- Bac Blanc (Chimie) GSFADocument3 pagesBac Blanc (Chimie) GSFAahmed amilPas encore d'évaluation
- C17 Resolu2Document1 pageC17 Resolu2Imene ImenePas encore d'évaluation
- Methode GranDocument29 pagesMethode GranASMAA KherrazPas encore d'évaluation
- Rapport Chimie PDFFDocument8 pagesRapport Chimie PDFFFati TLPas encore d'évaluation
- Cours PCT A TIRERDocument60 pagesCours PCT A TIRERJoy TowendoPas encore d'évaluation
- Exercice Chimie 3Document8 pagesExercice Chimie 3Idris HammouchePas encore d'évaluation
- TAT Équilibre Acido-BasiqueDocument17 pagesTAT Équilibre Acido-Basiquedrakox.fortnitePas encore d'évaluation
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 pagesC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniPas encore d'évaluation
- 2012 DS1 Acide Base PDFDocument2 pages2012 DS1 Acide Base PDFFoudil LaouiciPas encore d'évaluation
- 201702130116235Document7 pages201702130116235Maria KhouryPas encore d'évaluation
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Faculté Pluridisciplinaire de Nador SVIDocument4 pagesFaculté Pluridisciplinaire de Nador SVIZakaria AsbaiPas encore d'évaluation
- TD Acide Faible Classification 2019 LSLL WahabDocument2 pagesTD Acide Faible Classification 2019 LSLL WahabOumou Khaïry DiopPas encore d'évaluation
- Chim SolDocument4 pagesChim SolÆm Inē100% (2)
- Correction Exercice Type Bac Dosage Acide BaseDocument3 pagesCorrection Exercice Type Bac Dosage Acide BaseColinePas encore d'évaluation
- Chemical Engineering LabDocument15 pagesChemical Engineering LabOmairPas encore d'évaluation
- Le PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014Document15 pagesLe PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014RachidaPas encore d'évaluation
- Resumé-Chimie Des SolutionsDocument6 pagesResumé-Chimie Des Solutionsfzsaci26Pas encore d'évaluation
- Micro MDocument28 pagesMicro Ml3bsectionbPas encore d'évaluation
- TP PH Metre ATHIR - New1Document8 pagesTP PH Metre ATHIR - New1samibenhabilePas encore d'évaluation
- TD Tampon 2019 LSLL WahabdiopDocument2 pagesTD Tampon 2019 LSLL WahabdiopOumou Khaïry DiopPas encore d'évaluation
- GPS Mesures Incertitudes 2014 S Determination Pka Acide EthDocument6 pagesGPS Mesures Incertitudes 2014 S Determination Pka Acide EthCassandra LamarchePas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- TD 3ème CEGDocument25 pagesTD 3ème CEGAlain DEMBIPas encore d'évaluation
- Serie CoronaDocument15 pagesSerie CoronaJoséphine NancassePas encore d'évaluation
- C SERIE C8. Dosage Acide Base IDocument3 pagesC SERIE C8. Dosage Acide Base IEya MtibaaPas encore d'évaluation
- Pendule Élastique - Oscillateurs Mécaniques - Aspects Énergétiques - Examen National 2017 SM FRDocument8 pagesPendule Élastique - Oscillateurs Mécaniques - Aspects Énergétiques - Examen National 2017 SM FRPlisskenPas encore d'évaluation
- الامتحان الوطني في الفيزياء والكيمياء ترجمة فرنسية 2017 مسلك علوم رياضية ترجمة فرنسية الدورة الاستدراكية PDFDocument18 pagesالامتحان الوطني في الفيزياء والكيمياء ترجمة فرنسية 2017 مسلك علوم رياضية ترجمة فرنسية الدورة الاستدراكية PDFGshd GamingPas encore d'évaluation
- Chimie 2 PDFDocument8 pagesChimie 2 PDFTarik Mlilas50% (2)
- TransReaAcideBaseExercices 16-17 PDFDocument7 pagesTransReaAcideBaseExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Correction TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Document9 pagesCorrection TD2 - Calculs de PH (Exos 4,5,6,7,8) V2Amir NadeauPas encore d'évaluation
- 26 Dosage 3Document3 pages26 Dosage 3Ilyes Ben Jemaa0% (1)
- Notion PH EXOSDocument2 pagesNotion PH EXOSAbel MalléPas encore d'évaluation
- Chapitre VI Réaction ABDocument6 pagesChapitre VI Réaction ABSarah DiomandePas encore d'évaluation
- Acide BaseDocument14 pagesAcide Baseالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- TP de Chimie N 1Document10 pagesTP de Chimie N 1Rayane BEKKOUCHEPas encore d'évaluation
- Détermination de La Constante D'aciditéDocument3 pagesDétermination de La Constante D'aciditéAnis Dahnen100% (2)
- Chapitre 18Document10 pagesChapitre 18Ayman Ebn taouaitPas encore d'évaluation
- Travaux Pratiqe n1 de Chimi1Document14 pagesTravaux Pratiqe n1 de Chimi1douniasadok85Pas encore d'évaluation
- 2022 NelleCaledo J1 ExoA Correction AcBenzoique 5ptsDocument2 pages2022 NelleCaledo J1 ExoA Correction AcBenzoique 5ptsredatwitch2006Pas encore d'évaluation
- Exercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseIman QPas encore d'évaluation
- Ds Destop CorrecDocument11 pagesDs Destop CorrecDenis BurettePas encore d'évaluation
- Correction - TD 6 Acide BaseDocument8 pagesCorrection - TD 6 Acide BaseBILLBOARD TOP AFRICAPas encore d'évaluation
- 6129e58d84154reactions Acide Base Solutions Tampons Chimie TermDocument7 pages6129e58d84154reactions Acide Base Solutions Tampons Chimie TermPrince Informaticien GamesPas encore d'évaluation
- Bac CH 2000Document2 pagesBac CH 2000Haman Bello OumarouPas encore d'évaluation
- Ptsi - I1 TD.C4 Réactions Acido-Basiques Et de Précipitation I-Réactions Acido-BasiquesDocument2 pagesPtsi - I1 TD.C4 Réactions Acido-Basiques Et de Précipitation I-Réactions Acido-Basiquesnoamassin78Pas encore d'évaluation
- PH Avec CorrectionDocument7 pagesPH Avec Correctionaminamaaloul09Pas encore d'évaluation
- Suivi Titrage ExercicesDocument12 pagesSuivi Titrage Exercicespatatake2.0Pas encore d'évaluation
- Série Acide - BaseDocument6 pagesSérie Acide - BaseMehdi Bnmssd100% (1)
- Compte Rendu Ph-MètrieDocument8 pagesCompte Rendu Ph-MètrieIKRAM BOULAJOUL75% (4)
- TP 01 Chimie MinéraleDocument6 pagesTP 01 Chimie Minéraleabderrahmanemegherbi3Pas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Cours3 Etude Thermodynamique Du MoteurDocument4 pagesCours3 Etude Thermodynamique Du MoteurReda kawakibPas encore d'évaluation
- Poutres Dalles 2 Sens PDFDocument1 pagePoutres Dalles 2 Sens PDFOussama BoussahfaPas encore d'évaluation
- Beckers 2011 Helio 008 - Calcul Du Rayonnement Solaire Attenue Par LatmosphereDocument17 pagesBeckers 2011 Helio 008 - Calcul Du Rayonnement Solaire Attenue Par LatmosphereOmar DioufPas encore d'évaluation
- PH Calibration Poster A3 FR 30131318 V03.14 Original 31664Document1 pagePH Calibration Poster A3 FR 30131318 V03.14 Original 31664Armand Muteb AmkPas encore d'évaluation
- 07 Le Principe de La Refrigeration ConvertiDocument4 pages07 Le Principe de La Refrigeration Convertikhaled bouzidiPas encore d'évaluation
- Support de Cours Thermodynamique 2020Document59 pagesSupport de Cours Thermodynamique 2020ahlemmPas encore d'évaluation
- Capteur TemperatureDocument9 pagesCapteur Temperatureاشر اقPas encore d'évaluation
- ELONGO-BG - Thèse FinalDocument172 pagesELONGO-BG - Thèse FinalelongoPas encore d'évaluation
- 005a MEC625 Procede AutresDocument20 pages005a MEC625 Procede Autresjeanchristophereid90Pas encore d'évaluation
- Lois Du Mouvement de NewtonDocument10 pagesLois Du Mouvement de NewtonAndra LefterPas encore d'évaluation
- Diffusion MoleculaireDocument13 pagesDiffusion MoleculaireSébastien NiyonzimaPas encore d'évaluation
- 2404202011210199999754802Document2 pages2404202011210199999754802Kawthar TouzaniPas encore d'évaluation
- Correction - Seance 7 - TD EM2 CorDocument6 pagesCorrection - Seance 7 - TD EM2 CortchombathieryPas encore d'évaluation
- BTS Chimie Fiche 6 Oxydoréduction 2Document1 pageBTS Chimie Fiche 6 Oxydoréduction 2sonia moullaPas encore d'évaluation
- Travaux Diriges Avec CorrectionDocument2 pagesTravaux Diriges Avec CorrectionAliOucharPas encore d'évaluation
- Ch3 - Matériaux DiélectriquesDocument23 pagesCh3 - Matériaux DiélectriquesMãl Îk100% (2)
- RappelDocument28 pagesRappelkiwanmarylynn3Pas encore d'évaluation
- Etude D'une Salle Omni Sport en Charpente MétalliqueDocument179 pagesEtude D'une Salle Omni Sport en Charpente MétalliqueMejda KPas encore d'évaluation
- Ap 15 11 22Document6 pagesAp 15 11 22enzo 07Pas encore d'évaluation
- BopDocument21 pagesBopMansour M.TaherPas encore d'évaluation
- FinalDocument168 pagesFinalBorhane eddine DoghbalPas encore d'évaluation
- PotentielDocument38 pagesPotentielMohamed AminePas encore d'évaluation
- Calcul Perte de ChargeDocument7 pagesCalcul Perte de ChargeReda ChattahyPas encore d'évaluation
- CHA5 MagnétismeDocument27 pagesCHA5 Magnétismemohamed farahPas encore d'évaluation
- Planning Examens S1 GC 23 24Document17 pagesPlanning Examens S1 GC 23 24imane BelaalaPas encore d'évaluation
- Corrigé TD - Element Machinebvfds - CFM3Document7 pagesCorrigé TD - Element Machinebvfds - CFM3Nada GhammemPas encore d'évaluation
- Caracteristiques Armatures ACA23052019 DSIDocument1 pageCaracteristiques Armatures ACA23052019 DSIdurand.bastienPas encore d'évaluation
- TD Exos Geophysique LPH2 Oct 2023Document5 pagesTD Exos Geophysique LPH2 Oct 2023oubedathsadikouPas encore d'évaluation
- Es-En DS M140 UtilcellDocument2 pagesEs-En DS M140 Utilcellanon_51653190Pas encore d'évaluation