Académique Documents
Professionnel Documents
Culture Documents
Examen1 Opérations Unitaires
Transféré par
Ones JemaiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Examen1 Opérations Unitaires
Transféré par
Ones JemaiDroits d'auteur :
Formats disponibles
République Algérienne Démocratique et Populaire Ministère
de l’Enseignement Supérieur et de la Recherche Scientifique
Université Belhadj Bouchaib– Ain Témouchent
Faculté des Sciences Et de Technologie
Département de Génie Mécanique
Licence 3 Génie des Procédés
Le 28/05/2022 Durée 1h
Examen de l’Opération Unitaire 1
Exercice 1 : 10 pts
On utilise 3000 kg/h d’eau pure pour éliminer les vapeurs d’acétone. La composition molaire initiale de l’acétone dans
la phase gazeuse est de 6% et la composition finale de l’acétone après transfert est de 0,00128 kmol d’acétone/kmol
d’air.
Le débit de la phase gazeuse est de 1400 m3/h sachant que son volume molaire est égale 24.04 m3/Kmol et l’équation
de ligne d’équilibre est sous forme Y=1.68X.
1. Calculer les quantités de matière transférées en kmol/h ?
2. Calculer la composition molaire finale de l’acétone (Xsortie) dans l’eau.
3. Déterminer le nombre d’étage théorique de la colonne ?
Données : M (H2O) = 18 g/mol.
Corrigé de l’exercice 01 : 10 pts
1) Calcul les quantités de matière transférées en kmol/h
Quantités de matière de la phase liquide (L) en kmol/h
L(kmol/h) = L*(kg/h)x1/M(H2O)……………………….M(H2O)= 18 kg/kmol 1pt
L(kmol/h) = 3000(kg/h)x 1/18 [1/kg/kmol]
L(kmol/h) = 166,66 kmol/h 1pt
Quantités de matière de la phase gazeuse (G) en kmol/h
G(kmol/h) = G* (m3/h) x 1/VM [1/kmol/m3]………………………….. VM : volume molaire = 24,04 (kmol/(m3) 1pt
G(kmol/h) = 1400 (m3/h) x 1/24,04 [1/kmol/m3]
G(kmol/h) =58,23 kmol/h 1pt
2) la composition molaire finale de l’acétone (Xsortie) dans l’eau
Suivant les données la Colonne ; la somme des débits entrant est égale la somme des débits sortants de gaz et de
liquide suivant un bilan global et un bilan partiel sue le soluté qui est l’acétone : Le solvant pur (eau entrée Xe =0)
X, Y: rapport molaire
x: y composition ou fraction molaire
A/Calcul de rapport molaire de la phase gazeuse de l’entrée (Ye) :
Ye = Yacétone/Yair Ye = ye/(1-ye) 0,5pt
Ye = 0,06/(1-0,06) Ye = 0,0638(kmol de A/ kmol de B) 1pt
B/ Bilan global : L sortie + G sortie = L entrée + G entrée 0,5pt
C/ Bilan partiel de soluté :
Xs Ls + Ys Gs = XeLe + YeGe 0,5pt
XsL = G (Ye-Ys) Xs = [G (Ye-Ys)]*(1/L) 0,5pt
Xs = (58,23/166,66) x (0,0638-0.00128) Xs = 0,0218 (kmol de A/ kmol de B) 1pt
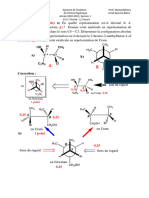
3) Graphe
Droite opératoire: (Xe, Ys) (0, 0,00128), (Xs, Ye) (0,0218, 0,0638)
Droite d’équilibre Y = 1,68X
NET= 6 2pts
Dr BELKHADEM Fatima Bonne chance
République Algérienne Démocratique et Populaire Ministère
de l’Enseignement Supérieur et de la Recherche Scientifique
Université Belhadj Bouchaib– Ain Témouchent
Faculté des Sciences Et de Technologie
Département de Génie Mécanique
Exercice 2 :
Sur la figure ci-dessous est représenté le diagramme d’équilibre liquide-vapeur relatif au mélange de deux liquides A
et B. En utilisant ce diagramme, répondre aux questions suivantes :
Dr BELKHADEM Fatima Bonne chance
République Algérienne Démocratique et Populaire Ministère
de l’Enseignement Supérieur et de la Recherche Scientifique
Université Belhadj Bouchaib– Ain Témouchent
Faculté des Sciences Et de Technologie
Département de Génie Mécanique
Exercice 2 :
Réponses
1) La température d’ébullition normale du liquide A = 110°C et B = 70°C (0,5pt+0,5pt)
2) Le liquide le plus volatile est le composant B (Teb de B < Teb de A) 0,5pt
Oui d’après le diagramme, Les deux liquides A et B sont miscibles en toutes proportions pour qu’on puisse faire la
séparation
3) Les courbes (1) c’est la courbe de rosée et (2) c’est la courbe de bulle (0,5pt+0,5pt)
Les différentes phases sur le diagramme :
Phases 1 : liquide, Phases 2 : liquide + vapeur, Phases 3 : Vapeur (0,5pt+0,5pt+0,5pt)
4) À température T=75°C commence l’ébullition d’un mélange de fraction molaire xA= 0,2 sous pression 1 atm 1pt
5) Quelles sont, à 98 °C et sous 1atm, les compositions du liquide xA= 0,84 et de la vapeur en équilibre yA= 0,36 1pt
6) À température T=109°C se termine l’ébullition d’un liquide de fraction molaire xB=0,30 sous 1 atm où xA= 0,7
c’est-à-dire (xA+ xB=1) 0,5pt
7) À température T=108°C commence à se condenser une vapeur de fraction molaire yB=0,60 sous 1 atm 1pt
8) À température T=86°C se termine la condenser d’une vapeur de fraction molaire yB=0,60 sous 1 atm 1pt
9) La composition de la première goutte de liquide XB=0,94 (en équilibre avec la vapeur) formé lors de la
condensation d’une vapeur de fraction molaire yA= 0,6 sous 1atm ? 0,5pt
Schéma 1pt
Dr BELKHADEM Fatima Bonne chance
Vous aimerez peut-être aussi
- Correction td3Document11 pagesCorrection td3Hendou MohamedPas encore d'évaluation
- Cours ThermodynamiqueDocument36 pagesCours ThermodynamiqueMeryem RakbaPas encore d'évaluation
- Équilibre Liquide-Vapeur Des Corps PursDocument17 pagesÉquilibre Liquide-Vapeur Des Corps PursaminePas encore d'évaluation
- Dernier TP DistillationDocument19 pagesDernier TP Distillationmeriem100% (2)
- TP 2 IPSA Loi de Biot Et Savart Helmoltz 2010-2011Document7 pagesTP 2 IPSA Loi de Biot Et Savart Helmoltz 2010-2011hind Ait BrahimPas encore d'évaluation
- Spectroscopie Chapitre 4 Et TD Corrigé-L2-V2019-2020Document19 pagesSpectroscopie Chapitre 4 Et TD Corrigé-L2-V2019-2020Houho Dz0% (1)
- Module 16: Thermodynamique 2 (Cours)Document137 pagesModule 16: Thermodynamique 2 (Cours)Mohamed SmimahPas encore d'évaluation
- Spectroscopie Chapitre 1 Et TD Corrigé-L2-V2019-2020Document24 pagesSpectroscopie Chapitre 1 Et TD Corrigé-L2-V2019-2020Houho DzPas encore d'évaluation
- Examen Final-Chimie 1Document1 pageExamen Final-Chimie 1Souha BenaichaPas encore d'évaluation
- TP 2 MNDocument9 pagesTP 2 MNAmir Na DzPas encore d'évaluation
- Compte Rendu Final E141 TP 3Document5 pagesCompte Rendu Final E141 TP 3Ayman AmkassouPas encore d'évaluation
- Serie 2 TD BMEDocument2 pagesSerie 2 TD BMEHendou MohamedPas encore d'évaluation
- TD 02Document3 pagesTD 02yousraghanem23Pas encore d'évaluation
- Appel CNPMA'2021Document2 pagesAppel CNPMA'2021Youcef Fermi100% (1)
- Chapitre I (Potentiel Chimique) 2015Document37 pagesChapitre I (Potentiel Chimique) 2015Chaouki100% (1)
- TD - N°4 17 18Document2 pagesTD - N°4 17 18SannadPas encore d'évaluation
- Corrige Dut D 1 A Cous TiqueDocument5 pagesCorrige Dut D 1 A Cous TiquedouoPas encore d'évaluation
- SV1 Chimie1Document49 pagesSV1 Chimie1Yassine ElkaPas encore d'évaluation
- Entr OpieDocument2 pagesEntr OpieamelPas encore d'évaluation
- TD 1thermoDocument2 pagesTD 1thermoGhassen BoussaaPas encore d'évaluation
- 4-Mécanique Des Fluides Et Mathématiques Faciles - Excercice Poussé DarchimèdeDocument6 pages4-Mécanique Des Fluides Et Mathématiques Faciles - Excercice Poussé DarchimèdeYoucef MiPas encore d'évaluation
- DS 14 15 rtp2Document6 pagesDS 14 15 rtp2Mohammed MarzougPas encore d'évaluation
- Thermodynamique 2Document15 pagesThermodynamique 2jyPas encore d'évaluation
- TP 2 - Méthode Des Points Fix Et Méthodes de Newton - SolutionDocument2 pagesTP 2 - Méthode Des Points Fix Et Méthodes de Newton - SolutionTō Rā YhPas encore d'évaluation
- (WWW - Clubetudiants.ma) - Cours de Thermodynamique Nov 2015Document135 pages(WWW - Clubetudiants.ma) - Cours de Thermodynamique Nov 2015Rondello99Pas encore d'évaluation
- Cours Thermodynamique Physique - Chap0Document26 pagesCours Thermodynamique Physique - Chap0الدعم الجامعيPas encore d'évaluation
- Diff Finies Serie Exer 2019 20Document8 pagesDiff Finies Serie Exer 2019 20Ishak KETTAFPas encore d'évaluation
- En9 5Document1 pageEn9 5KhaLed BenKaPas encore d'évaluation
- $RFCGXUMDocument2 pages$RFCGXUMChikov ÆminePas encore d'évaluation
- Boulika Bourkane Derrouich Groupe 3 PDFDocument5 pagesBoulika Bourkane Derrouich Groupe 3 PDFHamza BoulikaPas encore d'évaluation
- TP1 EltDocument8 pagesTP1 EltLakhdari BoutheinaPas encore d'évaluation
- Thermochimie Fiche CoursDocument3 pagesThermochimie Fiche CoursFZL100% (1)
- DS8 PsiDocument5 pagesDS8 Psiourrslim78Pas encore d'évaluation
- TdchigenDocument21 pagesTdchigenIlhame Alâbouch100% (1)
- TP 2 AnalysetemporelledessystemeslineairesDocument3 pagesTP 2 AnalysetemporelledessystemeslineairesYousra Khelfallah100% (1)
- Rattrapage S4 - Juin 2019 - SolutionDocument6 pagesRattrapage S4 - Juin 2019 - SolutionIm printPas encore d'évaluation
- ResumeDocument2 pagesResumeMounaim Matini100% (1)
- Exam PDF SMC SDocument2 pagesExam PDF SMC SUsnPas encore d'évaluation
- Reaction Chimique Complet PDFDocument25 pagesReaction Chimique Complet PDFabderrahimn100% (1)
- CNC MP 2010 Physique 2 EpreuveDocument10 pagesCNC MP 2010 Physique 2 EpreuveYassir Sadiq ElfilaliPas encore d'évaluation
- Solution EF-OV-2021-22Document5 pagesSolution EF-OV-2021-22ZoZo ChenPas encore d'évaluation
- Polycopié 7 - Examen ThermochimieDocument2 pagesPolycopié 7 - Examen ThermochimieZougmoréPas encore d'évaluation
- L3 TheorieGroupes Methodes HuckelDocument8 pagesL3 TheorieGroupes Methodes HuckelAbdoulaye tembelyPas encore d'évaluation
- Mecanique Serie 3Document2 pagesMecanique Serie 3maryem sousitaPas encore d'évaluation
- DynSystChap2 7 (Ailettes)Document11 pagesDynSystChap2 7 (Ailettes)Sokhona hawaPas encore d'évaluation
- Travaux Dirigés CHM101 - Série N°1Document5 pagesTravaux Dirigés CHM101 - Série N°1RV EtsePas encore d'évaluation
- TP3 Chimie 2Document4 pagesTP3 Chimie 2Roudaina BenzeguirPas encore d'évaluation
- Bilan Radiatif Fiche de RevisionDocument2 pagesBilan Radiatif Fiche de RevisionLPas encore d'évaluation
- Chimie Théorique TD1Document2 pagesChimie Théorique TD1thegthed0% (1)
- TD ChimieDocument50 pagesTD ChimieHoussam BenkerroumPas encore d'évaluation
- Série 03Document5 pagesSérie 03Dadiom AbdouPas encore d'évaluation
- TF06 P12 FinalDocument5 pagesTF06 P12 FinalthekrumpPas encore d'évaluation
- Compte Rendu: TP 3: Mesure de Coefficient de Compressibilité Isotherme Du Gaz SF6Document3 pagesCompte Rendu: TP 3: Mesure de Coefficient de Compressibilité Isotherme Du Gaz SF6oussama bensassiPas encore d'évaluation
- 05 TP 03 - Méthode de Point FixeDocument4 pages05 TP 03 - Méthode de Point FixeGhalia imane AboubPas encore d'évaluation
- Résumé Chapitre03Document20 pagesRésumé Chapitre03maîgaPas encore d'évaluation
- TPCorrCeFe 4Document2 pagesTPCorrCeFe 4Amelie Pinchon100% (1)
- Chapitre VDocument4 pagesChapitre VBelinda Dancheu100% (1)
- Electro 11 BestDocument175 pagesElectro 11 BestMadelaine Sassou Nguesso100% (1)
- Examen1 Opérations UnitairesDocument3 pagesExamen1 Opérations UnitairesLawrence Mundene-timotheePas encore d'évaluation
- Corrigé Examen OPU1+2022Document3 pagesCorrigé Examen OPU1+2022Lawrence Mundene-timotheePas encore d'évaluation
- Livre Blanc La Mode Sans PlastiqueDocument36 pagesLivre Blanc La Mode Sans PlastiqueOnes JemaiPas encore d'évaluation
- Cellulose 2Document128 pagesCellulose 2Ones JemaiPas encore d'évaluation
- Ajol File Journals - 490 - Articles - 233398 - Submission - Proof - 233398 5785 565359 1 10 20221004Document13 pagesAjol File Journals - 490 - Articles - 233398 - Submission - Proof - 233398 5785 565359 1 10 20221004Ones JemaiPas encore d'évaluation
- News 31717 Synthese FRB Repartition BiomasseDocument6 pagesNews 31717 Synthese FRB Repartition BiomasseOnes JemaiPas encore d'évaluation
- TP DistillationDocument19 pagesTP DistillationOnes JemaiPas encore d'évaluation
- Corrigé Type de La Série 2 Sur Le BilanDocument3 pagesCorrigé Type de La Série 2 Sur Le BilanOnes JemaiPas encore d'évaluation
- Résumé1 Opérations UnitairesDocument17 pagesRésumé1 Opérations UnitairesOnes JemaiPas encore d'évaluation
- Geodynamique Du Globe Première AnnéeDocument26 pagesGeodynamique Du Globe Première AnnéeOnes JemaiPas encore d'évaluation
- Exa Cor L2 S1 Ecu 1 2021Document5 pagesExa Cor L2 S1 Ecu 1 2021Ones JemaiPas encore d'évaluation
- File 1671125143989Document2 pagesFile 1671125143989Ones JemaiPas encore d'évaluation
- Et Donc: Une Espèce Chimique À Une Onde Électromagnétique RadiofréquenceDocument2 pagesEt Donc: Une Espèce Chimique À Une Onde Électromagnétique RadiofréquenceOnes JemaiPas encore d'évaluation
- L2 133EN001 Chapitre3b EtudiantsDocument24 pagesL2 133EN001 Chapitre3b EtudiantsOnes JemaiPas encore d'évaluation
- Distillation Des Huiles EssentiellesDocument24 pagesDistillation Des Huiles Essentiellesmeriamalaimi01Pas encore d'évaluation
- DistillationExtraction V1Document181 pagesDistillationExtraction V1Samuel Nikhil Avaby100% (1)
- Cours Thermodynamique-ConvertiDocument45 pagesCours Thermodynamique-ConvertiRedOne DerrouazinPas encore d'évaluation
- Courbe Du RésiduDocument263 pagesCourbe Du RésiduChërchěf DjămiīlåPas encore d'évaluation
- Résumé ThermochimieDocument9 pagesRésumé ThermochimiejeanPas encore d'évaluation
- Cours DistillationDocument86 pagesCours DistillationAnesPas encore d'évaluation
- Seq 7 ExercicesDocument4 pagesSeq 7 ExercicesMõ ÖnPas encore d'évaluation
- Généralités Sur Les Opérations UnitairesDocument20 pagesGénéralités Sur Les Opérations Unitairesjakobslimani02Pas encore d'évaluation
- Distillation Flash PDFDocument14 pagesDistillation Flash PDFSarah sarahPas encore d'évaluation
- COURSDocument32 pagesCOURSthomas yapiPas encore d'évaluation
- Thermo III L3 - 2021 - p1Document25 pagesThermo III L3 - 2021 - p1Salah Eddine SafyounPas encore d'évaluation
- Ch3.2.equilibre Liquide VapeurDocument5 pagesCh3.2.equilibre Liquide VapeurLounes RababPas encore d'évaluation
- Cours Opération Unitaire 1Document91 pagesCours Opération Unitaire 1Ayoub ArrarPas encore d'évaluation
- Master 1 Genie Des Procedes Physico-Chimiques: Ue Modelisation Thermodynamique de La MatiereDocument29 pagesMaster 1 Genie Des Procedes Physico-Chimiques: Ue Modelisation Thermodynamique de La Matiereichrak zedamPas encore d'évaluation
- Chapitre 4 - Équilibre PhysiqueDocument14 pagesChapitre 4 - Équilibre PhysiqueRAMDEPas encore d'évaluation