Académique Documents
Professionnel Documents
Culture Documents
Cours - Physique Loi de Moderation Et Loi Daction de Masse - Bac Math (2013-2014) MR Afdal Ali
Transféré par
ceddmefTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Cours - Physique Loi de Moderation Et Loi Daction de Masse - Bac Math (2013-2014) MR Afdal Ali
Transféré par
ceddmefDroits d'auteur :
Formats disponibles
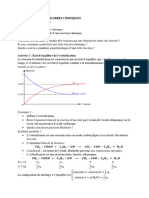
Cours chimie : Loi d’action de masse et loi de modération 4émeM S- exp
A- Définitions
Une transformation chimique est dit totale lorsque a’ la fin de la réaction le réactif limitant
avait totalement disparu.
Une transformation chimique est dit limitée lorsque le réactif limitant n’a pas disparu
totalement a’ la fin de la réaction.
On dit qu’un système chimique et dans un état d’équilibre chimique a’ température et pression
constante lorsque les concentrations des réactifs et des produits n’évoluent plus, cet état
correspond a l’état final de la réaction.
B- Taux d’avancement final d’une réaction
Soit X eq : L’avancement a’ l’équilibre.
𝑿𝒆𝒒
Soit X max : L’avancement maximal. Ʈf =
𝑿𝒎𝒂𝒙
𝑺𝒊 = 𝟏 ∶ 𝑻𝒓𝒂𝒏𝒔𝒇𝒐𝒓𝒎𝒂𝒕𝒊𝒐𝒏 𝒕𝒐𝒕𝒂𝒍
�
𝑺𝒊 〈 𝟏 ∶ 𝑻𝒓𝒂𝒏𝒔𝒇𝒐𝒓𝒎𝒂𝒕𝒊𝒐𝒏 𝒍𝒊𝒎𝒊𝒕é𝒆
C- L’estérification et l’hydrolyse
L’estérification est une réaction entre un acide et un alcool, elle conduit a’ un ester et de l’eau.
Acide + Alcool Ester + eau
RCOOH + R’OH RCOOR’ + H 2O
C’est une réaction lente, limitée et athermique.
L’hydrolyse est une réaction entre un ester et de l’eau, elle conduit a’ un acide et un alcool.
Ester + eau Acide + Alcool
RCOOR’ + H 2O RCOOH + R’OH
C’est une réaction lente, limitée et athermique.
L’estérification et l’hydrolyse sont deux transformation chimique l’une inverse de l’autre.
D- Loi d’action de masse
Soit l’équation chimique
aA + bB cC + Dd
Soit π la fonction de concentration.
[𝑪]𝒄 . {𝑫]𝒅
Π = {𝑨]𝒂 [𝑩]𝒃
: a’ l’équilibre π = K (constante d’équilibre)
.
Elaboré par Afdal Ali : GSM : 26548242 Page 1
Cours chimie : Loi d’action de masse et loi de modération 4émeM S- exp
𝑺𝒊 𝝅 〈 𝒌 ∶ 𝑳𝒂 𝒓é𝒂𝒄𝒕𝒊𝒐𝒏 𝒅𝒊𝒓𝒆𝒄𝒕𝒆 𝒆𝒔𝒕 𝒑𝒐𝒔𝒔𝒊𝒃𝒍𝒆 𝒔𝒑𝒂𝒏𝒕𝒂𝒏𝒆𝒎𝒆𝒏𝒕
�
𝑺𝒊 𝝅 > 𝑘: 𝐿𝑎 𝑟é𝑎𝑐𝑡𝑖𝑜𝑛 𝑖𝑛𝑑𝑖𝑟𝑒𝑐𝑡𝑒 𝑒𝑠𝑡 𝑝𝑜𝑠𝑠𝑖𝑏𝑙𝑒 𝑠𝑝𝑎𝑛𝑡𝑎𝑛𝑒𝑚𝑒𝑛𝑡
C- Loi de modération
1- Loi de modération relative à la variation de concentration :
Toute augmentation de la concentration de l’un des réactifs ou diminution de la
concentration de l’un des produits fait déplacer l’équilibre dans le sens direct.
Toute diminution de la concentration de l’un des réactifs ou augmentation de la
concentration de l’un des produits fait déplacer l’équilibre dans le sens inverse.
2- Loi de modération relative à la variation de température :
Toute augmentation de température fait déplacer l’équilibre dans le sens
endothermique. (Sens inverse)
Toute diminution de température fait déplacer l’équilibre dans le sens exothermique.
(Sens directe)
3- Loi de modération relative à la variation de pression :
Toute augmentation de la pression à température constante fait déplacer l’équilibre
dans le sens où le nombre de moles gazeux diminue.
a.A (gaz) + b.B (gaz) c.C (gaz) + d.D (gaz)
Si a + b 〈 c + d le système évolue dans le sens inverse.
Si a+b > c+d le système évolue dans le sens direct.
Toute diminution de la pression à température constante fait déplacer l’équilibre dans le
sens où le nombre de moles gazeux augmente.
si a+b 〈 c+d le système évolue dans le sens direct.
Si a+b > c+d le système évolue dans le sens inverse.
Enoncé de la loi de modération :
Pour un système chimique en état d’équilibre, toute modification de l’un des
facteurs d’équilibre déplace celui-ci dans le sens qui tend à modérer cette
modification.
Elaboré par Afdal Ali : GSM : 26548242 Page 2
Cours chimie : Loi d’action de masse et loi de modération 4émeM S- exp
Elaboré par Afdal Ali : GSM : 26548242 Page 3
Vous aimerez peut-être aussi
- Les Equilibres ChimiquesDocument7 pagesLes Equilibres Chimiquesdembamamadou274Pas encore d'évaluation
- 6.equilibre ChimiqueDocument3 pages6.equilibre ChimiqueDan GrigorePas encore d'évaluation
- Rappels Cinetique ChimiqueDocument22 pagesRappels Cinetique ChimiqueSaid Soilihi ZayadPas encore d'évaluation
- Suivi d’une transformation chimiqueDocument4 pagesSuivi d’une transformation chimiqueBadr addine AboualalaPas encore d'évaluation
- Chapitre 2Document4 pagesChapitre 2Moustapha Bassirou NianePas encore d'évaluation
- Cours - Chimie - RESUME EQUILIBRE CHIMIQUE - Bac Sciences Exp (2015-2016) MR Daghsni Sahbi PDFDocument3 pagesCours - Chimie - RESUME EQUILIBRE CHIMIQUE - Bac Sciences Exp (2015-2016) MR Daghsni Sahbi PDFMohamed HamdenePas encore d'évaluation
- 06 Evolution Spontanee D Un Systeme ChimiqueDocument7 pages06 Evolution Spontanee D Un Systeme ChimiqueElec FoPas encore d'évaluation
- CM CHI 201 - 2022 Royal Partie 1Document53 pagesCM CHI 201 - 2022 Royal Partie 1Vera Legba-MonyPas encore d'évaluation
- Cours-Les Réactions chimiques-FR PDFDocument6 pagesCours-Les Réactions chimiques-FR PDFhakima032100% (1)
- CHAPITRE 1 Partie 2Document14 pagesCHAPITRE 1 Partie 2hamid ibbakhPas encore d'évaluation
- Equilibre Chimique, Word 1Document2 pagesEquilibre Chimique, Word 1Lourdes Gerges0% (1)
- Transformation Chimiquebilan de MatièreDocument3 pagesTransformation Chimiquebilan de MatièreKamal LaourdaniPas encore d'évaluation
- Chapitre 7 Evolution Spontanée D'un Système Chimique CoursDocument6 pagesChapitre 7 Evolution Spontanée D'un Système Chimique CoursfranbillesPas encore d'évaluation
- Cours 13 Équilibres ChimiquesDocument4 pagesCours 13 Équilibres ChimiquesArti80% (5)
- TP EquilibrechimiqueDocument8 pagesTP Equilibrechimiquecherazer67% (3)
- 1 Equilibres ChimiquesDocument6 pages1 Equilibres ChimiquesMira MslPas encore d'évaluation
- CR Equilibre ChimiqueDocument3 pagesCR Equilibre Chimiquemohamed mohPas encore d'évaluation
- Equilibre Et Loi D Action de MasseDocument1 pageEquilibre Et Loi D Action de Masseaziz bensaid2Pas encore d'évaluation
- Document Sans TitreDocument6 pagesDocument Sans TitreMohamed MahdiPas encore d'évaluation
- Cours Chimie PhysiqueDocument33 pagesCours Chimie PhysiqueBoudardaraPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Resume de Cours 1Document2 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Resume de Cours 1Fatima Zahrae El BouhmidiPas encore d'évaluation
- Cours Chim 06Document28 pagesCours Chim 06fsqiypiyiherafzferkPas encore d'évaluation
- Cinétique Chimique MPSI Et MPDocument23 pagesCinétique Chimique MPSI Et MPmomoadamso07Pas encore d'évaluation
- 40-103 Vitesse RéactionDocument14 pages40-103 Vitesse RéactionKhalil LasferPas encore d'évaluation
- Description D'un Système Chimique en Réaction (1029)Document6 pagesDescription D'un Système Chimique en Réaction (1029)AxellePas encore d'évaluation
- Resume Pc Biof Partie ChimieDocument8 pagesResume Pc Biof Partie Chimielabiadsihame1Pas encore d'évaluation
- Avancement D Une Reaction ChimiqueDocument4 pagesAvancement D Une Reaction ChimiqueFitouri MoncefPas encore d'évaluation
- Https0330088s.index Education - netpronoteFichiersExternes8aDocument7 pagesHttps0330088s.index Education - netpronoteFichiersExternes8athomasPas encore d'évaluation
- Cours - Suivi D'une Transformation ChimiqueDocument2 pagesCours - Suivi D'une Transformation ChimiqueAbdo BdaPas encore d'évaluation
- Suivi D'une Transformation Chimique 3Document2 pagesSuivi D'une Transformation Chimique 3Jamal ZakiPas encore d'évaluation
- Transformation ReactionDocument6 pagesTransformation ReactionhossamkamalPas encore d'évaluation
- Chimie PCEMDocument0 pageChimie PCEMAbdelhakim BailalPas encore d'évaluation
- ch2 - Transformation Chimique Dun Systã Me - complétéDocument24 pagesch2 - Transformation Chimique Dun Systã Me - complétéd.xw.wx3Pas encore d'évaluation
- Résumé Équilibre ChimiqueDocument4 pagesRésumé Équilibre ChimiqueMehdi BnmssdPas encore d'évaluation
- Fascicule Cinetique ChimiqueDocument42 pagesFascicule Cinetique ChimiqueBarhoumi Mourad100% (2)
- ThermodynamiqueDocument34 pagesThermodynamiqueNabil holmesPas encore d'évaluation
- Cours 3 Thermochimie CompletDocument18 pagesCours 3 Thermochimie CompletMuuXx Ss'IlPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Cours 1Document5 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Cours 1Ahmed Yassine NaciriPas encore d'évaluation
- Cours 1 OPUN-S6Document33 pagesCours 1 OPUN-S6adebdoubiPas encore d'évaluation
- Chapitre 9Document17 pagesChapitre 9Belinda DancheuPas encore d'évaluation
- Cours Cinétique S5 2023 Chapitre 1Document72 pagesCours Cinétique S5 2023 Chapitre 1Chaima ErrejerajiPas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptsCyrille AssoumouPas encore d'évaluation
- Chapitre 1Document7 pagesChapitre 1مصطفى داودPas encore d'évaluation
- Chapitre 1Document7 pagesChapitre 1rania rezguiPas encore d'évaluation
- La Cinétique ChimiqueDocument7 pagesLa Cinétique ChimiqueAS asPas encore d'évaluation
- Support Cours ThermodDocument126 pagesSupport Cours ThermodABDOXX1aPas encore d'évaluation
- Suivi D Une Transformation Chimique Vitesse de Reaction Resume de CoursDocument2 pagesSuivi D Une Transformation Chimique Vitesse de Reaction Resume de CoursMahfoud NatsuPas encore d'évaluation
- 3.cinétique Chimique (DR - Chaal)Document9 pages3.cinétique Chimique (DR - Chaal)Neou Phors SoporsPas encore d'évaluation
- Cours Chimie II 1ère SNV v2 PDFDocument38 pagesCours Chimie II 1ère SNV v2 PDFSamsouma BkPas encore d'évaluation
- 02 Energie Partie2 A22Document27 pages02 Energie Partie2 A22Edwin RodriguezPas encore d'évaluation
- Chapitre 7 Energie Et Enthalpie Libres - Critères D'évolution D'un SystèmeDocument17 pagesChapitre 7 Energie Et Enthalpie Libres - Critères D'évolution D'un SystèmeZehnouni AbderezakPas encore d'évaluation
- Fiche Sur Notion Déquilibre ChimiqueDocument3 pagesFiche Sur Notion Déquilibre ChimiquechadaPas encore d'évaluation
- 2012 Metropole Exo3 Correction CinetiqueConducti 4ptsDocument2 pages2012 Metropole Exo3 Correction CinetiqueConducti 4ptsdansoujosemorelePas encore d'évaluation
- Chapitre 7 Equilibre ChimiqueDocument12 pagesChapitre 7 Equilibre ChimiqueAnonymous FikOnlapPas encore d'évaluation
- Partie1 PDFDocument48 pagesPartie1 PDFjulien9562Pas encore d'évaluation
- Processus irréversibles non linéaires en thermodynamique: Les Grands Articles d'UniversalisD'EverandProcessus irréversibles non linéaires en thermodynamique: Les Grands Articles d'UniversalisPas encore d'évaluation