Académique Documents
Professionnel Documents
Culture Documents
Exercice Chimie Bac
Transféré par
Ali HaniniTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercice Chimie Bac
Transféré par
Ali HaniniDroits d'auteur :
Formats disponibles
Bac S septembre 2017 Métropole Correction © http://labolycee.
org
EXERCICE I – DU FROMAGE ET DU BEURRE (4 points)
1. Quelques propriétés de l’acide butanoïque
1.1. (0,25)
1.2. (0,5)
(l’acide butanoïque étant un acide faible, sa réaction avec l’eau est limitée d’où la double flèche)
1.3. (0,5) Méthode 1 : pH < pKa ainsi l’acide butanoïque prédomine en solution. Il n’est pas totalement
consommé par la réaction avec l’eau. Il s’agit bien d’un acide faible.
Méthode 2 : Si l’acide butanoïque était un acide fort, on aurait la relation pH = – log c alors le pH
vaudrait pH = –log (3,0×10–2) = 1,5.
Le pH de la solution vaut 3,2, il est supérieur à 1,5, l’acide butanoïque n’est pas un acide fort, cela est
bien en accord avec le caractère « acide faible » attribué à l’acide butanoïque.
1.4. (0,25) Le pH de la solution (3,2) étant inférieur au pKa du couple (4,8), c’est la
forme acide qui prédomine.
2. La fermentation butyrique dans le fromage
2.1. (0,25) Le gonflement des fromages est dû à la formation de gaz ( et ) lors de la
fermentation butyrique.
2.2. D’après l’équation de réaction : , l’acide
lactique étant le seul réactif, c’est forcément le réactif limitant.
(0,25) La réaction étant totale, on peut écrire
Or, donc
(0,25)
(0,25)
(0,25) L’information du site www.agroscope.com est donc bien correcte car il s’agit d’une
valeur approchée (« environ 1 g »).
3. Analyse d’un beurre
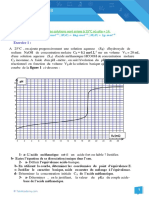
3.1. (0,5) Pour un titrage conductimétrique,
l’équivalence est repérée en modélisant les
deux portions de courbe par des demi-
droites. Le volume équivalent est égal à
l’abscisse du point d’intersection des deux
demi-droites.
On trouve : = 6,4 mL.
3.2.(0,75) Pour savoir si le beurre est rance, il faut déterminer son pourcentage massique en
acide butanoïque.
À l’équivalence, le réactif titré et le réactif titrant HO– ont été introduits dans les
proportions stœchiométriques de l’équation de titrage : il n’en reste donc plus.
On peut écrire : ( d’après la question 3.1.)
Ainsi, la masse d’acide lactique titrée est :
(dans 8,0 g de beurre)
Pour 100 g de beurre, on raisonne par proportionnalité :
Le pourcentage massique en acide butanoïque est inférieur à 4 %, le beurre n’est donc pas
rance.
Compétences exigibles ou attendues :
En noir : officiel (Au B.O.)
En italique : officieux (au regard des sujets de bac depuis 2013)
Savoir utiliser l’écriture topologique des molécules organiques.
Définir un acide faible et une base faible par leur réaction limitée avec l’eau.
Savoir écrire la réaction d’un acide faible ou d’une base faible avec l’eau.
Utiliser les symbolismes →, ← et dans l’écriture des réactions chimiques pour rendre compte des
situations observées.
Calculer le pH d’une solution aqueuse d’acide fort de concentration usuelle.
Identifier l’espèce prédominante d’un couple acide/base connaissant le pH du milieu et le pKA du
couple (savoir tracer un diagramme de prédominance).
Calculer des quantités de matière.
Savoir faire un bilan de matière.
Commenter le résultat d’une opération de mesure en le comparant à une valeur de référence.
Savoir repérer précisément l’équivalence dans un titrage conductimétrique.
Pratiquer une démarche expérimentale pour déterminer la concentration d’une espèce chimique (ou
sa masse ou sa quantité de matière) par titrage par le suivi d’une grandeur physique dans le domaine du
contrôle de la qualité.
Vous aimerez peut-être aussi
- Ecole de Formation en Cosmetique Modifier 2Document20 pagesEcole de Formation en Cosmetique Modifier 2PrimePas encore d'évaluation
- Partager LE - GRAND - LIVRE - DES - RECETTES - AFRICAINES - 1 - SPIRITUEL???Document163 pagesPartager LE - GRAND - LIVRE - DES - RECETTES - AFRICAINES - 1 - SPIRITUEL???Nicolson OdnePas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueBoussetta ZouhaierPas encore d'évaluation
- Projet de Creation D'un Centre D'elevage Et de Commercialisation de Tilapia en EtangdDocument111 pagesProjet de Creation D'un Centre D'elevage Et de Commercialisation de Tilapia en EtangdRalph MondesemePas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Série Dosage PDFDocument8 pagesSérie Dosage PDFAya ArPas encore d'évaluation
- Fiches Exercices Titrages-2010Document3 pagesFiches Exercices Titrages-2010Daniel Parnor100% (1)
- Les Iroquoiens Vers 1500Document25 pagesLes Iroquoiens Vers 1500wen qiPas encore d'évaluation
- 2022 Amsud J1 Exo1 Sujet AcideLactique 10pts - 0Document5 pages2022 Amsud J1 Exo1 Sujet AcideLactique 10pts - 0Louis VincentPas encore d'évaluation
- Exercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseIman QPas encore d'évaluation
- 5 Reactions Acido BasiquesDocument3 pages5 Reactions Acido BasiquesYouness SinePas encore d'évaluation
- Exercices 3transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuse - CopieDocument1 pageExercices 3transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuse - Copielabiadsihame73Pas encore d'évaluation
- Serie Acide Fort - Base Forte TS2Document3 pagesSerie Acide Fort - Base Forte TS2Amadou Oury DialloPas encore d'évaluation
- Correction Exercice Type Bac Dosage Acide BaseDocument3 pagesCorrection Exercice Type Bac Dosage Acide BaseColinePas encore d'évaluation
- Exercices Réactions Acido-BasiquesDocument4 pagesExercices Réactions Acido-Basiquesayyoub dhbPas encore d'évaluation
- SeÌ Rie 1 - Dosage Acido-BasiqueDocument2 pagesSeÌ Rie 1 - Dosage Acido-Basiqueb01554837Pas encore d'évaluation
- Exercices C7 TSDocument2 pagesExercices C7 TSkondemamadousaidouPas encore d'évaluation
- 2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsDocument3 pages2015-Pondichery-Exo1-Correction-Vitamine C-9 Ptsanasdiouri2020Pas encore d'évaluation
- Reactions Acide BaseDocument5 pagesReactions Acide BaseRitaj-Rayane KarimPas encore d'évaluation
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloPas encore d'évaluation
- Le PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014Document15 pagesLe PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014RachidaPas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- NEW EVAL CHIMIE TC, D CrucialDocument3 pagesNEW EVAL CHIMIE TC, D Crucialb60032595Pas encore d'évaluation
- Dosage de L'acide Lactique Du LaitDocument2 pagesDosage de L'acide Lactique Du Laitالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- 1cm3jftoi 866968Document2 pages1cm3jftoi 866968bipPas encore d'évaluation
- 2016 11 NelleCaledo Exo1 Correction Vanille 9ptsDocument4 pages2016 11 NelleCaledo Exo1 Correction Vanille 9ptsDalia AmarniPas encore d'évaluation
- 26 Dosage 3Document3 pages26 Dosage 3Ilyes Ben Jemaa0% (1)
- Transformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Document21 pagesTransformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Abderrazzak ElhaimerPas encore d'évaluation
- Exercice Type: Titrage Acido-BasiqueDocument3 pagesExercice Type: Titrage Acido-BasiqueMiniar BoughzalaPas encore d'évaluation
- TleD - CH - L11 - Dosage Acido-BasiqueDocument10 pagesTleD - CH - L11 - Dosage Acido-BasiqueHamadi DialloPas encore d'évaluation
- Cimie 2010 SRDocument1 pageCimie 2010 SRlina elouadihPas encore d'évaluation
- Examen SV FR Chimie 2010 1 PDFDocument4 pagesExamen SV FR Chimie 2010 1 PDFbettitPas encore d'évaluation
- Correction Dev c2 n2 Bac 2017Document3 pagesCorrection Dev c2 n2 Bac 2017Anis DahnenPas encore d'évaluation
- Acides Et Bases PCDocument15 pagesAcides Et Bases PCrkibi.khadija2006Pas encore d'évaluation
- 2023 NelleCaledo J1 Exo1 Sujet PLA 9ptsDocument5 pages2023 NelleCaledo J1 Exo1 Sujet PLA 9ptsl.garidouPas encore d'évaluation
- Exercices-Transformations-non-totales-d - Un-Système-Chimique (WWW - Pc1.ma)Document5 pagesExercices-Transformations-non-totales-d - Un-Système-Chimique (WWW - Pc1.ma)Walaa WalaaPas encore d'évaluation
- TD - Acido-BasiqueDocument12 pagesTD - Acido-BasiqueChaymae AyatiPas encore d'évaluation
- Exercice 1 (7 Points) L'acide LactiqueDocument7 pagesExercice 1 (7 Points) L'acide LactiqueAli Rammal100% (1)
- TD MD ChimieDocument2 pagesTD MD ChimieMatthias KingPas encore d'évaluation
- Exo Chimie 2009 SRDocument1 pageExo Chimie 2009 SRlina elouadihPas encore d'évaluation
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- 03 Titrages Acido BasiquesDocument7 pages03 Titrages Acido BasiquesMoha BaihiPas encore d'évaluation
- Null 6Document8 pagesNull 6Malih ChebboPas encore d'évaluation
- Serie CoronaDocument15 pagesSerie CoronaJoséphine NancassePas encore d'évaluation
- 2011 - Etudes de L'alcool AmyliqueDocument1 page2011 - Etudes de L'alcool AmyliqueEzéchiel HandjemedjiPas encore d'évaluation
- DOSAGE COLORIMETRIQUE Et Phmétrique Aspirine CorrigéDocument3 pagesDOSAGE COLORIMETRIQUE Et Phmétrique Aspirine Corrigétdi44617Pas encore d'évaluation
- Laboratoire 3 DÉTERMINATION DE LA CONCENTRATIONDocument11 pagesLaboratoire 3 DÉTERMINATION DE LA CONCENTRATIONKhalil OukebdanePas encore d'évaluation
- CHIMIE TLE Exercices DE REMISE A NIVEAUDocument10 pagesCHIMIE TLE Exercices DE REMISE A NIVEAUFadlou ISSAKAPas encore d'évaluation
- Exo 54 - Dosage Acide Benzoique EDocument2 pagesExo 54 - Dosage Acide Benzoique EislameilhamiPas encore d'évaluation
- Https0781948u.index Education - netpronoteFichiersExternes8fDocument5 pagesHttps0781948u.index Education - netpronoteFichiersExternes8fmka araPas encore d'évaluation
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 pagesSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinPas encore d'évaluation
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- TD Tampon 2019 LSLL WahabdiopDocument2 pagesTD Tampon 2019 LSLL WahabdiopOumou Khaïry DiopPas encore d'évaluation
- Tp5.dissociation D Un AcideDocument3 pagesTp5.dissociation D Un Acideadjidavibruno7Pas encore d'évaluation
- Titrages Acido-Basiques PDFDocument4 pagesTitrages Acido-Basiques PDFtarikPas encore d'évaluation
- Acide Base +dosage1Document2 pagesAcide Base +dosage1hamzacrypto080Pas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Acidite D Un VinaigreDocument6 pagesAcidite D Un Vinaigreboudriat ahmedPas encore d'évaluation
- TP #2 Dosage de L'acide Phosphorique Dans Une Boisson Au ColaDocument4 pagesTP #2 Dosage de L'acide Phosphorique Dans Une Boisson Au Colatitebin50% (2)
- TP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEDocument7 pagesTP I Analyse de Problèmes Réels Chi Analytique SOLUTION TAMPON CORRIGEEbouaiedanissa61Pas encore d'évaluation
- Feuille TD N°3Document2 pagesFeuille TD N°3Warren Wany'sPas encore d'évaluation
- Chimie Générale4 PDFDocument50 pagesChimie Générale4 PDFTOUREPas encore d'évaluation
- La Maitrise de La Securite Sanitaire DesDocument8 pagesLa Maitrise de La Securite Sanitaire DesTaki BouroubaPas encore d'évaluation
- Attestation Stage Professionnel Cap Patissier Ep2 PDF 27958Document1 pageAttestation Stage Professionnel Cap Patissier Ep2 PDF 27958Nonu GamolinPas encore d'évaluation
- Bou 4984Document123 pagesBou 4984BEN ABDENNEBI BrahimPas encore d'évaluation
- BavaroisDocument2 pagesBavaroisbluejasminePas encore d'évaluation
- Fiches Sons Pilotis 2019 Palier 2 NewDocument8 pagesFiches Sons Pilotis 2019 Palier 2 NewKarla Victoria Corado de VenturaPas encore d'évaluation
- Gamme PERSILLE TC BOVIN VIANDE 2022Document2 pagesGamme PERSILLE TC BOVIN VIANDE 2022Lakis LokosPas encore d'évaluation
- Articles Moringa IjartechDocument7 pagesArticles Moringa IjartechKarima GharsallahPas encore d'évaluation
- Cahier Porc 7Document7 pagesCahier Porc 7phillipe danvlemiPas encore d'évaluation
- تصحيح نمودج شامل رقم 05 - 3 متوسط-1Document2 pagesتصحيح نمودج شامل رقم 05 - 3 متوسط-1Kader MazPas encore d'évaluation
- Rapport Projet Pro CryogenisationDocument29 pagesRapport Projet Pro CryogenisationLili AlexPas encore d'évaluation
- Version PDFDocument5 pagesVersion PDFAbdellah BeichaPas encore d'évaluation
- Expose Du Groupe 9Document24 pagesExpose Du Groupe 9CabrelPas encore d'évaluation
- Exercice, Récit Et DiscoursDocument1 pageExercice, Récit Et DiscoursAyman BenkhdimPas encore d'évaluation
- Livret PédagogiqueDocument12 pagesLivret Pédagogiquegaewen.guicherd419Pas encore d'évaluation
- Projet Biogaz Benin Martin MoisseDocument120 pagesProjet Biogaz Benin Martin Moissegabin sotondjiPas encore d'évaluation
- Les Additifs Alimentaires Courants - AlimentariumDocument4 pagesLes Additifs Alimentaires Courants - AlimentariumInes DhPas encore d'évaluation
- Fiche Pratique Prestation RestaurationDocument17 pagesFiche Pratique Prestation RestaurationAaron Elie MemelPas encore d'évaluation
- Alimente in FrancezaDocument2 pagesAlimente in FrancezaDaniel MironPas encore d'évaluation
- MicrobesDocument18 pagesMicrobesdidlegPas encore d'évaluation
- 5fa82d86ea9dc - La Pate A ChouxDocument12 pages5fa82d86ea9dc - La Pate A ChouxdonPas encore d'évaluation
- Recommandations Printemps FMDocument22 pagesRecommandations Printemps FMTanguy MarinPas encore d'évaluation
- 4 As 3113Document11 pages4 As 3113BORN AlicePas encore d'évaluation
- Sequence Sciences Les Chaines AlimentairesDocument5 pagesSequence Sciences Les Chaines AlimentairespezzoliPas encore d'évaluation
- Saidarganier 1Document8 pagesSaidarganier 1Houcine BendaoudPas encore d'évaluation
- 1582 Wine Club - Secrets de Cave - Juin 2020Document2 pages1582 Wine Club - Secrets de Cave - Juin 2020learPas encore d'évaluation
- Fran Ais 29952 PDFDocument4 pagesFran Ais 29952 PDFThomas ReynePas encore d'évaluation