Académique Documents
Professionnel Documents
Culture Documents
Https0781948u.index Education - netpronoteFichiersExternes8f
Transféré par
mka araTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Https0781948u.index Education - netpronoteFichiersExternes8f
Transféré par
mka araDroits d'auteur :
Formats disponibles
Analyses Acidimétrie/Alcalimétrie/pH-métrie
ANALYSES ACIDO-BASIQUE
1. PRINCIPE D’UN DOSAGE / TITRAGE ACIDO-BASIQUE.
1.1. DÉFINITION.
Faire un dosage par titrage consiste, grâce à une réaction chimique totale, à rechercher la quantité de
matière ou la concentration inconnue d’une espèce chimique en solution, appelée réactif titré, en la
faisant réagir totalement et rapidement avec une espèce chimique en solution de concentration connue,
appelée réactif titrant.
Le dosage acido-basique utilise une réaction entre un acide et une base (réaction acido-basique) et
permet de déterminer la concentration d’acide ou de base dans une solution.
L’acidimétrie est le dosage d’acide contenu dans une solution et l’alcalimétrie est le dosage de base.
1.2. RÉACTION DE DOSAGE.
Le réactif titré est l’espèce dont on veut déterminer la concentration, il est contenu dans la solution à
titrer/doser (solution titrée). On utilise une solution titrante contenant un réactif titrant choisi en
fonction de l’espèce à doser.
Le volume (précis) de solution à titrer/à doser s’appelle la prise d’essai.
Ainsi pour titrer/doser une solution acide de concentration inconnue
(solution titrée), on va utiliser une solution basique de concentration
connue (solution titrante).
Réciproquement, pour doser une solution basique de concentration
inconnue, on va utiliser une solution acide de concentration connue.
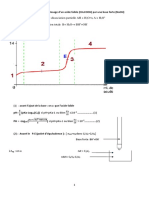
Les solutions sont placées comme sur le schéma ci-contre :
Le matériel nécessaire au dosage est :
- un dispositif d’agitation magnétique
- un bécher
- une burette graduée
La solution à titrer/doser est dans le bécher et son volume est fixé et connu.
La solution titrante est placée dans la burette. On verse la solution titrante, à l’aide de la burette, dans
la solution à doser jusqu’à ce que le réactif titré (qui est limitant) ait totalement réagi et disparu.
On atteint alors l’équivalence, et on obtient le volume versé à l’équivalence de la solution titrante VE.
Solution basique Solution acide
CB connue CA connue
VB,E déterminé VA,E déterminé
Solution acide Solution basique
CA ? CB ?
VA connu VB connu
Dosage d’une solution acide Dosage d’une solution basique
1B PCEPC Page 1/5
Bac IP : S2
Analyses Acidimétrie/Alcalimétrie/pH-métrie
1.3. ÉQUIVALENCE.
Réaction chimique support du titrage : Acide + Base → C + D
A l’équivalence, les réactifs sont dans les proportions stoechiométriques dans le milieu réactionnel
(dans le bécher où a lieu la réaction) : les réactifs sont intégralement consommés.
Le but de chaque dosage est de repérer l’équivalence et noter le volume à l’équivalence de solution
titrante versée.
Ce repérage se fait soit par un changement de couleur d’un indicateur coloré ou par le tracé d’une
courbe de variation du pH.
A l’équivalence E :
nAcide = nBase
nA = nB or n = C x Vavec C : concentration (mol/L)
V : volume (L)
Par exemple, avec A : solution acide à doser/titrer
et B : solution basique titrante
CA x VA = CB x VB,E avec VB,E : Volume de B versé à l’équivalence
Ainsi, on peut déterminer la concentration de la solution A :
CA =
Réciproquement, si on veut déterminer la concentration d’une solution basique.
2. DOSAGE COLORIMÉTRIQUE.
Le titrage colorimétrique se fait grâce à des indicateurs colorés qui ont la propriété de changer de
couleur en fonction du pH du milieu. Cette technique d’analyse permet donc de détecter facilement le
passage par l’équivalence lors du changement de couleur de l’indicateur coloré.
Caractéristiques des trois principaux indicateurs colorés utilisés dans les dosages acido-basiques :
Principe :
On réalise le titrage en ajoutant, dans la solution titrée (inconnue), quelques gouttes d’un indicateur
coloré acido-basique dont la zone de virage (changement de couleur en fonction du pH) doit englober le
saut de pH à l’équivalence.
L’équivalence du titrage correspond à une brusque variation du pH. L’équivalence est donc repérée par
le changement de couleur (zone de virage) de l’indicateur coloré incorporé dans la solution à titrer.
Le volume de la solution titrante (connue) versé à l’équivalence est donc déterminé par le virage de
couleur de l’indicateur coloré.
1B PCEPC Page 2/5
Bac IP : S2
Analyses Acidimétrie/Alcalimétrie/pH-métrie
3. DOSAGE pH-MÉTRIQUE.
Un titrage pH-métrique est une méthode pour titrer/doser un acide (ou une base) de concentration
inconnue. La manipulation consiste à suivre l’évolution du pH de la solution titrée (inconnue) au cours
de l’ajout de la solution de base (ou d’acide) titrante (de concentration connue).
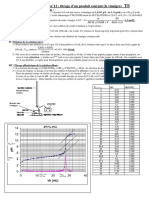
La courbe de titrage pH-métrique est la courbe pH= f(Vsolution titrante versée) donnant les variations du pH en
fonction du volume de solution titrante versée. L’équivalence se manifeste par une brusque variation du
pH.
Principe :
On mesure le pH de la solution titrée pour chaque volume de la solution titrante versée. Afin de pouvoir
représenter des points régulièrement répartis, il faut ajouter la solution titrante millilitre par millilitre
avant et après l’équivalence mais « resserrer » les versements au voisinage de l’équivalence, c’est-à-
dire pour :
VE – 1 mL < Vsolution titrante versée < VE + 1 mL
3.1. ÉQUIVALENCE D’UN TITRAGE PAR pH-MÉTRIE.
L’équivalence est représentée expérimentalement lorsqu’il se produit une brusque variation du pH,
appelée « saut de pH ». On peut déterminer les coordonnées du point d’équivalence sur la courbe de
titrage par deux méthodes :
Méthode des tangentes :
1. On trace 2 tangentes à la courbe pH = f(Vsolution titrante versée), parallèles et placées de part et d’autre du
saut de pH ;
2. On trace une droite parallèle à ces deux tangentes, équidistante de celles-ci.
Cette dernière droite coupe la courbe de titrage au point d’équivalence E, d’abscissse V E et
d’ordonnée pHE.
1B PCEPC Page 3/5
Bac IP : S2
Analyses Acidimétrie/Alcalimétrie/pH-métrie
Méthode de la courbe dérivée : Une seconde méthode de détermination du point d’équivalence
consiste à tracer, à l’aide d’un logiciel, la courbe dérivée de la courbe de titrage. L’abscisse de
l’extremum de cette courbe correspond au volume V E de solution titrante versée à l’équivalence.
3.2. TITRAGE D’UN ACIDE FORT PAR UNE BASE FORTE (ou inversement).
L’équation de la réaction support du titrage acide fort / base forte est :
H3O+ (aq) + HO- (aq) → 2 H2O (l )
Acide Base Eau
fort forte
Les courbes de titrage ont les formes suivantes :
A l’équivalence, on a donc : n(H3O+) = n(HO-)
La réaction étant totale, à l’équivalence les espèces H3O+ et HO- ont totalement disparu. Donc la solution
ne contient plus que H2O. Ainsi la solution est neutre, pH = 7.
3.3. TITRAGE D’UN ACIDE FAIBLE PAR UNE BASE FORTE.
L’équation de la réaction support du titrage acide faible / base forte est :
AH (aq) + HO- (aq) → A- (aq) + H2O (l )
Acide Base Base Eau
faible forte
A l’équivalence, on a donc : n(AH) = n(HO-)versé
La courbe de titrage a la forme suivante :
Exemple : titrage pH-métrique d’une solution
d’acide ascorbique (vitamine C) par l’hydroxyde
de sodium (soude, NaOH).
La réaction étant totale, à l’équivalence les espèces AH
et HO- ont totalement disparu. Donc la solution ne
contient plus que la base conjuguée A - et H2O. Ainsi le
pH est basique pH > 7.
1B PCEPC Page 4/5
Bac IP : S2
Analyses Acidimétrie/Alcalimétrie/pH-métrie
3.4. TITRAGE D’UNE BASE FAIBLE PAR UN ACIDE FORT.
L’équation de la réaction support du titrage base faible / acide fort est :
A- (aq) + H3O+ (aq) → AH (aq) + H2O (l )
Base Acide Acide Eau
faible fort
A l’équivalence, on a donc : n(A-) = n(H3O+)versé
La réaction étant totale, à l’équivalence les espèces A - et H3O+ ont totalement disparu. Donc la solution
ne contient plus que l’acide conjuguée AH et H2O. Ainsi le pH est acide pH < 7.
La courbe de titrage a la forme suivante :
Exemple : titrage pH-métrique d’une solution
d’ammoniac (ammoniaque, NH3) par l’acide
chlorhydrique (HCl).
1B PCEPC Page 5/5
Bac IP : S2
Vous aimerez peut-être aussi
- FSR TDs CHIMIE DES SOLUTIONS 2020Document34 pagesFSR TDs CHIMIE DES SOLUTIONS 2020Mohamd BobsPas encore d'évaluation
- TP Chimie Des Solutions 2015 2016 - 1Document24 pagesTP Chimie Des Solutions 2015 2016 - 1Ábdėrrâhman Ča-d100% (1)
- Les Formules de PHDocument2 pagesLes Formules de PHmohamigo2100% (1)
- Exercices Sur Le DosageDocument13 pagesExercices Sur Le DosageNaouma ChahdPas encore d'évaluation
- Corrigé Série 2Document7 pagesCorrigé Série 2Doudou SamiPas encore d'évaluation
- Exercices N 5 Et 6Document7 pagesExercices N 5 Et 6ahlemmPas encore d'évaluation
- Chimie TP9 Titrage Conduc VinaigreDocument2 pagesChimie TP9 Titrage Conduc VinaigreMarius MissiPas encore d'évaluation
- Web Exercices Precipitation PDFDocument2 pagesWeb Exercices Precipitation PDFans1390100% (1)
- Mod4 Corrige ch8 Partie2Document8 pagesMod4 Corrige ch8 Partie2api-278378684100% (1)
- Correction de La Serie 2 - Réactivité Chimique-Exercices 1-5Document59 pagesCorrection de La Serie 2 - Réactivité Chimique-Exercices 1-5Zakaria Abouzaid67% (3)
- Chimie B Chap8 Titrage AcidobasiqueDocument6 pagesChimie B Chap8 Titrage AcidobasiqueSamantha Farah100% (1)
- TP03 Et TP04 DosageDocument4 pagesTP03 Et TP04 DosageHawa COULIBALYPas encore d'évaluation
- TP-PH-métrie ElectrochimieDocument14 pagesTP-PH-métrie ElectrochimieAya DgmPas encore d'évaluation
- Exposé Sur DosageDocument30 pagesExposé Sur DosageFaiçalEssabery100% (2)
- Dosage Acido-Basique FRDocument3 pagesDosage Acido-Basique FRAicha DaouPas encore d'évaluation
- 5 - Chap5-Dosages Et Calcul D'incertitude - Mode de Compatibilité PDFDocument63 pages5 - Chap5-Dosages Et Calcul D'incertitude - Mode de Compatibilité PDFoulaiPas encore d'évaluation
- Partie 6 Chap 5 Les DosagesDocument44 pagesPartie 6 Chap 5 Les DosagesdPas encore d'évaluation
- Chap III IV Et V l3 CADocument17 pagesChap III IV Et V l3 CAFatouma ShPas encore d'évaluation
- 2005-Afrique-Dosage-Precipitation Mohr Chrapentier CDocument3 pages2005-Afrique-Dosage-Precipitation Mohr Chrapentier CzakavPas encore d'évaluation
- TP ch4 Titrage PhmetriqueDocument2 pagesTP ch4 Titrage PhmetriquebounegabPas encore d'évaluation
- Examen de TP Dosage de H3PO4 Par NaOH 5Document3 pagesExamen de TP Dosage de H3PO4 Par NaOH 5KHALIFA EL HARFIPas encore d'évaluation
- TP Dosage PhmetriqueDocument1 pageTP Dosage PhmetriqueNesrine BouzidPas encore d'évaluation
- TP de Chimie N 1Document10 pagesTP de Chimie N 1Rayane BEKKOUCHEPas encore d'évaluation
- Les Solutios TomponDocument19 pagesLes Solutios Tomponmed100% (1)
- Partie I - Cours Acides Bases 2019Document68 pagesPartie I - Cours Acides Bases 2019Youssef AouinPas encore d'évaluation
- TP PH Metre ATHIR - New1Document8 pagesTP PH Metre ATHIR - New1samibenhabilePas encore d'évaluation
- TP 1Document2 pagesTP 1Aya BoucharebPas encore d'évaluation
- TP2 ChimieDocument10 pagesTP2 ChimieHalima ZighPas encore d'évaluation
- MANGANIMÉTRIEDocument2 pagesMANGANIMÉTRIEDiallo100% (1)
- PrepaTS TransfoChimiqueBilanDeMatiereDocument6 pagesPrepaTS TransfoChimiqueBilanDeMatierebessama84Pas encore d'évaluation
- 2003 Asie Sujet Exo1 Savon 4ptsDocument2 pages2003 Asie Sujet Exo1 Savon 4ptstrenteastonPas encore d'évaluation
- S - Rie TD Chimie1Document12 pagesS - Rie TD Chimie1Aristide MfifenPas encore d'évaluation
- TP 1 CphysiDocument3 pagesTP 1 Cphysiazou korbaPas encore d'évaluation
- TP 3 STDocument4 pagesTP 3 STABDelpari SeraichePas encore d'évaluation
- ComplexometrieDocument4 pagesComplexometrieABDELALI SASSIOUIPas encore d'évaluation
- Aldéhydes Et CétonesDocument34 pagesAldéhydes Et Cétonesatika benslimanePas encore d'évaluation
- TP Chimie Compte Rendu Preparation Dune SolutionDocument6 pagesTP Chimie Compte Rendu Preparation Dune SolutionAbdellah BerrouachdiPas encore d'évaluation
- Les Methodes VolumetriquesDocument11 pagesLes Methodes VolumetriquesSaiida Mansour100% (1)
- Corrigé Exam Norm 21 (SMC5)Document4 pagesCorrigé Exam Norm 21 (SMC5)ZAGGAZ MERYPas encore d'évaluation
- P39oxbenzoine PersaDocument8 pagesP39oxbenzoine Persaayoub dahbi0% (1)
- CocaDocument5 pagesCocatheobromine100% (4)
- SavonDocument3 pagesSavonOrnevalde JulphinPas encore d'évaluation
- Methode GranDocument29 pagesMethode GranASMAA KherrazPas encore d'évaluation
- TP Chimie Analytique Et Instrumentale Manip1 FinalDocument16 pagesTP Chimie Analytique Et Instrumentale Manip1 FinalHamed AbbassiPas encore d'évaluation
- Compte Rendu 1Document11 pagesCompte Rendu 1hadil100% (1)
- TS TPC13Document3 pagesTS TPC13Prince AbdooPas encore d'évaluation
- IntroductionDocument12 pagesIntroductionselmi nourelhoudaPas encore d'évaluation
- Risa Exercices Application CH2 TC Epss 2020Document2 pagesRisa Exercices Application CH2 TC Epss 2020Jean Luc KonanPas encore d'évaluation
- Indicateurs ColoresDocument3 pagesIndicateurs ColoresWEMBE RAOULPas encore d'évaluation
- Thermo-1 DjaberDocument6 pagesThermo-1 DjaberSara BenPas encore d'évaluation
- TP L2 2022 BouraadaDocument9 pagesTP L2 2022 BouraadaHanae HanaPas encore d'évaluation
- TP2 PH Métrie 2022-2023Document6 pagesTP2 PH Métrie 2022-2023abderrahmane lalaouiPas encore d'évaluation
- Dosage de IbuprofèneDocument3 pagesDosage de IbuprofèneHonoré IrengePas encore d'évaluation
- TP-PH Solution AqDocument2 pagesTP-PH Solution AqAnis DahnenPas encore d'évaluation
- TP Chimie OrganiqueDocument8 pagesTP Chimie OrganiqueSamar Zedam100% (1)
- 5.titrage Direct Et Indirect PDFDocument4 pages5.titrage Direct Et Indirect PDFkimmikPas encore d'évaluation
- TP Chimie 1er 3Document6 pagesTP Chimie 1er 3efzefezrhPas encore d'évaluation
- Chromatographie Sur Colonne PDFDocument8 pagesChromatographie Sur Colonne PDFInesPas encore d'évaluation
- Chapitre 2 - Aldehydes& Cetones ModDocument104 pagesChapitre 2 - Aldehydes& Cetones ModYoussef Aouin100% (1)
- 11.les Dosages Redox 1Document6 pages11.les Dosages Redox 1Souad MahiPas encore d'évaluation
- Titrages Acido-Basiques PDFDocument4 pagesTitrages Acido-Basiques PDFtarikPas encore d'évaluation
- 6129e58d84154reactions Acide Base Solutions Tampons Chimie TermDocument7 pages6129e58d84154reactions Acide Base Solutions Tampons Chimie TermPrince Informaticien GamesPas encore d'évaluation
- Le PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014Document15 pagesLe PH 6. Le Dosage Des Solutions Dacides Et Des Bases Faibles - Theorie - 2014RachidaPas encore d'évaluation
- FICHE Dosage WebDocument4 pagesFICHE Dosage Webفيديو بالعربيPas encore d'évaluation
- Chap 5 ChiDocument7 pagesChap 5 ChiMahmoud FerhatPas encore d'évaluation
- CH4TCH02L04Document1 pageCH4TCH02L04chadaPas encore d'évaluation
- Examen Chimie en Sol PC1-Juin 2021Document1 pageExamen Chimie en Sol PC1-Juin 2021Wi Em ChPas encore d'évaluation
- Titrage ABDocument4 pagesTitrage ABEL Hassania EL HERRADIPas encore d'évaluation
- TleD - CH - L11 - Dosage Acido-BasiqueDocument10 pagesTleD - CH - L11 - Dosage Acido-BasiqueHamadi DialloPas encore d'évaluation
- C5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFDocument4 pagesC5Chim - Reactions - Acidobasiques - Exercices - Bronsted-Lowry PDFAbdeljalil LoudainiPas encore d'évaluation
- Potentiel HydrogèneDocument13 pagesPotentiel HydrogèneFoudil LaouiciPas encore d'évaluation
- PhmetreDocument2 pagesPhmetrekessou_abdelghafourPas encore d'évaluation
- Traveaux Dirigés 2Document6 pagesTraveaux Dirigés 2Aymen BaccouchePas encore d'évaluation
- FICHE Dosage WebDocument4 pagesFICHE Dosage Webفيديو بالعربيPas encore d'évaluation
- Cma 2Document11 pagesCma 2Abdou SaiPas encore d'évaluation
- ANNALE-DE-Chimie-TS-Finale (08-13)Document6 pagesANNALE-DE-Chimie-TS-Finale (08-13)noeliekdgouPas encore d'évaluation
- Catalyse Acido-Basique PDFDocument25 pagesCatalyse Acido-Basique PDFABAKIHPas encore d'évaluation
- Correction TP 12 Vinaigre New PDFDocument2 pagesCorrection TP 12 Vinaigre New PDFYouSsef EchafaiPas encore d'évaluation
- Détermination de La Dureté de L'Eau: TPN 22 - Solutions Aqueuses 4Document7 pagesDétermination de La Dureté de L'Eau: TPN 22 - Solutions Aqueuses 4Nelly RakotoPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences Physiques - Bac Sciences Exp (2022-2023) MR BARHOUMI EZZEDINEDocument6 pagesDevoir de Synthèse N°2 - Sciences Physiques - Bac Sciences Exp (2022-2023) MR BARHOUMI EZZEDINEGhada DaddouPas encore d'évaluation
- Module Complément de Formation en Chimie Réactions Acido BasiquesDocument29 pagesModule Complément de Formation en Chimie Réactions Acido BasiquesyounesPas encore d'évaluation
- Chapitre 3Document7 pagesChapitre 3srhconnor_31Pas encore d'évaluation
- Titrages Acide BaseDocument22 pagesTitrages Acide BaseramiPas encore d'évaluation
- Acidimetrie Acides CalculacidDocument2 pagesAcidimetrie Acides CalculacidMar WaPas encore d'évaluation
- Reactions Acide BaseDocument5 pagesReactions Acide BaseRitaj-Rayane KarimPas encore d'évaluation
- ChimieDocument57 pagesChimieOmar ThiamPas encore d'évaluation
- Physique Chimie 2023 StudyramaDocument7 pagesPhysique Chimie 2023 StudyramaMerciaPas encore d'évaluation
- Liste Des Produits A Command2Document5 pagesListe Des Produits A Command2Essassi AmmarPas encore d'évaluation
- L'alchimisteDocument2 pagesL'alchimisteYanoussa TEBAYAPas encore d'évaluation