Académique Documents
Professionnel Documents
Culture Documents
CH4TCH02L04
Transféré par
chadaCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
CH4TCH02L04
Transféré par
chadaDroits d'auteur :
Formats disponibles
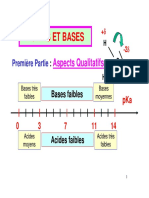
Classification des bases
I. Constante de la basicité d’un couple acide/base
La constante de basicité pour un couple Acide/Base, la réaction acide-base à considérer est :
Base + H2O ⇄ OH- + Acide
La constante d’équilibre relative à cette réaction est appelée constante de basicité du couple Acide/Base
notée « Kb ». La constante d’acidité Kb ne dépend que de la température. L’application de la loi d’action de
[𝐴𝑐𝑖𝑑𝑒][𝑂𝐻 − ]
masse pour la réaction nous permet d’écrire: Πé𝑞 = 𝐾𝑏 = [𝐵𝑎𝑠𝑒]
On définit alors le pKa, tel que, pKb = - log Kb
D’où on tire la relation équivalente à Kb = 10 - pKb
Couple Constante d’équilibre Interprétation
- La réaction est totale
Πé𝑞 = 𝐾𝑏 - A l’état d’équilibre, on dit qu’il existe seulement
[𝐴𝑐𝑖𝑑𝑒][𝑂𝐻 −] des traces de la base
Bases fortes 𝐾𝑏 = - A l’état d’équilibre, la concentration molaire de la
[𝐵𝑎𝑠𝑒]
base est faible. La base est entièrement dissociée
𝐾𝑏 est très élevée
en ion hydroxyde OH- et en Acide.
Πé𝑞 = 𝐾𝑏 - La réaction est limitée.
[𝐴𝑐𝑖𝑑𝑒][𝑂𝐻 −] - A l’état d’équilibre, la base est faiblement
Bases faibles 𝐾𝑏 = dissociée en ion hydroxyde OH- et en acide.
[𝐵𝑎𝑠𝑒]
𝐾𝑏 de valeur moyenne
Πé𝑞 = 𝐾𝑏 - La réaction ne se fait pas pratiquement. Et la
[𝐴𝑐𝑖𝑑𝑒][𝑂𝐻 −] réaction inverse est pratiquement totale.
Bases inertes 𝐾𝑏 = - A l’équilibre chimique l’acide existe seulement à
[𝐵𝑎𝑠𝑒]
𝐾𝑏 ≅ 0 l’état de traces.
II. La constante de basicité des couples acide/base et forces de base correspondante
On considère le couple acide-base AH/A- et la réaction ci-dessous entre l’acide A- et l’eau H2O.
A- + H2O ⇄ AH + OH-
La constante de basicité d’un couple acide-base renseigne sur la tendance plus ou moins grande que la
base, correspondante, ait à fixer un ion hydrogène provenant de l’eau.
Une base est d’autant plus forte que la valeur de la constante de basicité K b du couple auquel elle
appartient est grande et que la valeur de son pKb est faible.
Une base forte est une base plus forte que l’ion OH-.
Une base inerte est une base moins forte que H2O.
Une base faible est une base plus forte que H2O mais moins forte que l’ion OH-.
Vous aimerez peut-être aussi
- CH 4 (Acide Base)Document9 pagesCH 4 (Acide Base)Seif Souid92% (24)
- COMMENT - ENTREPRENDRE - DANS - LA - VIE (Les 100 Idées Business)Document84 pagesCOMMENT - ENTREPRENDRE - DANS - LA - VIE (Les 100 Idées Business)GaneshPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Présentation - DD Au MarocDocument56 pagesPrésentation - DD Au MarocSiham KhaifallahPas encore d'évaluation
- MRP2Document47 pagesMRP2najlae alfathiPas encore d'évaluation
- Guide Protection Des Systemes EssentielsDocument108 pagesGuide Protection Des Systemes Essentielsalbert dupontPas encore d'évaluation
- Les Acides Et Les BasesDocument3 pagesLes Acides Et Les BasesRemy HebertPas encore d'évaluation
- Cours Chim 7Document2 pagesCours Chim 7Yasmina BenPas encore d'évaluation
- Equilibres Acido-BasiqueDocument38 pagesEquilibres Acido-BasiqueMouniratou NazéPas encore d'évaluation
- Chimie - Chapitre 7: Equilibre Acido-Basique en Solution Aqueuse Ce Qu'il Faut RetenirDocument2 pagesChimie - Chapitre 7: Equilibre Acido-Basique en Solution Aqueuse Ce Qu'il Faut RetenirOussama ElfaqyrPas encore d'évaluation
- 2017 Acide-Base PDFDocument3 pages2017 Acide-Base PDFBen Mamia MahmoudPas encore d'évaluation
- Cours Acide BaseDocument14 pagesCours Acide BaseAli AllamPas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Resume Acides Et Bases PDFDocument2 pagesResume Acides Et Bases PDFAnonymous nbHyrU81Pas encore d'évaluation
- Chimie Des Solutions AqueusesDocument29 pagesChimie Des Solutions AqueusesJean-Loïc BauchetPas encore d'évaluation
- 9 B 6 F 330 Dfec 47 e 8 CCDDocument3 pages9 B 6 F 330 Dfec 47 e 8 CCDb.hahastellaPas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- 4.acide Fort, Acide Faible, Notion de Constante D'acidité Et de pKA PDFDocument4 pages4.acide Fort, Acide Faible, Notion de Constante D'acidité Et de pKA PDFkimmikPas encore d'évaluation
- Chsol - Chapitre IiDocument28 pagesChsol - Chapitre IielkhiatmohammedaminePas encore d'évaluation
- PH Et Équilibre Acido-BasiqueDocument9 pagesPH Et Équilibre Acido-BasiqueAdamPas encore d'évaluation
- Théme 1 - Chapitre 8 - Carte MentaleDocument1 pageThéme 1 - Chapitre 8 - Carte MentaleAbdel ElouaerPas encore d'évaluation
- Reactions Acido BasiquesDocument11 pagesReactions Acido BasiquesBouchi FtyPas encore d'évaluation
- Chapitre IV, L1PCSM FSTDocument21 pagesChapitre IV, L1PCSM FSTbandiaye2002Pas encore d'évaluation
- Equilibres en Solutions Aqueuses PC PDFDocument20 pagesEquilibres en Solutions Aqueuses PC PDFAhmed fattoumPas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- Chapitre 3Document7 pagesChapitre 3srhconnor_31Pas encore d'évaluation
- 08 TS Chimie Cours - Reactions Acido-Basiques-2Document4 pages08 TS Chimie Cours - Reactions Acido-Basiques-2foufoudoudouPas encore d'évaluation
- 2 - Les Acides Et Les BasesDocument21 pages2 - Les Acides Et Les BasesAmine CompanPas encore d'évaluation
- Acides Faibles Bases FaiblesDocument7 pagesAcides Faibles Bases FaiblesBouaouiche KarimPas encore d'évaluation
- Chimie Des Solutions Résumé 04Document23 pagesChimie Des Solutions Résumé 04Jordan PeterPas encore d'évaluation
- Séance 1.091 Acide Base StagiairesDocument7 pagesSéance 1.091 Acide Base Stagiairesaita.kane6Pas encore d'évaluation
- CH4Acide BaseDocument11 pagesCH4Acide BaseAmen RouissiPas encore d'évaluation
- Chimie en SolutionDocument54 pagesChimie en SolutionFRANCK ARMAND JOSIAS BONKOUNGOU WENDBENEDOPas encore d'évaluation
- Reactions Acide-BaseDocument8 pagesReactions Acide-BaseMahmoud GazzahPas encore d'évaluation
- CH Gene Cours Chimie en SolutionDocument41 pagesCH Gene Cours Chimie en SolutionAlhassane BahPas encore d'évaluation
- 3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023Document6 pages3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023Said Said AkandjiPas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- Acides Bases C1Document4 pagesAcides Bases C1Sophie RosiPas encore d'évaluation
- Cours - Chimie - Dosage - Acide - Base - Bac Toutes Sections (2019-2020) MR Sfaxi SalahDocument3 pagesCours - Chimie - Dosage - Acide - Base - Bac Toutes Sections (2019-2020) MR Sfaxi Salahgzqg9cp7mtPas encore d'évaluation
- Chap.I Chimie Analytique II - 2021-2022Document17 pagesChap.I Chimie Analytique II - 2021-2022Mira MslPas encore d'évaluation
- 01-SA1 Réactions Acido-BasiquesDocument12 pages01-SA1 Réactions Acido-BasiquesberthouPas encore d'évaluation
- Polycopie de CG S2 2011Document62 pagesPolycopie de CG S2 2011Dobl JokPas encore d'évaluation
- ILEPHYSIQUE Chimie Terminale Reactions Acido BasiquesDocument4 pagesILEPHYSIQUE Chimie Terminale Reactions Acido BasiquessarahPas encore d'évaluation
- Chapitre II - Chimie II - Equilibres ChimiquesDocument19 pagesChapitre II - Chimie II - Equilibres Chimiqueskim namjoonPas encore d'évaluation
- Chapitre 6 Acides-BasesDocument50 pagesChapitre 6 Acides-BasesMo DicPas encore d'évaluation
- Equilibres Acidobasiques1Document49 pagesEquilibres Acidobasiques1lahcen essPas encore d'évaluation
- Cours Chimie en Solution 2 - Reactions Acido-BasiquesDocument54 pagesCours Chimie en Solution 2 - Reactions Acido-Basiquesmanalch1219Pas encore d'évaluation
- Solutionaqueusechap 2Document6 pagesSolutionaqueusechap 2Kawthar MokhtarPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- S11 - Force Des Acides Et Des BasesDocument5 pagesS11 - Force Des Acides Et Des BasessocranedeoufPas encore d'évaluation
- Résumé App L A M Aux Réactions Acide Base 23 24Document2 pagesRésumé App L A M Aux Réactions Acide Base 23 24Hamdi AbbassiPas encore d'évaluation
- Resumé-Chimie Des SolutionsDocument6 pagesResumé-Chimie Des Solutionsfzsaci26Pas encore d'évaluation
- Cours de Chimie en Solution Les Acides Et Les Bases: 1 Année Biologie 2019-2020Document37 pagesCours de Chimie en Solution Les Acides Et Les Bases: 1 Année Biologie 2019-2020kheddirachidPas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- Cours - Chimie - Les Acides Et Les BasesDocument6 pagesCours - Chimie - Les Acides Et Les BasesDaghsni Said100% (2)
- Force Des Acides Et BasesDocument4 pagesForce Des Acides Et Basestjmhfkdkd5Pas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Première Année de Médecine Dentaire Module de Biophysique Chapitre 2 PPS CHIMIQUES DES SOLUTIONS Prof Karim MANSOUR 2022Document13 pagesPremière Année de Médecine Dentaire Module de Biophysique Chapitre 2 PPS CHIMIQUES DES SOLUTIONS Prof Karim MANSOUR 2022wiamePas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- Résumé 2 Chimie Des SolutionsDocument2 pagesRésumé 2 Chimie Des SolutionsLoubna El JehouariPas encore d'évaluation
- Chap 5 Equilibres Acidobasiques Et PhmetrieDocument5 pagesChap 5 Equilibres Acidobasiques Et PhmetrieAlidou KOHOUMPas encore d'évaluation
- Equilibres Acido-BasiqueDocument43 pagesEquilibres Acido-BasiqueRiani YosriPas encore d'évaluation
- Cancers Et Exposition Professionnelle Aux Radiations IonisantesDocument14 pagesCancers Et Exposition Professionnelle Aux Radiations IonisanteschadaPas encore d'évaluation
- Fiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1Document4 pagesFiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1chadaPas encore d'évaluation
- CV CanadienDocument2 pagesCV CanadienchadaPas encore d'évaluation
- Fiche Sur LélectrolyseDocument4 pagesFiche Sur LélectrolysechadaPas encore d'évaluation
- Fiche Sur La Loi de Modération 3Document2 pagesFiche Sur La Loi de Modération 3chadaPas encore d'évaluation
- Correction de La Série Dexercices Sur Les Piles de Type DaniellDocument12 pagesCorrection de La Série Dexercices Sur Les Piles de Type Daniellchada100% (1)
- Correction de La Série de Révision Sur Les Acides Et Les BasesDocument7 pagesCorrection de La Série de Révision Sur Les Acides Et Les BaseschadaPas encore d'évaluation
- Fiche Sur Notion Déquilibre ChimiqueDocument3 pagesFiche Sur Notion Déquilibre ChimiquechadaPas encore d'évaluation
- Révision Unités Et FormulesDocument2 pagesRévision Unités Et FormuleschadaPas encore d'évaluation
- La Pile AlcalineDocument5 pagesLa Pile Alcalinechada100% (1)
- Série 1Document7 pagesSérie 1chadaPas encore d'évaluation
- Révision Équilibre Chimique CorrectionDocument10 pagesRévision Équilibre Chimique CorrectionchadaPas encore d'évaluation
- Révision Equilibre ChimiqueDocument6 pagesRévision Equilibre ChimiquechadaPas encore d'évaluation
- En 60079-1Document75 pagesEn 60079-1Aek Larabi100% (1)
- Onde ScalaireDocument23 pagesOnde ScalairesyliusPas encore d'évaluation
- Progression Graphisme P1Document3 pagesProgression Graphisme P1cocaPas encore d'évaluation
- Série N°3 - Dynamique Des FluidesDocument9 pagesSérie N°3 - Dynamique Des FluidesJasmine Yasmine100% (1)
- Transferts Thermiques 1Document10 pagesTransferts Thermiques 1houssem dhiebPas encore d'évaluation
- Certificado Ref 51103 Lote 1007622670Document2 pagesCertificado Ref 51103 Lote 1007622670Mike SanchezPas encore d'évaluation
- FTF SuperviseurDocument10 pagesFTF SuperviseurYannick AgbavonPas encore d'évaluation
- Sujet de Doctorat Mécanique PDFDocument1 pageSujet de Doctorat Mécanique PDFZaidi IsmailPas encore d'évaluation
- LES CODES ORAL ET ECRIT - Docx Les Registes de LanguesDocument7 pagesLES CODES ORAL ET ECRIT - Docx Les Registes de LanguesSeydou KantePas encore d'évaluation
- I I 'A C: Nstitut Nternational D Frique EntraleDocument2 pagesI I 'A C: Nstitut Nternational D Frique EntraleAbdel Bassid IssaPas encore d'évaluation
- Projet Projet Projet Projet: Les Doudous: Les Doudous: Les Doudous: Les DoudousDocument4 pagesProjet Projet Projet Projet: Les Doudous: Les Doudous: Les Doudous: Les DoudousAlfrida FleurPas encore d'évaluation
- OHL Les Lignes de Transport HTDocument5 pagesOHL Les Lignes de Transport HTKassem BaalbakiPas encore d'évaluation
- 15 Richany Samer - Grand Oral MathsDocument6 pages15 Richany Samer - Grand Oral MathsSamer RichanyPas encore d'évaluation
- TP Scilab BodeDocument11 pagesTP Scilab BodeMohamed LahninePas encore d'évaluation
- ExposéDocument4 pagesExposétehillahngolo3Pas encore d'évaluation
- Root JoinDocument198 pagesRoot JoinBabacar SowPas encore d'évaluation
- 1ère - Physique Chimie Spécialité Correction de L'Épreuve Commune - Décembre 2021 APP RCO REA Ana/ RAI COMDocument3 pages1ère - Physique Chimie Spécialité Correction de L'Épreuve Commune - Décembre 2021 APP RCO REA Ana/ RAI COMWolfGangPas encore d'évaluation
- TP1ALGODocument4 pagesTP1ALGOBabacar SowPas encore d'évaluation
- Par Le Bout Du NezDocument40 pagesPar Le Bout Du NezLeila MekkaouiPas encore d'évaluation
- Cours Lois Newton ProfDocument5 pagesCours Lois Newton ProfPatrick HenryPas encore d'évaluation
- Chapitre 3Document12 pagesChapitre 3Wissem BejaouiPas encore d'évaluation
- Serie EspaceDocument2 pagesSerie EspaceNermin ArfaouiPas encore d'évaluation
- Rapport StageDocument35 pagesRapport StageMou The ScientistPas encore d'évaluation
- Exp Bac EcoDocument4 pagesExp Bac EcoChaima QasimiPas encore d'évaluation
- Exercices Préliminairess (Original)Document5 pagesExercices Préliminairess (Original)Princ Aimriss Mobongo100% (1)
- Rapport Devloppement DturDocument11 pagesRapport Devloppement DturAmine El BougriniPas encore d'évaluation