Académique Documents
Professionnel Documents
Culture Documents
3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023
Transféré par
Said Said AkandjiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023
Transféré par
Said Said AkandjiDroits d'auteur :
Formats disponibles
Groupe LOKO 2022-2023 Génie du Bâtiment 1ère Année
Chapitre 3 : Acides et bases en solution aqueuse, Ph, 𝐊 𝐀 et 𝐩𝐊 𝐀
3.1. Acides et bases : modèles et définitions
3.1.1. Définition d’Arrhenius pour les bases fortes courantes
Une base d’Arrhenius est un composé ionique comportant des ions hydroxyde OH − ,
qui sont dispersés lors de la dissolution par l’eau.
La soude NaOH et la potasse KOH (très solubles dans l’eau), la baryte Ba(OH)2 (assez
soluble), ainsi que la chaux éteinte Ca(OH)2 et la magnésie Mg(OH)2 (peu solubles),
sont les plus connues et les plus utilisées des bases d’Arrhenius. Elles sont appelées
bases fortes car ce sont des électrolytes forts :
H O
NaOH (s) 2 Na+ (aq) + OH − (aq)
→
3.1.2. Définitions de la théorie de Brønsted-Lowry
• Un acide de Brønsted est une espèce chimique capable de céder un proton H + ; c’est
un donneur de proton.
• Une base de Brønsted est une espèce chimique capable de capter un proton H + ; c’est
un accepteur de proton.
• Un amphotère (ou ampholyte) est une espèce chimique susceptible de se comporter
comme un acide ou comme une base.
La perte du proton H + par l’acide ne se fait qu’en présence de la base qui le fixe. Il y a
simultanément déprotonation de l’acide et protonation de la base. La particule
élémentaire H + est donc échangée sans être libérée dans les solutions.
- Une réaction acide-base est une réaction de transfert de proton du donneur (acide) à
l’accepteur (base). Par exemple :
CH3 COOH (aq) + NH3 (aq) → CH3 COO− (aq) + NH4 + (aq)
3.2. Autoprotolyse de l’eau
3.2.1. Équilibre d’autoprotolyse
La structure de la molécule H2 O confère à l’eau un caractère amphotère. L’auto-
ionisation de l’eau liquide, interprétée à la lumière de la théorie de Brønsted, est le
transfert d’un proton d’une molécule d’eau qui joue le rôle d’un acide à une autre
molécule d’eau qui joue le rôle d’une base. Les processus aller et retour se déroulant à
la même vitesse, l’eau liquide est le siège de l’équilibre d’autoprotolyse :
H2 O + H2 O ⇌ H3 O+ + OH −
Cours proposé par M. SOSSO Innocent Page 1
Groupe LOKO 2022-2023 Génie du Bâtiment 1ère Année
3.2.2. Produit ionique de l’eau
Sachant que :
• 1 L d’eau a une masse de 1000 g et que M(H2 O) = 18 g ∙ mol−1 ,
[H3 O+ ] [OH − ]
• = = 1,8 ∙ 10−9 à 25 °C,
[H2 O] [H2 O]
alors les concentrations de H2 O, H3 O+ (ion hydronium) et OH − (ion hydroxyde) sont,
dans l’eau pure à 25 °C :
1000
[H2 O] = = 55,56 mol ∙ L−1
18
[H3 O+ ] = [OH − ] = 1,8 ∙ 10−9 ∙ 55,56 = 10−9 mol ∙ L−1
L’existence de l’équilibre d’autoprotolyse impose que les concentrations des ions H3 O+
et OH − ne puissent pas varier indépendamment. Ce sont des grandeurs liées par le
produit ionique de l’eau dont la valeur est calculée à partir des concentrations [H3 O+ ]
et [OH − ] dans l’eau pure :
K e = [H3 O+ ] × [OH − ] = 10−14 à 25 °C
On définit aussi le logarithme de K e :
pK e = – log10 K e ou K e = 10−pKe
3.3. pH, définition et échelle
En solution pas trop concentrée, le pH est donné par la formule approchée :
pH =– log10 [H3 O+ ] ou [H3 O+ ] = 10−pH
Pour la grande majorité des applications pratiques, l’échelle de pH s’étend de 0 à 14.
1°) En milieu neutre, dans l’eau pure à 25 °C, pH = 7 :
[H3 O+ ] = [OH − ] = 10−7 mol ∙ L−1
2°) En milieu acide, pH < 7 :
[H3 O+ ] > 10−7 mol ∙ L−1 et [OH − ] < 10−7 mol ∙ L−1
2°) En milieu basique, pH > 7 :
[H3 O+ ] < 10−7 mol ∙ L−1 et [OH − ] > 10−7 mol ∙ L−1
Cours proposé par M. SOSSO Innocent Page 2
Groupe LOKO 2022-2023 Génie du Bâtiment 1ère Année
3.4. Forces des acides et des bases dans l’eau
Pour comparer les forces des acides et des bases, on compare leur action sur l’eau.
3.4.1. Couple acide/base et réaction acide-base
Tout couple acide/base est tel que :
Acide = base + H +
Il ne s’agit là que d’une relation stoechiométrique. Il ne se produit pas de transfert de
proton entre deux formes acide et basique conjuguées. Il n’y a transfert de proton, et
donc réaction acide-base, qu’entre un acide et une base appartenant à deux couples
différents. La dissolution des acides et des bases de Brønsted dans l’eau est une réaction
acide-base :
a) Dissolution d’un acide HA dans l’eau
HA (aq) + H2 O (l) ⇌ H3 O+ (aq) + A− (aq)
Acide 1 Base 2 Acide 2 Base 1
Couples acide/base en jeu :
(1) HA/A−
(2) H3 O+ /H2 O
b) Dissolution d’une base de Brønsted (B) dans l’eau
B (aq) + H2 O (l) ⇌ BH + (aq) + OH − (aq)
Base 3 Acide 4 Acide 3 Base 4
Couples acide/base en jeu :
(3) BH + /B
(4) H2 O/OH −
3.4.2. Acides et bases forts
• Un acide fort dans l’eau est totalement converti en H3 O+ et en sa base conjuguée ; par
exemple, le chlorure d’hydrogène HCl, gaz dont la solution dans l’eau est l’acide
chlorhydrique :
HCl + H2 O → H3 O+ + Cl−
• Une base forte de Brønsted dans l’eau est totalement convertie en OH − et en son
acide conjugué. La réaction sur l’eau des amidures alcalins et alcalino-terreux montre
que l’ion amidure NH2 − , par exemple, est une base forte :
(Na+ ) + NH2 − + H2 O → NH3 + OH − + (Na+ )
Cours proposé par M. SOSSO Innocent Page 3
Groupe LOKO 2022-2023 Génie du Bâtiment 1ère Année
Dans un couple acide/base, si la forme acide est forte, sa base conjuguée est indifférente
(elle ne se comporte pas comme une base dans l’eau) ; inversement, si la forme basique
est forte, son acide conjugué est indifférent (pas de rôle acide dans l’eau).
3.4.3. Acides et bases faibles : 𝐊 𝐀 , 𝐊 𝐁 𝐞𝐭 𝐩𝐊 𝐀
• Un acide est faible si sa dissolution dans l’eau conduit à l’établissement d’un équilibre :
Acide + H2 O ⇌ H3 O+ + Base
En solution pas trop concentrée, la constante d’acidité K A s’exprime par :
[Base] ∙ [H3 O+ ]
K A (Acide/Base) =
[Acide]
1
pK A = – log10 K A = log10 ou K A = 10−pKA
KA
Pour tout couple acide/base faible en solution aqueuse :
KA < 1
{
pK A > 0
• Une base est faible si sa dissolution dans l’eau conduit à l’établissement d’un équilibre :
Base + H2 O ⇌ OH − + Acide
La constante de basicité K B est :
[Acide] ∙ [OH − ]
KB = avec pK B = – log10 K B
[Base]
K B est reliée à la constante d’acidité K A du couple acide/base concerné par :
KA ∙ KB = Ke pK A + pK B = 14 à 25 °C
Remarque : Certains acides sont des polyacides faibles, certaines bases sont des
polybases faibles. Un polyacide est susceptible de subir des déprotonations successives,
une polybase, des protonations successives.
3.4.4. Loi de dilution d’Ostwald
Par définition, les acides faibles de type HA ne se dissolvent pas totalement sous forme
d’ions H3 O+ et A− ; similairement, les bases faibles de type B ne se convertissent pas
totalement en ions BH + et OH − . Ce ne sont pas des électrolytes forts, mais des
électrolytes faibles.
Cours proposé par M. SOSSO Innocent Page 4
Groupe LOKO 2022-2023 Génie du Bâtiment 1ère Année
Ils obéissent à la loi de dilution d’Ostwald qui stipule que l’équilibre de dissociation d’un
électrolyte faible en ions se déplace vers la droite par dilution. À très grande dilution,
l’équilibre est totalement déplacé vers la droite, il devient une réaction quantitative dans
le sens 1. L’électrolyte faible se comporte alors comme un électrolyte fort.
Cette loi, très importante, se généralise à tout acide ou toute base faible donnant lieu aux
équilibres vus plus haut ; à grande dilution, tout acide se comporte comme un acide fort :
Acide + H2 O → H3 O+ + Base
et toute base comme une base forte :
Base + H2 O → OH − + Acide
3.4.5. Coefficient de dissociation d’un acide et constante d’acidité
Soit un acide faible, introduit en solution à la concentration c, et donnant lieu à
l’équilibre acide/base. On appelle coefficient de dissociation α de cet acide le rapport :
[Base]
α=
c
Ce coefficient mesure la position de l’équilibre dans des conditions expérimentales
données ; α est compris entre 0 (dissociation négligeable) et 1 (acide se comportant
comme un acide fort).
La conservation de la matière à l’équilibre s’écrit :
c = [acide] + [base]
Par conséquent, on a [base] = cα et [acide] = c(1– α).
Sauf à très grande dilution de l’acide, l’autoprotolyse de l’eau rétrograde suffisamment
pour générer une quantité d’ions H3 O+ négligeable devant l’apport dû à l’acide :
[H3 O+ ]auto = ε
On peut donc écrire :
Acide + H2 O ⇌ H3 O+ + Base
c(1– α) cα + ε ≈ cα cα
D’où l’expression de K A :
cα2 α2 KA
KA = ce qui donne ausssi ∶ =
1−α 1−α c
Cours proposé par M. SOSSO Innocent Page 5
Groupe LOKO 2022-2023 Génie du Bâtiment 1ère Année
3.5. Prédominance et diagramme de distribution
3.5.1. Relation d’Henderson-Hasselbalch
Rappelons que :
[Base] ∙ [H3 O+ ]
K A (Acide/Base) =
[Acide]
La transformée logarithmique de cette expression de la constante d’acidité K A conduit à
la relation d’Henderson-Hasselbalch :
[Base] [Base]
pH = pK A + lg10 soit = 10pH−pKA
[Acide] [Acide]
3.5.2. Espèce prédominante/majoritaire
Des deux formes acide et basique conjuguées, celle qui est en quantité supérieure à
l’autre est l’espèce prédominante. Si elle est en quantité au moins dix fois supérieure à
l’autre, elle est dite majoritaire.
Les formes sont en concentration égale lorsque :
[Base]
pH = pK A soit = 100 = 1
[Acide]
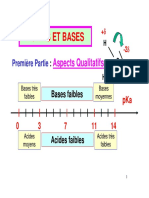
3.5.3. Diagramme de prédominance et de distribution
La représentation des domaines de prédominance des espèces en fonction du pH sur un
axe est le diagramme de prédominance.
On peut également calculer les rapports [base]/c et [acide]/c (c = [acide] + [base]) et
tracer les courbes de distribution des espèces : [base]/c = f(pH) et [acide]/c = f(pH).
Ces courbes se coupent au point d’abscisse pH = pK A et d’ordonnée 1/2. De telles
courbes peuvent être généralisées à un polyacide ou à une polybase.
Cours proposé par M. SOSSO Innocent Page 6
Vous aimerez peut-être aussi
- Chsol - Chapitre IiDocument28 pagesChsol - Chapitre IielkhiatmohammedaminePas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- Cours de Chimie Des Solutions Chapitre 2 Acides Et BasesDocument58 pagesCours de Chimie Des Solutions Chapitre 2 Acides Et Basesmeriemg912Pas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- C02 - Équilibres Acido-Basiques - EleveDocument5 pagesC02 - Équilibres Acido-Basiques - EleveElPas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Solutionaqueusechap 2Document6 pagesSolutionaqueusechap 2Kawthar MokhtarPas encore d'évaluation
- Chapitre 6 Acides-BasesDocument50 pagesChapitre 6 Acides-BasesMo DicPas encore d'évaluation
- Séance 1.091 Acide Base StagiairesDocument7 pagesSéance 1.091 Acide Base Stagiairesaita.kane6Pas encore d'évaluation
- AcibaseDocument35 pagesAcibaseAbdessamad EttariqiPas encore d'évaluation
- Equilibre Acido-Basique 2019Document44 pagesEquilibre Acido-Basique 2019Théophile NAMOINEPas encore d'évaluation
- Chap I Acide BaseDocument81 pagesChap I Acide BaseyoussefPas encore d'évaluation
- Chimie en SolutionDocument166 pagesChimie en Solutionjawad izallalenPas encore d'évaluation
- Cour de Chimie en SolutionDocument20 pagesCour de Chimie en SolutionIhsan Mokhlisse100% (28)
- Cours Acide BaseDocument14 pagesCours Acide BaseAli AllamPas encore d'évaluation
- Capture D'écran . 2022-01-29 À 23.52.15 PDFDocument11 pagesCapture D'écran . 2022-01-29 À 23.52.15 PDFAymen NamanePas encore d'évaluation
- Equilibres Acido-BasiqueDocument43 pagesEquilibres Acido-BasiqueRiani YosriPas encore d'évaluation
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Equilibres Acidobasiques1Document49 pagesEquilibres Acidobasiques1lahcen essPas encore d'évaluation
- Cours de Chimie en Solution Les Acides Et Les Bases: 1 Année Biologie 2019-2020Document37 pagesCours de Chimie en Solution Les Acides Et Les Bases: 1 Année Biologie 2019-2020kheddirachidPas encore d'évaluation
- Cours Chimie Analytique 2 AnnéeDocument4 pagesCours Chimie Analytique 2 AnnéeMeryem ZouarhiPas encore d'évaluation
- Chapitre I Partie 1Document8 pagesChapitre I Partie 1Amna TahriPas encore d'évaluation
- Les Acides Et Les BasesDocument59 pagesLes Acides Et Les BasesCarter JeanPas encore d'évaluation
- Acide Base PDFDocument26 pagesAcide Base PDFFoudil Laouici100% (1)
- Partie I - Cours Acides Bases 2019Document68 pagesPartie I - Cours Acides Bases 2019Youssef AouinPas encore d'évaluation
- Equilibre Acido-BasiqueDocument44 pagesEquilibre Acido-BasiqueKhaoula OthmaniPas encore d'évaluation
- Chimie en SolutionDocument54 pagesChimie en SolutionFRANCK ARMAND JOSIAS BONKOUNGOU WENDBENEDOPas encore d'évaluation
- Chapitre IV, L1PCSM FSTDocument21 pagesChapitre IV, L1PCSM FSTbandiaye2002Pas encore d'évaluation
- Chap I-2 CSDocument18 pagesChap I-2 CSSimo MaroPas encore d'évaluation
- COURS Acide Base PDFDocument18 pagesCOURS Acide Base PDFYasmina BenPas encore d'évaluation
- Chap I Equilibres AcidobasiquesDocument28 pagesChap I Equilibres Acidobasiqueselguerchsara68Pas encore d'évaluation
- 01 - Les Acides Et BasesDocument34 pages01 - Les Acides Et BasesBsissaSoltaniPas encore d'évaluation
- Rev Ac Bas PDFDocument5 pagesRev Ac Bas PDFYoussef BerquedichPas encore d'évaluation
- Analyse Equilibres Reactions Acide Base PrecipitationDocument50 pagesAnalyse Equilibres Reactions Acide Base PrecipitationCyril GaillardPas encore d'évaluation
- Force Des Acides Et BasesDocument4 pagesForce Des Acides Et Basestjmhfkdkd5Pas encore d'évaluation
- Les Équilibres Acido-BasiquesDocument48 pagesLes Équilibres Acido-Basiquesj92366361Pas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Chimie Des Solutions AqueusesDocument29 pagesChimie Des Solutions AqueusesJean-Loïc BauchetPas encore d'évaluation
- Les ReactionsDocument18 pagesLes ReactionsChaymae AyatiPas encore d'évaluation
- Chapitre IV 1Document37 pagesChapitre IV 1sidiPas encore d'évaluation
- Rappels Chimie Des SolutionsDocument24 pagesRappels Chimie Des SolutionsDavid KientegaPas encore d'évaluation
- Chimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)Document41 pagesChimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)AliEle2013Pas encore d'évaluation
- Séance 9Document13 pagesSéance 9SantamitoPas encore d'évaluation
- Définitions Des Acides Et Des BasesDocument7 pagesDéfinitions Des Acides Et Des BasesMaria ConstantinoPas encore d'évaluation
- Acide Base PDFDocument16 pagesAcide Base PDFchahin07Pas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- SN2-Chapitre 05 H2024Document29 pagesSN2-Chapitre 05 H2024alyssiamorrissette7Pas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- Fascicule 2007-2008-2eme Partie Chi PhysikDocument96 pagesFascicule 2007-2008-2eme Partie Chi PhysikHenri Elias HabibPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Types de Compresseurs D'airDocument24 pagesTypes de Compresseurs D'airrocceli nzoulouPas encore d'évaluation
- 2MRLMD Affectation v1Document2 pages2MRLMD Affectation v1Riadh AlianiPas encore d'évaluation
- CiscoDocument7 pagesCiscoma llekPas encore d'évaluation
- Estimation IncertitudesDocument35 pagesEstimation IncertitudesBacem Chaabane100% (1)
- Partie Mecanique Frein Graisseur Boudin Rames z2m Cours DumDocument29 pagesPartie Mecanique Frein Graisseur Boudin Rames z2m Cours DumAbdou Benziane50% (2)
- TD1 Algorithme - 1 PDFDocument1 pageTD1 Algorithme - 1 PDFmaherhamdiPas encore d'évaluation
- Exercice 3. Surfer Sur La Vague: Sujet 1, Amérique Du Nord, Juin 2013Document206 pagesExercice 3. Surfer Sur La Vague: Sujet 1, Amérique Du Nord, Juin 2013ogbondaPas encore d'évaluation
- TP Access 2017Document5 pagesTP Access 2017Amine MénPas encore d'évaluation
- Session 1 2013 2014Document8 pagesSession 1 2013 2014Yc YacinePas encore d'évaluation
- Devoir de Synthèse N°2 - SVT - 1ère AS (2011-2012) MR Korbi WissemDocument3 pagesDevoir de Synthèse N°2 - SVT - 1ère AS (2011-2012) MR Korbi WissemSassi LassaadPas encore d'évaluation
- Audrey Roig-L'Adjectivité Approches Descriptives de La Linguistique Adjectivale-JerichoDocument518 pagesAudrey Roig-L'Adjectivité Approches Descriptives de La Linguistique Adjectivale-JerichoKi WiPas encore d'évaluation
- PythagoreDocument13 pagesPythagorelemoga75yahoo.frPas encore d'évaluation
- TD DHCPDocument2 pagesTD DHCPomrani.ahmed2002Pas encore d'évaluation
- 1813 Belidor La Science Des IngenieurDocument652 pages1813 Belidor La Science Des Ingenieuremmanuel nuñez ruizPas encore d'évaluation
- CryptographieDocument42 pagesCryptographieYoussef AlsabekPas encore d'évaluation
- Arduino - Use A Shift Register (74HC595) and A Transistor Array (ULN2803) Erwan's BlogDocument3 pagesArduino - Use A Shift Register (74HC595) and A Transistor Array (ULN2803) Erwan's BlogapofviewPas encore d'évaluation
- Devoir de Synthèse N°1 2019 2020 (MR Foued Bahlous)Document5 pagesDevoir de Synthèse N°1 2019 2020 (MR Foued Bahlous)Abdelkader HamdaPas encore d'évaluation
- Chapitre 5 SuiteDocument5 pagesChapitre 5 Suitelilia RabhiPas encore d'évaluation
- Chapitre 3 L'imputation Rationelle Des Charges FixesDocument5 pagesChapitre 3 L'imputation Rationelle Des Charges Fixesghassen Ben hlimaPas encore d'évaluation
- Langage Sas EnsaeDocument124 pagesLangage Sas EnsaeMohamedPas encore d'évaluation
- Connaissance de La Mecanique Des Sols BTP-TSCTDocument43 pagesConnaissance de La Mecanique Des Sols BTP-TSCTprincessesara100% (3)
- AnouarDocument6 pagesAnouarAnouar Mca DebbabiPas encore d'évaluation
- Rapport 2021 Hajri MarwaDocument30 pagesRapport 2021 Hajri MarwaMarwa HajriPas encore d'évaluation
- Crackme 4 - Le Chiffre Inconnu PDFDocument3 pagesCrackme 4 - Le Chiffre Inconnu PDFFrançois MolletPas encore d'évaluation
- Calcul D'un Volant D'inertieDocument19 pagesCalcul D'un Volant D'inertieNathan KibilaPas encore d'évaluation
- Examens Corrigés Examens Corrigés: Sciences Des Matériaux Sciences Des MatériauxDocument31 pagesExamens Corrigés Examens Corrigés: Sciences Des Matériaux Sciences Des Matériauxkoruko basketPas encore d'évaluation
- 07 Decouverte Utilisation ElasticsearchDocument33 pages07 Decouverte Utilisation ElasticsearchChristian BibouePas encore d'évaluation
- Geometrie VectorielleDocument44 pagesGeometrie VectorielleAdel Fehri100% (1)
- Integral 18 Complet PDFDocument28 pagesIntegral 18 Complet PDFBouazizi HechmiPas encore d'évaluation
- MAT2023 Chapitre0Document10 pagesMAT2023 Chapitre0KamPas encore d'évaluation