Académique Documents
Professionnel Documents
Culture Documents
Séance 1.091 Acide Base Stagiaires
Transféré par
aita.kane6Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Séance 1.091 Acide Base Stagiaires
Transféré par
aita.kane6Droits d'auteur :
Formats disponibles
Chimie Générale Activité type 1
Vénissieux TTE Analyser
Séance 1.09 Les acides et les bases J. MERCADIER
13/09/07 Révision 0
1. Les acides : définition
Les acides sont des molécules (ou ions) capables de céder un ou plusieurs protons.
exemple 1: HCl H+ + Cl-
H+ + H2O H3O+
L’acide chlorhydrique peut céder 1 proton H3O+ donc c’est un monoacide.
exemple 2 : H2SO4 2 H+ + SO4--
2 H+ + 2 H2O 2 H3O+
L’acide sulfurique peut céder 2 protons H3O+ donc c’est un diacide.
2. Les bases : définition
Les bases sont des molécules (ou ions) capables de capter un ou plusieurs protons.
exemple 1 : NaOH + H+ H2O + Na+
H2O H+ + OH-
La soude peut céder 1 anion OH- qui va capter un proton H3O+ donc c’est un monobase.
OH- + H3O+ 2 H2O
exemple 2 : Ca(OH)2 + 2 H+ 2 H2O + Ca++
2 H2O 2 H+ + 2 OH-
La chaux peut céder 2 anions OH- qui vont capter 2 protons H3O+ donc c’est une dibase.
708636001.doc Page 1 sur 7
3. Les couples acides / bases
On a coutume de simplifier l’écriture des équations définissant les couples acide/base en
supprimant la molécule d’eau de part et d’autre et en remplaçant H3O+ par le proton H+
NH3 + H+ NH4+
Base acide
NH4+ NH3 + H+
Acide base
On a donc le couple : NH4+ / NH3
On dit que NH4+ est l’acide conjugué de la base NH3.
On dit que NH3 est la base conjuguée de l’acide NH4+.
En annexe, vous avez un tableau regroupant quelques exemples de couples acide/base.
4. Force des acides et des bases
L’eau à un comportement acide en présence d’une base et un comportement basique en présence
d’un acide. C’est ce que l’on appelle le caractère amphotère de l’eau.
L’eau n’est pas la seule substance à posséder cette propriété.
Le comportement (acide ou basique) d’une substance dans une situation donnée sera dictée par la
force du caractère de la substance avec la quelle elle est mise en contact.
Cela nous conduit donc à envisager la notion de force relative des acides et des bases.
Lorsque l’on dissous un acide dans l’eau il se dissocie en donnant des ions et un anion.
Cet anion, dans certaines conditions, est capable de recapter le proton fixé par l’eau ; il est de ce
fait une base. Il y a en réalité une compétition permanente entre les deux processus simultanés
par l’équation bilan suivante :
AH + H2O ⇄ H3O+ + A-
De cette compétition dans une solution aqueuse acide on va trouver simultanément ces quatre
espèces chimiques.
On dit que l’on est présence d’un équilibre chimique.
Tous les acides ne cèdent pas leur proton avec la même facilité.
Les acides forts cèdent facilement leur proton.
Les acides faibles cèdent difficilement leur proton.
Plus un acide est fort, plus la proportion des espèces qui apparaissent à droite de l’équation sera
importante comparée à celles des espèces figurant à gauche.
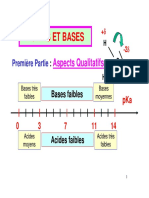
Pour mesurer la force des différents acides, on défini une constante d’acidité Ka par le rapport :
Ka = [H3O+ ] . [A- ]
[ AH ] . [ H2O ]
Ka est une constante adimensionnelle sa valeur est indépendante de la concentration globale de la
solution. Elle caractérise donc la force de l’acide.
708636001.doc Page 2 sur 7
On a coutume de considérer comme acide fort les acides qui sont totalement ionisés en solution
dans l’eau. Les acides forts les plus courant sont : HCl, H2SO4 et HNO3.
Les autres acides sont regroupés en acides moyennement forts et en acides faibles.
Dans les couples acide/base , plus un acide est fort, plus sa base conjuguée est faible.
Plus l’acide libère facilement son proton et donc plus difficilement sa base conjuguée le capte.
On peut donc classer les couples acide/base en fonction de leur constante d’acidité Ka.
Voir tableau en annexe.
5. Equilibre ionique de l’eau, notion de pH
L’eau est à la fois un acide et une base. Elle est capable de réagie sur elle même.
2 H2O → H3O+ + OH-
Le réaction inverse a évidemment lieu simultanément.
H3O+ + OH- → 2 H2O
Ceci conduit en fait à un équilibre entre les deux processus.
L’acide H2O est un acide très faible et de ce fait son abondance sera très largement supérieure à
celle des ions H3O+ et OH- dans l’eau pure.
2 H2O ⇄ H3O+ + OH- c’est l’autoprotolyse de l’eau
La concentration des ions H3O+ et celle des ions OH- sont évidemment égales dans l’eau pure
puisqu’elle sont formées en nombre égal à partir de deux molécules d’eau. Les ions H3O+ ne
sont en fait que le résultat de la captation des protons par des molécules d’eau ; on parle de
protons solvatés. On simplifie l’écriture de l’équation de l’équilibre de la façon suivante :
H2O ⇄ H+ + OH-
On peut définir pour l’eau une constante d’acidité comme pour n’importe quel acide :
Ka = [ H+ ] . [OH- ] on utilise également le grandeur pKa = - log Ka
[ H2O ]
Il existe une autre grandeur importante dans les solutions aqueuses diluées, c’est le pH (potentiel
hydrogène). On est dans un domaine où la concentration en H3O+ va aller de 0,1 à 10-14mol.L-1.
Définition : pH = - log [H3O+ ] soit [H3O+ ] = 10- pH
Dans une solution aqueuse la gamme de pH va de 0 à 14.
La valeur de ph = 7 correspond à le neutralité de la solution.
708636001.doc Page 3 sur 7
2 H2O ⇄ H3O+ + OH- De cette équation appliquée dans l’eau on a pu mesurer
le produit ionique de l’eau :
Ke = [H3O+ ] . [OH- ] = 10 –14 mol.L-1 à 25 °C
On précise la température car Ke varie sensiblement avec la température :
Ke = 10-13 à 60°C et Ke = 10-15 à 0°C.
dans la solution à pH = 7 on a : [H3O+ ] = 10-7 mlo/L soit 0,000 000 7 mol/L
Je peux donc calculer la concentration en OH- grâce au produit ionique de l’eau.
[ OH- ] = 10 –14 = 10 –7 mol/L
10 -7
Il y a donc à la neutralité autant de moles de H3O+ que de mole de OH- .
En connaissant une concentration en proton dans une soluition aqueuse, on peut donc en calculer
son pH.
Exemple : [H3O+ ] = 10-3 mol/L => pH = - log ( 10-3) => pH = 3
[H3O+ ] = 2.10-4 mol/L => pH = - log (2.10-4) => pH = 3,7
6. La réaction acide-base
On a coutume de simplifier l’écriture des équations définissant les couples acide/base en
supprimant la molécule d’eau de part et d’autre.
AH ⇄ H+ + A- Ka = [ H+ ].[ A- ]
[ AH ]
L’écriture des constants d’acidités en sont simplifiées mais les valeurs n’en sont pas affectées du
moins tant qu’on considère des solutions suffisamment diluées.
Les réactions entre acides et bases sont donc en fait des réactions entre couples différents.
L’acide de l’un de couple réagit avec la base de l’autres :
Acide 1 ⇄ base 1 + H+ Ka1
Acide 2 ⇄ base 2 + H+ Ka2
Le sens spontané des réactions est fixé par la valeur des deux constantes d’acidités des 2 couples.
Les couples acide/base étant listés en fonction de leur Ka en ordre décroissant, on pourra prévoir
les réactions possibles en appliquant la règle du « gamma ».
L’acide le plus fort réagit spontanément avec la base la plus forte pour donner l’acide le plus
faible avec la base la plus faible.
708636001.doc Page 4 sur 7
Si la Ka1>>>> Ka2 on aura spontanément une réaction complète dans le sens :
Acide 1 + base 2 → acide 2 + base 1
Si Ka1 > Ka2 on aura un équilibre qui pourra être déplacé dans un sens ou dans l’ autre en
fonction des concentrations des réactifs mis en jeu.
Acide 1 + base 2 ⇄ acide 2 + base 1
Exercices :
Les réactions suivantes auront-elles lieu ?
a) HCl + H2O H3O+ + Cl-
HCl Ka = couple :
H2O Ka = couple :
b) CH3COOH + H2O
CH3COOH Ka = couple :
H2O Ka = couple :
c) NH3 + H2O
NH3 Ka = couple :
H2O Ka = couple :
7. Le dosage acido-basique
Pour connaître la concentration d’une solution d’acide ou de base on réalise ce que l’on appelle
un dosage. Cela consiste à neutraliser (faire réagir totalement) l’acide ou la base contenu dans
un volume connu exactement d’échantillon à l’aide de la quantité juste suffisante d’une solution
de base ou d’acide dont on connaît exactement la concentration (solution titrée).
On mesure précisément le volume versé au point d’équivalence, c’est à dire le moment où l’on a
introduit dans l’échantillon la quantité juste suffisante de solution titrante pour neutra liser la
quantité d’acide ou de base qu’elle contenait à l’origine.
La principale difficulté est de déterminer le plus précisément possible le point final du dosage.
Au point d’équivalence il y aura toujours la relation :
Na . Va = Nb . Vb à l’équivalence 1 mole d’acide est neutralisée par une mole de base
Na : normalité de la solution acide en mol.L-1
Nb : normalité de la solution basique en mol.L-1
Va : volume de l’acide en mL
Vb : volume de la base en mL
708636001.doc Page 5 sur 7
Déroulement du dosage :
Cas d’un acide fort dosé par une base forte.
HCl + NaOH NaCl + H2O
HCl NaOH NaCl H2O Variation pH
État initial CaVa 0
Avant
équivalence
équivalence
Après
équivalence
Exemple : solution d’HCl à 1 mol/L
HCl NaOH NaCl H2O Variation pH
État initial 1 mole 0
Avant
0,8
équivalence
Avant
0,5
équivalence
Avant
0,3
équivalence
équivalence
Après
équivalence
C’est ce que l’on appelle un dosage volumétrique
708636001.doc Page 6 sur 7
8. Deux exemples de calculs de pH dans une solution
8.1. Cas des acides forts
On doit résoudre un système d’équation à 4 inconnues pour calculer le pH. Les 4 concentrations
sont : [AH], [H2O], [A-] et [H+]
De manière générale si AH représente un acide on a :
AH + H2O ⇄ H3O+ + A-
Lorsque l’on dissous un acide fort dans l’eau, la reaction d’ionisation avec l’eau est pratiquement
complète car la constante Ka de l’acide est très supérieure à celle de l’ion hydronium.
La concentration des ions H
+ est pratiquement égale à la concentration globale de l’acidedans la solution préparée soit C M en
mol/L. On a donc :
[H+] = CM et pH = - log CM
Acide fort CM (mol/L) [H+] (mol/L) pH
HNO3 0,015
H2SO4 2,5
HCl 0,1
8.2 Cas des acides très faibles
Si l’acide est très faible il ne sera pratiquement pas ionisé et dans ces conditions on peut supposer
sans faire trop d’erreur que [AH] = CM
Le produit ionique de l’eauétant très faible, on peut négliger la concentration des ions
hydroxydes devant celle de la base conjuguée et donc [H+] ~ [A-]
( pour que cette hypothèse soit vraissemblable il convient que : 10-6< CM< 10-1 )
Dans ces conditions on a : [H+]2 = Ka . CM et donc pH = 1 ( pKa – log CM )
2
Acide faible CM (mol/L) Ka pKa [H+] (mol/L) pH
H3PO4 0,1
CH3COOH 4
HClO 0,001
708636001.doc Page 7 sur 7
Vous aimerez peut-être aussi
- These L'EFFET DES PRATIQUES DE GESTION DES RESSOURCES HUMAINES SUR LA PERFORMANCEDocument225 pagesThese L'EFFET DES PRATIQUES DE GESTION DES RESSOURCES HUMAINES SUR LA PERFORMANCEZINEB67% (3)
- Thomas-Antérion - Le Bilan Neuropsychologique, Comment Le LireDocument12 pagesThomas-Antérion - Le Bilan Neuropsychologique, Comment Le LireEccoPas encore d'évaluation
- Cour de Chimie en SolutionDocument20 pagesCour de Chimie en SolutionIhsan Mokhlisse100% (28)
- Acide Base PDFDocument26 pagesAcide Base PDFFoudil Laouici100% (1)
- Guide Des Ascendances Des Prédictions PerduesDocument146 pagesGuide Des Ascendances Des Prédictions Perduesjean-luc LopezPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- La Mise en Oeuvre Du ContratDocument32 pagesLa Mise en Oeuvre Du ContratKaoutar NachPas encore d'évaluation
- Equilibres Acido-BasiquesDocument43 pagesEquilibres Acido-Basiquesattentatalabombe100% (5)
- Cours Acide BaseDocument14 pagesCours Acide BaseAli AllamPas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- Chsol - Chapitre IiDocument28 pagesChsol - Chapitre IielkhiatmohammedaminePas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Cours de Chimie Des Solutions Chapitre 2 Acides Et BasesDocument58 pagesCours de Chimie Des Solutions Chapitre 2 Acides Et Basesmeriemg912Pas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- COURS Acide Base PDFDocument18 pagesCOURS Acide Base PDFYasmina BenPas encore d'évaluation
- Chapitre I Partie 1Document8 pagesChapitre I Partie 1Amna TahriPas encore d'évaluation
- 2 - Les Acides Et Les BasesDocument21 pages2 - Les Acides Et Les BasesAmine CompanPas encore d'évaluation
- AcibaseDocument35 pagesAcibaseAbdessamad EttariqiPas encore d'évaluation
- Equilibres Acido-BasiqueDocument43 pagesEquilibres Acido-BasiqueRiani YosriPas encore d'évaluation
- Solutionaqueusechap 2Document6 pagesSolutionaqueusechap 2Kawthar MokhtarPas encore d'évaluation
- Chimie Des Solutions Résumé 04Document23 pagesChimie Des Solutions Résumé 04Jordan PeterPas encore d'évaluation
- Chimie en SolutionDocument54 pagesChimie en SolutionFRANCK ARMAND JOSIAS BONKOUNGOU WENDBENEDOPas encore d'évaluation
- TP Force D'un Couple Acide-BaseDocument8 pagesTP Force D'un Couple Acide-BaseKhalil OukebdanePas encore d'évaluation
- Acides Faibles Bases FaiblesDocument7 pagesAcides Faibles Bases FaiblesBouaouiche KarimPas encore d'évaluation
- FTSCresume Acide BaseDocument3 pagesFTSCresume Acide BaseWerfelli YassinePas encore d'évaluation
- Chapitre 6 Acides-BasesDocument50 pagesChapitre 6 Acides-BasesMo DicPas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- 3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023Document6 pages3 Acides Et Bases en Solution Aqueuse - 1GCV - LOKO 2022-2023Said Said AkandjiPas encore d'évaluation
- Chapitre I: Equilibres Acido-Basiques en Solutions AqueusesDocument9 pagesChapitre I: Equilibres Acido-Basiques en Solutions AqueusesWisdom KouPas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Chapitre Un CDocument13 pagesChapitre Un CDaboPas encore d'évaluation
- Abdel GhaniDocument36 pagesAbdel Ghanicerveaumental80Pas encore d'évaluation
- SMPC s2 CHP 2Document31 pagesSMPC s2 CHP 2Abdelhakim BailalPas encore d'évaluation
- Equilibre Acido-Basique 2019Document44 pagesEquilibre Acido-Basique 2019Théophile NAMOINEPas encore d'évaluation
- C02 - Équilibres Acido-Basiques - EleveDocument5 pagesC02 - Équilibres Acido-Basiques - EleveElPas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Equilibre Acido-BasiqueDocument44 pagesEquilibre Acido-BasiqueKhaoula OthmaniPas encore d'évaluation
- Rappels Chimie Des SolutionsDocument24 pagesRappels Chimie Des SolutionsDavid KientegaPas encore d'évaluation
- Force Des Acides Et BasesDocument4 pagesForce Des Acides Et Basestjmhfkdkd5Pas encore d'évaluation
- Chapitre IIDocument28 pagesChapitre IIchaima sagiPas encore d'évaluation
- Chapitre Chimie st2sDocument6 pagesChapitre Chimie st2snabil douadiPas encore d'évaluation
- Chimie Analytique Acides BasesDocument19 pagesChimie Analytique Acides Basesawara237Pas encore d'évaluation
- Chap I Acide BaseDocument81 pagesChap I Acide BaseyoussefPas encore d'évaluation
- Chimie en SolutionDocument166 pagesChimie en Solutionjawad izallalenPas encore d'évaluation
- Equilibres en Solutions AcqueusesDocument58 pagesEquilibres en Solutions AcqueusesGadede Martine ESSANPas encore d'évaluation
- Chap.I Chimie Analytique II - 2021-2022Document17 pagesChap.I Chimie Analytique II - 2021-2022Mira MslPas encore d'évaluation
- Thermodynamique Des Equilibres Chimiques Dans Les Solution AqueusesDocument85 pagesThermodynamique Des Equilibres Chimiques Dans Les Solution AqueusesFatima BenPas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- Les Acides Et Les BasesDocument3 pagesLes Acides Et Les BasesRemy HebertPas encore d'évaluation
- Chimir PHDocument16 pagesChimir PHImane KaPas encore d'évaluation
- Faculté Pluridisciplinaire de Nador SVIDocument4 pagesFaculté Pluridisciplinaire de Nador SVIZakaria AsbaiPas encore d'évaluation
- Traité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresD'EverandTraité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresPas encore d'évaluation
- Rapport de Sensibilisation - DéfinitifDocument51 pagesRapport de Sensibilisation - DéfinitifLova AndriamanampisoaPas encore d'évaluation
- Internet Du Futur Horizon 2030Document12 pagesInternet Du Futur Horizon 2030barthelemyelyPas encore d'évaluation
- TP MDF Mesure de DébitDocument7 pagesTP MDF Mesure de DébitMôùràd DôùàsPas encore d'évaluation
- Seance A P Exercice Perspective 1Document5 pagesSeance A P Exercice Perspective 1emiliefolcquePas encore d'évaluation
- Agit Syst DiphasDocument19 pagesAgit Syst Diphasthibaud.rosinPas encore d'évaluation
- واقع السكن في الجزائر - السكن الكولونيالي الفردي نموذجا -دراسة ميدانية ببلدية الذرعان - ولاية الطارفDocument21 pagesواقع السكن في الجزائر - السكن الكولونيالي الفردي نموذجا -دراسة ميدانية ببلدية الذرعان - ولاية الطارفNour MhiriPas encore d'évaluation
- Cours 3 en 1 Gec1Document112 pagesCours 3 en 1 Gec1SiluePas encore d'évaluation
- Logique Serie SM FRDocument2 pagesLogique Serie SM FRFFFFFFFFFFFFFFFFFFFFFE100% (1)
- Mathematics FrenchDocument78 pagesMathematics FrenchEirini MelianouPas encore d'évaluation
- Psy4190 - Notes de CoursDocument39 pagesPsy4190 - Notes de CoursMissaoui LamiaaPas encore d'évaluation
- Activité MsculaireDocument7 pagesActivité MsculaireameniPas encore d'évaluation
- TD MasterDocument13 pagesTD MasterabdellahmorPas encore d'évaluation
- HistoplasmosesDocument6 pagesHistoplasmosesfifi fifiPas encore d'évaluation
- KALED TALBI FRDocument9 pagesKALED TALBI FRcisar0007Pas encore d'évaluation
- Exposé 01 Elaboration Des Programmes Selon l'APC FFDocument66 pagesExposé 01 Elaboration Des Programmes Selon l'APC FFEbou Mo7amedPas encore d'évaluation
- Entretien 3 Avec Gitta - Cahier de L e TudiantDocument16 pagesEntretien 3 Avec Gitta - Cahier de L e TudiantMaëlle Courty100% (1)
- Travaux Dirigeees de Materiaux Composites1Document6 pagesTravaux Dirigeees de Materiaux Composites1Francis Sonkeng100% (1)
- CV Mohamed Karimi Charte EntrepriseDocument5 pagesCV Mohamed Karimi Charte EntreprisemayssaePas encore d'évaluation
- AnalyseDocument19 pagesAnalyseMehdi KallaPas encore d'évaluation
- A Propos de La PsychopedagogieDocument12 pagesA Propos de La PsychopedagogieChristian BisimwaPas encore d'évaluation
- Systématisation Du TCDocument48 pagesSystématisation Du TCAmina Hasnaoui100% (1)
- Formules Trigonometriques 1 4Document1 pageFormules Trigonometriques 1 4ahmed tounsiPas encore d'évaluation
- Cours RDM 2023Document138 pagesCours RDM 2023Chancelle Aurélie ZangaPas encore d'évaluation
- Le Champ Magnetique Cree Par Un Courant Electrique Cours 1 2Document4 pagesLe Champ Magnetique Cree Par Un Courant Electrique Cours 1 2Mohsine LazreqPas encore d'évaluation
- ORAUX HEC - QQ Sujets Et QuestionsDocument3 pagesORAUX HEC - QQ Sujets Et QuestionsNisma BounkitPas encore d'évaluation
- k4121c - EnglishDocument4 pagesk4121c - Englishfta123Pas encore d'évaluation