Académique Documents
Professionnel Documents
Culture Documents
TP 3 ST
Transféré par
ABDelpari SeraicheCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TP 3 ST
Transféré par
ABDelpari SeraicheDroits d'auteur :
Formats disponibles
TP de Chimie 1
1er Année LMD (ST) TP N°3: Dosage acido –basique
Manipulation N°3
Titrages acido –basiques
Dosage colorimétrique d’un acide fort par une base forte
_________________________________________________________________
Dosage d’un acide fort par une base forte :
Avant toute manipulation consulter les pictogrammes et les consignes de sécurité de chaque produit
chimique en discuter avec le professeur afin de prendre toutes les mesures de protection.
1- Introduction :
Dans la vie courante, nous utilisons régulièrement des solutions acides ou basiques : détartrant,
vinaigre, jus de citron, ammoniaque, soude, etc.
Un acide est fort si sa réaction avec l'eau peut être considérée comme totale et qu'il ne subsiste alors
en solution que sa base conjuguée.
La réaction de cet acide fort AH s'écrit alors de la manière suivante :
AH + H2O → A- + H3O+
2- Définitions :
2-1. Définition d’un acide et d’une base :
- Un acide est une substance qui dissocie dans l’eau sous forme d’ion H+ (Définition d’Arrhénius).
- Un acide est un donneur de protons (Définition de Broenstedt) : HCl + H2O → H3O+ + Cl-
- Une base est une substance qui dissocie dans l’eau sous forme d’ions OH- (Définition d’Arrhénius).
- Une base est un accepteur de protons (Définition de Broenstedt) : NaOH → Na+ + OH-
2-2. La force des acides et des bases :
Un acide fort est un acide qui se dissocie complètement en ions positifs et négatifs, comme l’acide
chlorhydrique (HCl). Une base forte se dissocie complètement en ions positifs et négatifs, comme
hydroxyde de sodium (NaOH).
Par contre la plupart des acides et des bases se dissocient très peu en solution aqueuse. Prenons par
exemple l’acide acétique (CH3COOH) qui n’a qu’une partie de ses ions (1.3%) qui se dissocient dans l’eau.
Il est considéré comme un acide faible. Le même phénomène se produit avec l’ammoniaque (NH3) qui
dissocie en deux parties NH4+ et OH-. La majeure partie de ses molécules ne réagissent pas. L’ammoniaque
est considérée comme une base faible.
2-3. Principe et les différents types de dosages (titrage) :
Le but de tout dosage est de déterminer la concentration inconnue ( via la quantité de matière ) d'une
espèce ( titrée ) à l'aide d'une autre espèce (titrante) de concentration connue. Le point d'équivalence
entre les quantités de matières présentes et celles introduites permet après quelques calculs la
détermination de la concentration de l'espèce recherchée. Plusieurs méthodes sont possibles afin de
1
Page
Dr. MAKHLOUFI EL HANI 2022/2023
TP de Chimie 1
1er Année LMD (ST) TP N°3: Dosage acido –basique
déterminer ce point d'équivalence : l'introduction d'un indicateur coloré, la valeur du pH, la valeur de la
conductance de la solution.
a- Dosages par étalonnage : Le dosage par étalonnage repose sur l’utilisation de solutions (appelées
solutions étalons) qui contiennent l’espèce chimique à doser à différentes concentrations connues.
Elles sont préparées par dilution à partir d’une solution mère de concentration connue.
La concentration de l’espèce chimique à doser influe sur une grandeur physique mesurable comme la
masse volumique, l’indice optique, etc.
On compare ensuite la grandeur physique mesurée pour l’échantillon à celles des solutions étalons
afin de déterminer la concentration de l’échantillon.
b- Dosage colorimétrique : Un dosage colorimétrique est aussi envisageable en utilisant des indicateurs
colorés tels que l'hélianthine, la phénol phtaléine, le vert de bromocrésol etc. qui vont se colorer à
pH différents et par conséquent, vont pouvoir indiquer lorsque on atteint l'équivalence.
c- Dosage pH-métrique : Un titrage pH-métrique consiste à suivre l’évolution du pH de la solution
titrée au cours de l’ajout de la solution titrante, La réaction support du titrage est une réaction
acido-basique entre un couple titrant et un couple titré.
La courbe de titrage pH-métrique est la courbe pH = f(VSol. Titrante versée) donnant les variations du
pH en fonction du volume de solution titrante versée.
d- Dosage conductimétrique : Le titrage conductimétrique est une méthode qui consiste à suivre
l’évolution de la conductivité σ d’une solution lorsqu’on y ajoute, petit à petit, une solution titrante. Il
se produit une réaction entre les espèces titrée et titrante : des ions peuvent apparaître, disparaître,
ce qui modifie la conductivité de la solution.
Avant l’équivalence, la conductivité varie de façon affine en fonction du volume versé, et après
l’équivalence, la courbe reste une droite mais la pente est différente. Le changement de pente permet
de déterminer le volume à l'équivalence VE.
2-4. Dosage acido-basique :
Doser une solution aqueuse d’un acide ou d’une base, c’est déterminer sa concentration en réalisant une
réaction acide-base.
A l’équivalence le nombre de moles H3O+ apportées par l’acide doit être égal au nombre de moles OH-
apportées par la base. Cela entraîne :
CA.VA = CB.VB
On désigne par : - CA : la concentration molaire de l’acide, par VA le volume de l’acide.
- CB : la concentration molaire de la base, par VB le volume de la base.
Un dosage acido-basique peut-être suivi par :
▪ pH-mètre : on suit l’évolution du pH au cours de la réaction.
▪ Colorimétrie : on utilise un indicateur coloré.
2
Page
Dr. MAKHLOUFI EL HANI 2022/2023
TP de Chimie 1
1er Année LMD (ST) TP N°3: Dosage acido –basique
2-5. Indicateur coloré :
Un indicateur coloré est un réactif dont la couleur dépend du pH. Il peut être utilisé pour repérer la
fin d’un dosage si l’équivalence est atteinte dans sa zone de virage.
Les indicateurs acido-basiques (connus aussi comme les indicateurs de pH) sont des substances qui
changent de couleur avec le pH. Ce sont généralement des acides faibles qui se dissocient légèrement dans
l'eau en donnant des ions. Ces couples acide-base sont caractérisés par une valeur dite pKa.
La forme acide et sa base conjuguée ont des couleurs différentes. La solution prendra la couleur de la
forme qui prédomine déterminée par le pH de la solution :
- si pH < pKa la solution prend la couleur A de la forme acide
- si pH > pKa la solution prend la couleur B de la forme basique
- si pH = pKa alors on a un mélange des 2 couleurs A et B , c'est la zone de virage de l'indicateur. On
considère en général une zone de une à deux unités de pH.
Exemples d’indicateurs colorés :
Interval de pH
Indicateur Couleur acide Couleur basique pKa
Zone de virage
Bleu de Thymol Rouge Jaune 1,2 - 2,8 1.5
Rouge de Méthyle Jaune Rouge 4,6 - 6,0 5.1
Bleu de bromothymol Jaune Bleu 6,0 - 7,6 7.0
Rouge de Phénol Jaune Rouge 6,8 – 8,4 7.9
Phénolphtaléine Incolore Rose 8,2 - 10,0 9.4
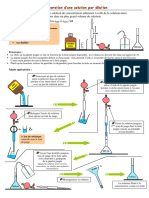
3- Partie Expérimentale :
• Dosage colorimétrique de l’acide chlorhydrique par la soude
Matériel : Burette, Erlenmeyer, bécher, éprouvette, pissette, solution de NaOH (0.1N), solution d’HCL
et les indicateurs colorés
Dosage en présente de phénophtaléine :
1- Rincer le matériel. Burette, erlenmeyer ...etc.
2- Remplir la burette avec la solution de (NaOH) (CB=0.1N) jusqu'à la graduation zéro.
3- Prendre (VA=10 ml) de la solution à doser (HCl) et verser la dans un erlenmeyer de 100 mL.
4- Ajouter 2 à 3 gouttes d'indicateur coloré (phénolphtaléine).
5- Poser l’erlenmeyer sur une feuille blanche au-dessous de la burette.
6- Réaliser un dosage rapide pour estimer le volume d'équivalence.
7- Noter le volume VB de (NaOH) versé.
8- En présence d’un papier pH, lire le pH de la solution chaque 2ml jusqu'à coloration.
3
Page
Dr. MAKHLOUFI EL HANI 2022/2023
TP de Chimie 1
1er Année LMD (ST) TP N°3: Dosage acido –basique
4- Résultats et calculs:
1- Quel est le but du TP.
2- Ecrire l'équation de la réaction.
3- Calculer la Concentration (CA) et la Normalité (NA) de la solution d’HCl.
4- Remplier le tableau ci-dessous :
VB mL 0 2 4 6 8 10 12 14 16 18
pH
5- Tracer le graphe représentant la valeur du pH= f(VB) sur papier millimétré.
6- Déterminer le volume VE et le pH à l’équivalence en utilisant le graphique.
7- Que signifier pour vous une zone virage.
4
Page
Dr. MAKHLOUFI EL HANI 2022/2023
Vous aimerez peut-être aussi
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- TP-PH-métrie ElectrochimieDocument14 pagesTP-PH-métrie ElectrochimieAya DgmPas encore d'évaluation
- TP Dosage PH MétriqueDocument2 pagesTP Dosage PH MétriqueAbidine CHAHIR100% (2)
- TP ch4 Titrage PhmetriqueDocument2 pagesTP ch4 Titrage PhmetriquebounegabPas encore d'évaluation
- Thermo-1 DjaberDocument6 pagesThermo-1 DjaberSara BenPas encore d'évaluation
- TP2 Chimie MineralDocument7 pagesTP2 Chimie MineralNà ZimPas encore d'évaluation
- TP ThermoDocument7 pagesTP Thermosofia safaaPas encore d'évaluation
- P2016 CM11 TP FasciculeDocument44 pagesP2016 CM11 TP FasciculeRochdi BAATIPas encore d'évaluation
- IntroductionDocument12 pagesIntroductionselmi nourelhoudaPas encore d'évaluation
- Dosage Volumétrique Par Précipitation: 1) Principe 1.1Document1 pageDosage Volumétrique Par Précipitation: 1) Principe 1.1don yen100% (2)
- TP Cinetique Et CatalyseDocument9 pagesTP Cinetique Et CatalyseGrairiPas encore d'évaluation
- Chap III IV Et V l3 CADocument17 pagesChap III IV Et V l3 CAFatouma ShPas encore d'évaluation
- MANGANIMÉTRIEDocument2 pagesMANGANIMÉTRIEDiallo100% (1)
- COMPTE RENDU DE CHIMIE MINERALE 2 2023 FinalDocument5 pagesCOMPTE RENDU DE CHIMIE MINERALE 2 2023 FinalMeryem Bouh0% (1)
- Examen de TP Dosage de H3PO4 Par NaOH 5Document3 pagesExamen de TP Dosage de H3PO4 Par NaOH 5KHALIFA EL HARFIPas encore d'évaluation
- TP2 PH Métrie 2022-2023Document6 pagesTP2 PH Métrie 2022-2023abderrahmane lalaouiPas encore d'évaluation
- Solution TP2-TITRAGE-D - UNE-BASE-FORTE-PAR-UN-ACIDE-FORT-univ-annabaDocument8 pagesSolution TP2-TITRAGE-D - UNE-BASE-FORTE-PAR-UN-ACIDE-FORT-univ-annabaKhalil Oukebdane100% (1)
- Chimie B Chap8 Titrage AcidobasiqueDocument6 pagesChimie B Chap8 Titrage AcidobasiqueSamantha Farah100% (1)
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- VolumetrieDocument9 pagesVolumetriebounegabPas encore d'évaluation
- TP 4 Titrage Oxydo-Redox PDFDocument4 pagesTP 4 Titrage Oxydo-Redox PDFleilalargate_3780929Pas encore d'évaluation
- TP Chimie Analytique Et Instrumentale Manip1 FinalDocument16 pagesTP Chimie Analytique Et Instrumentale Manip1 FinalHamed AbbassiPas encore d'évaluation
- Exsm14 02rDocument1 pageExsm14 02rbadre50% (2)
- Ch06 SolutionsDocument46 pagesCh06 SolutionsMateus SantosPas encore d'évaluation
- C13 - Correction D'exercicesDocument5 pagesC13 - Correction D'exercicesSans SnoqPas encore d'évaluation
- Compte Rendu 1Document11 pagesCompte Rendu 1hadil100% (1)
- TP L2 2022 BouraadaDocument9 pagesTP L2 2022 BouraadaHanae HanaPas encore d'évaluation
- Mode Op DilutionDocument1 pageMode Op DilutionValère Richu Fokou Tchemebe100% (1)
- Reactions PrecipitationDocument3 pagesReactions PrecipitationRitaj-Rayane KarimPas encore d'évaluation
- TPChi10 Corrige 1S1Document3 pagesTPChi10 Corrige 1S1henryPas encore d'évaluation
- TP Catalyse Par Transfert de Phase PDFDocument12 pagesTP Catalyse Par Transfert de Phase PDFFifiMisaPas encore d'évaluation
- TP 1Document2 pagesTP 1Aya BoucharebPas encore d'évaluation
- Détermination de La Dureté de L'Eau: TPN 22 - Solutions Aqueuses 4Document7 pagesDétermination de La Dureté de L'Eau: TPN 22 - Solutions Aqueuses 4Nelly RakotoPas encore d'évaluation
- TP Chimie 1Document24 pagesTP Chimie 1saidi chaouki100% (2)
- 6-Suivi Cinétique Par Titrage-A Préparatoire Du TP Christine 2007Document3 pages6-Suivi Cinétique Par Titrage-A Préparatoire Du TP Christine 2007Daniela DinicaPas encore d'évaluation
- 1059 TP Doser Par ConductimetrieDocument3 pages1059 TP Doser Par ConductimetrieAli TrikiPas encore d'évaluation
- TP PH Metre ATHIR - New1Document8 pagesTP PH Metre ATHIR - New1samibenhabilePas encore d'évaluation
- Chapitre IIIDocument11 pagesChapitre IIIHåmēd Bën MåkhtārįPas encore d'évaluation
- Thermodynamique TP n2 Solution Diluees CryometriesDocument11 pagesThermodynamique TP n2 Solution Diluees CryometriesKIAS DjahidPas encore d'évaluation
- TP Conductimetrie PDFDocument13 pagesTP Conductimetrie PDFHajar AMENAOUPas encore d'évaluation
- BUT DE TP Determination de Lordre Dune RDocument7 pagesBUT DE TP Determination de Lordre Dune RÃßdø SãñføürPas encore d'évaluation
- Travaux Pratiques Coordinance S6Document21 pagesTravaux Pratiques Coordinance S6Mohamed TaouilPas encore d'évaluation
- Tp4: Modeles Moleculaires: ObjectifsDocument2 pagesTp4: Modeles Moleculaires: Objectifssoufiane souf100% (1)
- Examen Smc3 - 2016-17 Rattrapage CorrigeDocument4 pagesExamen Smc3 - 2016-17 Rattrapage Corrigeayyoub dhbPas encore d'évaluation
- 07.dosages Acide BaseDocument6 pages07.dosages Acide BaseCedric BabokaPas encore d'évaluation
- CHM224 2022 2023Document102 pagesCHM224 2022 2023Franel YolandaPas encore d'évaluation
- Fiche Technique - TS - La RecristallisationDocument1 pageFiche Technique - TS - La RecristallisationBlm RfkPas encore d'évaluation
- Thermodynamique Des Solutions Master Chapitre2Document41 pagesThermodynamique Des Solutions Master Chapitre2Abde Tam100% (2)
- TP3 Titrage Argentimétrique 2022-2023Document5 pagesTP3 Titrage Argentimétrique 2022-2023abderrahmane lalaouiPas encore d'évaluation
- TP 1 Preparation Solution 2020 2021 1Document6 pagesTP 1 Preparation Solution 2020 2021 1BillarjohnPas encore d'évaluation
- 4 Substitution Nucleophile 1 PDFDocument10 pages4 Substitution Nucleophile 1 PDFgregoire korgaPas encore d'évaluation
- ch13 Separation Extraction BenzocaineDocument3 pagesch13 Separation Extraction Benzocaineالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2005-Afrique-Dosage-Precipitation Mohr Chrapentier CDocument3 pages2005-Afrique-Dosage-Precipitation Mohr Chrapentier CzakavPas encore d'évaluation
- 2014 Liban Spe Exo3 Correction TensioactifsDocument2 pages2014 Liban Spe Exo3 Correction TensioactifsOussama El BouadiPas encore d'évaluation
- TP1 Chimie 2 (2022-2023)Document3 pagesTP1 Chimie 2 (2022-2023)Native Emerick Kokea TielaPas encore d'évaluation
- Mangani M Ét RieDocument5 pagesMangani M Ét RieVictoria BuciuceanuPas encore d'évaluation
- TP Spe Chimie TP 3 Synthese Acide Benzoique Eleve PDFDocument6 pagesTP Spe Chimie TP 3 Synthese Acide Benzoique Eleve PDFMasterPas encore d'évaluation
- TITRAGEDocument3 pagesTITRAGETahar YahiaouiPas encore d'évaluation
- TP 3 Chimie 1Document4 pagesTP 3 Chimie 1Marouane Taibini100% (2)
- ChimEq - Syllabus TP - 2023-2024Document26 pagesChimEq - Syllabus TP - 2023-2024juanlognoulPas encore d'évaluation
- EXERCICES - 11,12 Et 13Document2 pagesEXERCICES - 11,12 Et 13ABDelpari SeraichePas encore d'évaluation
- IntroductionDocument25 pagesIntroductionABDelpari SeraichePas encore d'évaluation
- CH II CinématiqueDocument17 pagesCH II CinématiqueABDelpari SeraichePas encore d'évaluation
- TD02Document7 pagesTD02ABDelpari SeraichePas encore d'évaluation
- Série N 03Document2 pagesSérie N 03ABDelpari SeraichePas encore d'évaluation
- Exercice 01: (Fig.01)Document3 pagesExercice 01: (Fig.01)ABDelpari SeraichePas encore d'évaluation
- TP 4 STDocument3 pagesTP 4 STABDelpari SeraichePas encore d'évaluation
- TP 5 STDocument2 pagesTP 5 STABDelpari SeraichePas encore d'évaluation
- Chimie SuiteDocument29 pagesChimie SuiteProost N'guessanPas encore d'évaluation
- Programmes Ex AdmissionDocument43 pagesProgrammes Ex AdmissionAribPas encore d'évaluation
- 6 AlcoolDocument51 pages6 AlcoolgaPas encore d'évaluation
- PDF Télécharger Cours de Physique Terminale D Gratuit PDFDocument1 pagePDF Télécharger Cours de Physique Terminale D Gratuit PDFAlidou Badini100% (1)
- AcidimetrieDocument6 pagesAcidimetriesumaleePas encore d'évaluation
- Corrige Du Concours de Medecine 2022 Epreuve de Chimie CorrectionDocument12 pagesCorrige Du Concours de Medecine 2022 Epreuve de Chimie CorrectionHafidi AhmedPas encore d'évaluation
- Acide 2 Calculs de PH 2Document11 pagesAcide 2 Calculs de PH 2ezezaeaPas encore d'évaluation
- 6 Exercices Réactions Acido-Basique 1Document1 page6 Exercices Réactions Acido-Basique 1RIDA SAMIPas encore d'évaluation
- CH Gene Cours Chimie en SolutionDocument41 pagesCH Gene Cours Chimie en SolutionAlhassane BahPas encore d'évaluation
- Transformations Acide - Base Eleve NDocument2 pagesTransformations Acide - Base Eleve Nblack HPas encore d'évaluation
- Corrigé de La Série N°2 - Équilibres Acido-BasiquesDocument7 pagesCorrigé de La Série N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Yyy Suppexos cm4 cm5 Chimie Acides Bases PDFDocument16 pagesYyy Suppexos cm4 cm5 Chimie Acides Bases PDFKurosaki AimarPas encore d'évaluation
- TD Réactions Acido-Basiques: L Mol HCO CDocument3 pagesTD Réactions Acido-Basiques: L Mol HCO ChassouiooPas encore d'évaluation
- TP 3 STDocument4 pagesTP 3 STABDelpari SeraichePas encore d'évaluation
- Reactions de ComplexationDocument2 pagesReactions de ComplexationVghjhPas encore d'évaluation
- Cours Chimie 20102011Document83 pagesCours Chimie 20102011Mohcine RickyPas encore d'évaluation
- Equilibre Chimique Travaux DirigesDocument12 pagesEquilibre Chimique Travaux DirigesLouis Lacaud-barbeauPas encore d'évaluation
- Cours Chim 7Document2 pagesCours Chim 7Yasmina BenPas encore d'évaluation
- TP de Chimie Important EvisualDocument72 pagesTP de Chimie Important EvisualLarbii Badrour100% (5)
- Sujet 1Document4 pagesSujet 1MbodjPas encore d'évaluation
- Cours Chimie Analytique 2 AnnéeDocument4 pagesCours Chimie Analytique 2 AnnéeMeryem ZouarhiPas encore d'évaluation
- Chapitre-5-Les Transformations Liées Par Des Réactions Acido-Basique - DosageDocument13 pagesChapitre-5-Les Transformations Liées Par Des Réactions Acido-Basique - Dosagea houssPas encore d'évaluation
- Serie Devoir 5 DomestiqueDocument2 pagesSerie Devoir 5 DomestiqueToki MimiPas encore d'évaluation
- Equilibres en Solutions Aqueuses PC PDFDocument20 pagesEquilibres en Solutions Aqueuses PC PDFAhmed fattoumPas encore d'évaluation
- CHM 112 - Chimie Des Solutions (2020)Document27 pagesCHM 112 - Chimie Des Solutions (2020)Berthe Aristide Ngue NkongoPas encore d'évaluation
- Chimie: - Chimie en Solution AqueuseDocument35 pagesChimie: - Chimie en Solution AqueuseAyoub Maverick100% (1)
- Corre-Exo-Ch1 3Document28 pagesCorre-Exo-Ch1 3Jihen Ben SlimaPas encore d'évaluation
- Corrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1Document7 pagesCorrige - Examen de Chimie Des Solutions (SMPC - s2) Session Normale-1charki zakariaPas encore d'évaluation
- Polycopie TP Chimie ST Semestre 1 2021 2022Document36 pagesPolycopie TP Chimie ST Semestre 1 2021 2022Lotfi KhPas encore d'évaluation
- TD1 Acide BaseDocument3 pagesTD1 Acide BaseAnass Badre-EddinePas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation