Académique Documents
Professionnel Documents
Culture Documents
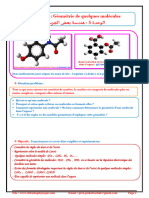
PC1 Chimie Introduction Essentiel
Transféré par
MAX YTBTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
PC1 Chimie Introduction Essentiel
Transféré par
MAX YTBDroits d'auteur :
Formats disponibles
Thème : Images & vision PC1 : Introduction à la chimie
I – Chimique ou naturelle (Extractions, synthèses)
II – STABILITÉ DES ELÉMENTS CHIMIQUES.
Les éléments chimiques sont classés par
tableau de Mendeleïev tableau actuel
ligne
colonne
La chimie se déroule donc
Les gaz nobles de la colonne 8 sont
D’où les règles de stabilité :
Pour augmenter leur stabilité chimique, les éléments cherchent à acquérir la même structure
électronique que le gaz noble le plus proche. (la famille de la VIIIéme colonne)
Règle du duet : .
Règle de l'octet :
Qui expliquent comment sont constitués les ions monoatomiques :
Un ion est un atome qui a perdu ou gagné un ou plusieurs électrons en suivant les règles de stabilité.
Exemples :
Liaison ionique : composés ioniques
III – Qui expliquent comment se constituent les molécules :
Molécules :
De plus les électrons se regroupent par deux ( ) sur la couche externe (une histoire de
spin !)
1°) Représentation de Lewis :
Dans une molécule, les atomes sont liés par des liaisons qui correspondent à la mise en commun de deux
électrons : on parle de doublets liants.
Les électrons externes qui ne participent pas aux liaisons se regroupent par deux pour former des doublets
non-liants autour de l'atome.
H C N O Cl
structure électronique K1 K L42
K2 L5 K2 L6 K L8 M7
2
| _ _ _
représentation
C N O |Cl
de Lewis H
| | ‾ ‾
Exemples : au dos
Déf : Formule brute :
Formule développée :
Formules semi-développée :
L’essentiel Page 1/2
Représentation topologique (chimie organique) :
2°) Géométrie des molécules :
Exemple : méthane CH4 représentation de Cram :
liaison dans le plan géométrie tétraédrique
de la feuille
liaison en arrière
liaison en avant
Représentation de Cram :
- l'atome formant le plus de liaison est placé au centre,
- les doublets d'électrons s'éloignent au maximum les uns des autres car
Autres exemples :
ammoniac NH3 eau H2O
géométrie géométrie plane
pyramidale coudée
Compléter le tableau avec les formules développées :
phosgène : COCl2 acide formique : CH2O2
Cl - C - Cl
װ H - C - OH
װ
O O
C2H7N : 2 isomères urée : CH4ON2 O
CH3 - NH - CH3 CH3 - CH2 - NH2 H2N - C - NH2
װ
acétone : C3H6O O acide acétique : C2H4O2
CH3 - CO - CH3 CH3 - C - OH
ou CH3 - C H2 - C - H װ
O
װ
IV – Nomenclature en chimie organique
Meth. : 1 Carbone, Eth. : 2 C, Prop. : 3 C, But. : 4 C, Pent. : 5 C, Hex. : 6 C, Hept. : 7 C, oct. : 8 C…
Alcanes ramifiés : CnH2n+2, Alcènes : CnH2n , groupe (gr.) Alkyle : − CnH2n+1 ,
gr. Hydroxyle : − OH, gr. Carboxyle : − COOH, gr. Carbonyle : − CO − …
Les carbones sont numérotés sur la chaine la plus longue pour positionner les groupes fonctionnels
Guides : nomen1, nomen2, nomen3
Faire le QCM en nommant les molécules non nommées dans le QCM
Faire apprendre à résoudre et le l’exercice 10 de exo2
Equations chimiques : faire les exercices 11, 12 et 13
L’essentiel Page 2/2
Vous aimerez peut-être aussi
- Nomeclature Des Composés OrganiquesDocument32 pagesNomeclature Des Composés OrganiquesmehdiPas encore d'évaluation
- Introduction à la physique de la matièreD'EverandIntroduction à la physique de la matièreÉvaluation : 3 sur 5 étoiles3/5 (1)
- Chimie OrganiqueDocument37 pagesChimie Organiquemehdi100% (1)
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chimie OrganiqueDocument29 pagesChimie OrganiqueRubyPas encore d'évaluation
- Isom Rie Et ST R Oisom Rie FC PCDocument64 pagesIsom Rie Et ST R Oisom Rie FC PCMohamed Ben talebPas encore d'évaluation
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésD'EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésÉvaluation : 4.5 sur 5 étoiles4.5/5 (4)
- Correction Devoir de ChimieDocument3 pagesCorrection Devoir de ChimieLéa ClastresPas encore d'évaluation
- 3 ActiviteCHONDocument3 pages3 ActiviteCHONMustafa HuyukPas encore d'évaluation
- La Geometrie de Quelques Molecules Exercices Non Corriges 3Document3 pagesLa Geometrie de Quelques Molecules Exercices Non Corriges 3maryam.zagririPas encore d'évaluation
- Complement de Cours Chapitre 1. Nomenclature PDFDocument17 pagesComplement de Cours Chapitre 1. Nomenclature PDFMorel TegangPas encore d'évaluation
- ds5 CorrigeDocument16 pagesds5 Corrigeakissiyapi555Pas encore d'évaluation
- Cours de Chimie OrganiqueDocument75 pagesCours de Chimie OrganiqueMohamadsfPas encore d'évaluation
- 1ère CD - APC - Quelques Composés OxygénésDocument5 pages1ère CD - APC - Quelques Composés OxygénésLAWSON NICOLASPas encore d'évaluation
- Aldéhydes CétonesDocument56 pagesAldéhydes CétonesRoi AroufPas encore d'évaluation
- Cours de Chimie Organique VetoDocument12 pagesCours de Chimie Organique VetoZãkï ZäkīPas encore d'évaluation
- Chimie1an31 OrganiqueDocument153 pagesChimie1an31 Organiquejack rousouPas encore d'évaluation
- HydcarburesDocument11 pagesHydcarburesHOUSSEINPas encore d'évaluation
- Chapitre 18 Structure Des Mol Cules OrganiquesDocument12 pagesChapitre 18 Structure Des Mol Cules Organiqueszabsi533Pas encore d'évaluation
- 4454863Document160 pages4454863AbdelOuahidSenhadjiPas encore d'évaluation
- Quelques Composés OxygénésDocument6 pagesQuelques Composés OxygénésXray34Pas encore d'évaluation
- Alcenes Et AlcynesDocument8 pagesAlcenes Et AlcynesMohamed Aly SawadogoPas encore d'évaluation
- AlcynesDocument11 pagesAlcynesAssan Sanogo100% (1)
- Carbures Insaturés - Cours - Copier PDFDocument9 pagesCarbures Insaturés - Cours - Copier PDFSawadogoPas encore d'évaluation
- PC 1ère CD-C6 Quelques Composés Oxygénés PDFDocument11 pagesPC 1ère CD-C6 Quelques Composés Oxygénés PDFZanaple CoulibalyPas encore d'évaluation
- Chapitre 5, Géométrie de Quelques Molã©cules, Activités, Exercices D'application, TCS BIOF, PR JENKAL RACHIDDocument3 pagesChapitre 5, Géométrie de Quelques Molã©cules, Activités, Exercices D'application, TCS BIOF, PR JENKAL RACHIDzakariaouaoua38Pas encore d'évaluation
- Alcene Et Alcyne PDFDocument11 pagesAlcene Et Alcyne PDFTraoré Mamadou Tâ100% (1)
- Cours de Sciences Physiques 4ADocument71 pagesCours de Sciences Physiques 4AAdrien JulienPas encore d'évaluation
- Chapitre VII Les Hydrocarbures Saturés & InsaturésDocument13 pagesChapitre VII Les Hydrocarbures Saturés & Insaturésmadomano1971Pas encore d'évaluation
- Chimie Organique Générale Cours 03 Universite Ibn Tofail KenitraDocument69 pagesChimie Organique Générale Cours 03 Universite Ibn Tofail KenitraJamal KOUBACHIPas encore d'évaluation
- Chapitre VII Les Réactions D'estérificationDocument11 pagesChapitre VII Les Réactions D'estérificationRenolga MountekelaPas encore d'évaluation
- Corrig de E1 Chimie 3eDocument2 pagesCorrig de E1 Chimie 3ePaul Eric EkoaPas encore d'évaluation
- Id-3031 PDFDocument29 pagesId-3031 PDFMicrocosmos MystiquePas encore d'évaluation
- Chapitre VIII Les Composés Oxygénés FiniDocument7 pagesChapitre VIII Les Composés Oxygénés Finimadomano1971Pas encore d'évaluation
- Cours de Chimie Organique AAT Filière Bois 2022-2023Document36 pagesCours de Chimie Organique AAT Filière Bois 2022-2023Bella BellaPas encore d'évaluation
- Les Alcools - Ts - SunudaaraDocument6 pagesLes Alcools - Ts - SunudaaraDabo0% (1)
- Squelette Carbon Partie 1 2017 FR PDFDocument8 pagesSquelette Carbon Partie 1 2017 FR PDFEl Youbi MohammedPas encore d'évaluation
- Les AlcanesDocument8 pagesLes AlcanesMonicaPas encore d'évaluation
- Cours Chimie Organique FSF 2007-2008Document52 pagesCours Chimie Organique FSF 2007-2008Mahfoud ZakiPas encore d'évaluation
- Description Des Fonctions Chimiques Simples2017Document16 pagesDescription Des Fonctions Chimiques Simples2017BikondPas encore d'évaluation
- TS-18-chimie Stratégies-Élèves PDFDocument8 pagesTS-18-chimie Stratégies-Élèves PDFsergiolamenacePas encore d'évaluation
- Chapitre VDocument9 pagesChapitre Vassma madouiPas encore d'évaluation
- Chimie Organique GénéraleDocument39 pagesChimie Organique GénéraleINASSE BOUHAMIDIPas encore d'évaluation
- Cours Chimie Organique 2122Document40 pagesCours Chimie Organique 2122Abdou HajjajiPas encore d'évaluation
- Chimie OrganiqueS3Document70 pagesChimie OrganiqueS3Akram OmariPas encore d'évaluation
- ALCENESDocument8 pagesALCENESHadjer zitPas encore d'évaluation
- Activité 2 Séq 5 - Comprendre Le Modèle de LewisDocument3 pagesActivité 2 Séq 5 - Comprendre Le Modèle de LewisSpectre UnPas encore d'évaluation
- TD CH - Org.Serie N°2 - 2021 - 22Document2 pagesTD CH - Org.Serie N°2 - 2021 - 22mohamedaminedarrajPas encore d'évaluation
- Liaison ChimDocument26 pagesLiaison ChimEL MOSTAFA EL MAZOUZYPas encore d'évaluation
- Chap 3 2020Document23 pagesChap 3 2020shinobochan1Pas encore d'évaluation
- Alcenes Et AlcynesDocument7 pagesAlcenes Et AlcynesSYLVAIN KOUADIOPas encore d'évaluation
- ExtraitDocument8 pagesExtraitLewis HamiltonPas encore d'évaluation
- Chimie Organique de SynthèseDocument68 pagesChimie Organique de SynthèseNick BOUNGOU-KOUALIPas encore d'évaluation
- PC 1ère CD-C3 Hydrocarbures InsaturésDocument12 pagesPC 1ère CD-C3 Hydrocarbures InsaturésJoconias Mongnonhoda100% (1)
- TP Edifice LewisDocument4 pagesTP Edifice LewisMohamed Ali MahjoubPas encore d'évaluation
- L'Infiltration PercolationDocument35 pagesL'Infiltration Percolationbilal100% (2)
- Phospha TationDocument32 pagesPhospha Tationxv kipPas encore d'évaluation
- Phospha TationDocument27 pagesPhospha TationJon Be GoodPas encore d'évaluation
- Classeur InvestissementsDocument3 pagesClasseur Investissementsriad sidhoumPas encore d'évaluation
- Tabla PeriódicaDocument1 pageTabla PeriódicaFabiana PaniaguaPas encore d'évaluation
- Airpur 81 SawerysynDocument10 pagesAirpur 81 SawerysynrafikrafikyPas encore d'évaluation
- Suissetec Directive SICC BT102-01 Présentation Energys PDFDocument12 pagesSuissetec Directive SICC BT102-01 Présentation Energys PDFbommobPas encore d'évaluation
- Suivi Des Stock Produit - Copie - CopieDocument54 pagesSuivi Des Stock Produit - Copie - Copieالأطلسي رشيدPas encore d'évaluation
- Aciers de Construction Nuances A Usinabilite Amelioree: Cette Norme REMPLACE La Norme S531101Document4 pagesAciers de Construction Nuances A Usinabilite Amelioree: Cette Norme REMPLACE La Norme S531101Ricardo VitorianoPas encore d'évaluation
- CHM 112 - Chimie Des Solutions (2020)Document27 pagesCHM 112 - Chimie Des Solutions (2020)Berthe Aristide Ngue NkongoPas encore d'évaluation
- Economic Evaluation of Enhanced Oil RecoveryDocument10 pagesEconomic Evaluation of Enhanced Oil Recoveryadewunmi olufemiPas encore d'évaluation
- Examen Local 2020 2021-3Document2 pagesExamen Local 2020 2021-3Soukaina OutmalPas encore d'évaluation
- Designatin Des MateriauxDocument6 pagesDesignatin Des MateriauxMohsen SaidiPas encore d'évaluation
- La Géométrie de Quelques MoléculesDocument4 pagesLa Géométrie de Quelques Moléculesicer350Pas encore d'évaluation
- Le Suivi de La Non-Conformite - Mohammed OUBEKKAR - 4117Document36 pagesLe Suivi de La Non-Conformite - Mohammed OUBEKKAR - 4117abdelmoutalib salimPas encore d'évaluation
- 9 23Document15 pages9 23SamiAmeurPas encore d'évaluation
- Correction Concours Des Mines Physique-Chimie 2022Document11 pagesCorrection Concours Des Mines Physique-Chimie 2022The Teacher100% (1)
- Index Pheur 8.8 FrancaisDocument42 pagesIndex Pheur 8.8 FrancaisBeldjouzi Hamza100% (1)
- Presentation1.Pptx - CopieDocument10 pagesPresentation1.Pptx - Copieibtissam mikhyarPas encore d'évaluation
- Equilibre ChimiqueDocument42 pagesEquilibre ChimiqueTrekOff OfficielPas encore d'évaluation
- BIOCHIMIE METABOLIQUE ET ENZYMO - Sujet Et Corrigé H.HaidousDocument7 pagesBIOCHIMIE METABOLIQUE ET ENZYMO - Sujet Et Corrigé H.Haidousrobbihad95% (22)
- Les ComprimésDocument7 pagesLes ComprimésGHERMI .M91% (11)
- PumpSelectionGuide FRDocument40 pagesPumpSelectionGuide FRarnaud SitcheuPas encore d'évaluation
- Norme Européenne EN-197-1 - 2000 Spécification Pour Le Ciment PortlandDocument5 pagesNorme Européenne EN-197-1 - 2000 Spécification Pour Le Ciment PortlandAlain SINAPas encore d'évaluation
- MémoireDocument16 pagesMémoireLotfi AbderezzakPas encore d'évaluation
- Chemins de Câbles & Canalisations PréfabriquéesDocument29 pagesChemins de Câbles & Canalisations Préfabriquéesdriouch MaryemPas encore d'évaluation
- PDF CHIMIE PDFDocument22 pagesPDF CHIMIE PDFBenjamen Ç FiloPas encore d'évaluation
- Objectif CO2 Poster GalileeDocument1 pageObjectif CO2 Poster Galileekikou tyuPas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Harmonisation Energétique des Personnes: Manuel de Curothérapie 2020D'EverandHarmonisation Energétique des Personnes: Manuel de Curothérapie 2020Évaluation : 4 sur 5 étoiles4/5 (8)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)