Académique Documents
Professionnel Documents
Culture Documents
Laboratoire 4
Transféré par
juju.simon2001Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Laboratoire 4
Transféré par
juju.simon2001Droits d'auteur :
Formats disponibles
Wattier 15/10/2020
Margaux
Groupe B
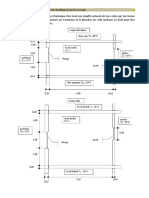
Rapport de laboratoire : Manipulation 4 : préparation d’une
solution normale d’hydroxyde de sodium.
1. Le but :
Préparation d’une solution normale d’hydroxyde de sodium à partir d’un solide
2. Le principe :
En pesant la quantité exacte d’hydroxyde de sodium et en fessant un titrage avec
comme solution titrant HCl.
3. Masse de NaOH :
J’ai pesé 22,18g de NaOH
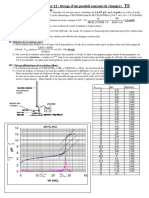
4. Résultats et calculs :
Essaies Volume Volume Titre de NaOH Erreur relative sur le Erreur absolue sur
n° de NaOH HCl titre le titre
( )+( 021, 15,7 )=0,00696
1 20 21,7 1. 21 ,7 1.10
−3 0,0069.1,085=0,00748N
=1,085N
20 20
1,085N ± 0,007N
0,007.100=0,7%
( )( )
2 20 21,6 1. 21 , 6 1.10
−3
0 , 15 0,0069.1,08=0,00745N
=1,08N + =0,0069
20 20 21 , 6
9 1,08N±0,007N
0,007.100=0,7%
( )( )
3 20 21,7 1. 21 ,7 1.10
−3
0 , 15 0,0069.1,085=0,00748N
=1,085N + =0,0069
20 20 21 , 7
6 1,085±0,007N
0 ,007.100=0,7%
5. Calcul pour la solution du professeur :
Dans un ballon jaugé de 250ml préparer une solution de NaOH par dilution de la
solution précédemment titré :
21 ,7+ 21, 6+21 , 7
Moyenne des volumes d’HCl : = 1,083
3
Volume de NaOH pour avoir NaOH 1N :
0 , 25
=0,23084L 230,84ml
1,083
250ml -230,84ml=19,16
Wattier 15/10/2020
Margaux
Groupe B
Donc il faut 230,84 ml de NaOH et 19,16ml d’eau distillée
6. Conclusion :
La concentration déterminée par le titrage du professeur est par calcul : Ci+Vi=Cf+Vf
Vf=20ml de ma solution +10ml du titrage
1,085+1,085+1 , 08
Ci= =1,083N
3
Vi=20ml
1,083
Cf = =0,0361M
30
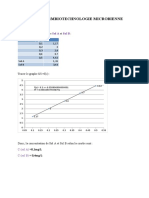
Les calculs d’erreurs de la dilution :
ER= (20 )( )(
0 , 05 0 , 15 0,007
+
10
+
1,083) .100=0,66%
EA=0,66% . 0,0361M =0,023826
Ce qui donne : 0,036M ± 0,024M
Intervalles d’erreurs : Je remarque que je n’ai pas de résultat en commun mais mon
intervalle d’erreur n’est pas grande.
Vous aimerez peut-être aussi
- Fiche de Paie ChartrinDocument18 pagesFiche de Paie Chartrinjuliefleur chironPas encore d'évaluation
- TSP1SP3Ch14T5 Correction - Exos - p365 - n14 15 16 17 18Document4 pagesTSP1SP3Ch14T5 Correction - Exos - p365 - n14 15 16 17 18EL BAKRI KHALID100% (2)
- Rapport Masse Volumique A23 PartageDocument8 pagesRapport Masse Volumique A23 PartageAli Ousaja JafriPas encore d'évaluation
- Correction TP 12 Vinaigre New PDFDocument2 pagesCorrection TP 12 Vinaigre New PDFYouSsef Echafai100% (1)
- PL4 EmagDocument4 pagesPL4 EmagGonçalo PereiraPas encore d'évaluation
- Volmolaire - Chafou - CopieDocument10 pagesVolmolaire - Chafou - CopieMë RîëmPas encore d'évaluation
- Vérification de La Période Fondamentale de La Structure - OdtDocument2 pagesVérification de La Période Fondamentale de La Structure - OdtAsmaâ TaïbiPas encore d'évaluation
- TP N°2 ChimieDocument5 pagesTP N°2 ChimieDenilson Josemir100% (1)
- Correction Cas 15Document6 pagesCorrection Cas 15Imane LKPas encore d'évaluation
- Exemples Et ExercicesDocument2 pagesExemples Et Exercicesihaya617Pas encore d'évaluation
- TP31Document12 pagesTP31Abd El Kabir H'DDPas encore d'évaluation
- CMPR OdomtrDocument5 pagesCMPR OdomtrNOURA BENPas encore d'évaluation
- Ich Piste ACIERDocument9 pagesIch Piste ACIERSaloua BelPas encore d'évaluation
- UntitledDocument6 pagesUntitledTristan RollandPas encore d'évaluation
- Extraction Liq Liq25Document6 pagesExtraction Liq Liq25fahedbou751Pas encore d'évaluation
- TP RectifiDocument2 pagesTP Rectifi9tknvgtynqPas encore d'évaluation
- 4 - Exercice S1Document9 pages4 - Exercice S1Etienne jeoffreyPas encore d'évaluation
- TD Tolérances & Ajustements - Page Sciences de L'ingénieurDocument7 pagesTD Tolérances & Ajustements - Page Sciences de L'ingénieurAmi nePas encore d'évaluation
- Estabilidade - Prova 1Document8 pagesEstabilidade - Prova 1jmartinidalmoroPas encore d'évaluation
- tp16 MaiverDocument27 pagestp16 MaiverFrédérick NguepyPas encore d'évaluation
- Zaki 4Document2 pagesZaki 4Zouaghi ZakariaPas encore d'évaluation
- Cotes Tolerancees ProfDocument2 pagesCotes Tolerancees Profsamir ghebouli100% (1)
- TP FrejDocument9 pagesTP FrejwiemsafsefiPas encore d'évaluation
- TP GeoDocument13 pagesTP GeoZineb AssafianiPas encore d'évaluation
- Correction TP N°2 Le Dosage Par Étalonnage Spectrophotométrique-CorrigéDocument2 pagesCorrection TP N°2 Le Dosage Par Étalonnage Spectrophotométrique-Corrigéjad mamouPas encore d'évaluation
- Ex TDDocument4 pagesEx TDDjihane RamdaniPas encore d'évaluation
- Exo 7Document6 pagesExo 7alalPas encore d'évaluation
- Hasil Pengamatan Unit 4 Resonansi RLCDocument5 pagesHasil Pengamatan Unit 4 Resonansi RLCZulfa auliya NikmatullahPas encore d'évaluation
- 11 - Etude de La Culée 116-136Document21 pages11 - Etude de La Culée 116-136slislimanegc100% (3)
- Compt Rendu TP PVDocument33 pagesCompt Rendu TP PVChady LahbibPas encore d'évaluation
- TP Fermentation LactiqueDocument7 pagesTP Fermentation Lactiquefarah hajibPas encore d'évaluation
- Page de Garde: GénéralDocument10 pagesPage de Garde: Généralbacha436Pas encore d'évaluation
- Reparation Et Analyse Des: Compte RenduDocument11 pagesReparation Et Analyse Des: Compte RenduabdelwahedzenkouarPas encore d'évaluation
- Resonance MecaDocument15 pagesResonance Mecariezjrif fsdjkfipsdjPas encore d'évaluation
- Grupo5 - Obras Hidraulicas EspecialesDocument138 pagesGrupo5 - Obras Hidraulicas EspecialesPamela Carolina Pesántez-CabreraPas encore d'évaluation
- Compte Rendu de LA37 BDocument7 pagesCompte Rendu de LA37 BHunter AlexPas encore d'évaluation
- Feinguss Masstoleranzen FDocument3 pagesFeinguss Masstoleranzen FMakrem CherifPas encore d'évaluation
- Projet TBATIT Meryem 2IHE PDFDocument10 pagesProjet TBATIT Meryem 2IHE PDFAyoub El HoussainiPas encore d'évaluation
- Exemple D'une Fiche de PaieDocument2 pagesExemple D'une Fiche de PaieAHMED ghribiPas encore d'évaluation
- Correction de La Serie Dexercices Sur Les Interets Simples - WWW - Etude Generale - ComDocument3 pagesCorrection de La Serie Dexercices Sur Les Interets Simples - WWW - Etude Generale - ComppdPas encore d'évaluation
- RéacteurDocument7 pagesRéacteurABDELALI SASSIOUIPas encore d'évaluation
- 4 Devoir 4 2s4 2016 2017Document2 pages4 Devoir 4 2s4 2016 2017attaheryoussouf01Pas encore d'évaluation
- Solution Serie D - Exercice Tassement ConsolidationDocument7 pagesSolution Serie D - Exercice Tassement ConsolidationYasmine OuahmedPas encore d'évaluation
- Tableau de Resultat Technique Monopoint Et Calcul de ConcentrationDocument4 pagesTableau de Resultat Technique Monopoint Et Calcul de ConcentrationMatthieu HoarauPas encore d'évaluation
- LALADocument4 pagesLALANOURDINE EZZALMADIPas encore d'évaluation
- Document Rapport de LaboratoireDocument7 pagesDocument Rapport de LaboratoireGurlInpinkPas encore d'évaluation
- Demande Avancement GRESDocument12 pagesDemande Avancement GRESLOIC STRAGAPEDEPas encore d'évaluation
- DALLAGE Note de CalculDocument7 pagesDALLAGE Note de CalculNgo Minh DucPas encore d'évaluation
- Transformations Associées À Des Réactions Acido-Basiques, Analyse Des Courbes de Titrage Acide-Base PH-métrique Et ConductimétriqueDocument18 pagesTransformations Associées À Des Réactions Acido-Basiques, Analyse Des Courbes de Titrage Acide-Base PH-métrique Et ConductimétriqueAmal ElbaniPas encore d'évaluation
- TPN2 Les BouclesDocument4 pagesTPN2 Les Boucleschahrazed amarouchePas encore d'évaluation
- Corrigé TDTP1Document10 pagesCorrigé TDTP1Souhail MdehhebPas encore d'évaluation
- Practica 2 TEQDocument3 pagesPractica 2 TEQMEGALOMANIACPas encore d'évaluation
- Linha RBDocument1 pageLinha RBrafaelPas encore d'évaluation
- Corrigé de Lexercice OCP1 Impôt Sur Le RevenuDocument7 pagesCorrigé de Lexercice OCP1 Impôt Sur Le RevenuNy Aina RabePas encore d'évaluation
- Cas Pratique Groupe CaramailDocument2 pagesCas Pratique Groupe CaramailKASEREKA MWIRA NELPHANSEPas encore d'évaluation
- TP2 RéacteurDocument9 pagesTP2 RéacteurÄyyoüb El-BchiriPas encore d'évaluation
- Immobilier À LisbonneDocument12 pagesImmobilier À Lisbonnejuju.simon2001Pas encore d'évaluation
- Informatique 1Document6 pagesInformatique 1juju.simon2001Pas encore d'évaluation
- Rapport-De-Labo-3 2Document2 pagesRapport-De-Labo-3 2juju.simon2001Pas encore d'évaluation
- DEROULEMENT DES EXAMENS Juin 2021-ÉtudiantsDocument2 pagesDEROULEMENT DES EXAMENS Juin 2021-Étudiantsjuju.simon2001Pas encore d'évaluation
- I.3.2 TP Autour Du CuivreDocument2 pagesI.3.2 TP Autour Du CuivrevaldxPas encore d'évaluation
- tp12 MaiverDocument28 pagestp12 MaiverBillel BoudjedirPas encore d'évaluation
- Acide TransDocument3 pagesAcide Transouijdane marocPas encore d'évaluation
- 4 Suivi D'une Transrormation ChimiqueDocument19 pages4 Suivi D'une Transrormation ChimiqueMfO HaCkEr ViPPas encore d'évaluation
- Labo 8 ChangementsDocument5 pagesLabo 8 ChangementsAdam LahlalPas encore d'évaluation
- Dosage 20 21Document13 pagesDosage 20 21salma benmiledPas encore d'évaluation
- Fiches E - Dosages VolumétriquesDocument9 pagesFiches E - Dosages Volumétriqueselalaoui25Pas encore d'évaluation
- Exo SOLUTIONS AQUEUSESDocument3 pagesExo SOLUTIONS AQUEUSESS.Théophile KOURAPas encore d'évaluation
- 1-Introduction:: Manipulation #2Document4 pages1-Introduction:: Manipulation #2Hi BaPas encore d'évaluation
- Exercice Chimie Solution MPSIDocument32 pagesExercice Chimie Solution MPSIlink225100% (2)
- TP s5 2018 2019 PR Abdelaaziz El Gadi Et Pr. Kholtei AbdelilahDocument34 pagesTP s5 2018 2019 PR Abdelaaziz El Gadi Et Pr. Kholtei AbdelilahMounir DABOUZPas encore d'évaluation
- BacPC PDFDocument177 pagesBacPC PDFDéyana BAKELE100% (1)
- Serie Acide Fort - Base Forte TS2Document3 pagesSerie Acide Fort - Base Forte TS2Amadou Oury DialloPas encore d'évaluation
- Concours Koba 2003Document2 pagesConcours Koba 2003falilou loPas encore d'évaluation
- Section 2 Echange D'ions/ PR KHERRATDocument59 pagesSection 2 Echange D'ions/ PR KHERRATRochdi KherratPas encore d'évaluation
- TP Coefficient de Partage Microsoft WordDocument3 pagesTP Coefficient de Partage Microsoft Wordelbakaliloubna11Pas encore d'évaluation
- Examen National Physique Chimie Sciences Maths 2020 Normale Sujet 3Document8 pagesExamen National Physique Chimie Sciences Maths 2020 Normale Sujet 3Kha Lid Bah RiPas encore d'évaluation
- Recueil de Chimie Tle CdeDocument27 pagesRecueil de Chimie Tle CdeKarma SambaPas encore d'évaluation
- Hydrométallurgie Tech IngDocument14 pagesHydrométallurgie Tech IngAnonymous uueSiA7ZCxPas encore d'évaluation
- TP Esterification 2015Document2 pagesTP Esterification 2015Daghsni Said100% (8)
- Conductimetrie - TPDocument18 pagesConductimetrie - TPChafi Mohammed100% (1)
- TP Esterification Web PDFDocument2 pagesTP Esterification Web PDFDadati Sou67% (3)
- TP AciditetotalevinDocument2 pagesTP AciditetotalevinNassimaPas encore d'évaluation
- 2bac-Sm FR Examens Nationaux Physique-Chimie 2015 A 2020Document196 pages2bac-Sm FR Examens Nationaux Physique-Chimie 2015 A 2020Soufiane AzikiPas encore d'évaluation
- Procedure ReceptionDocument12 pagesProcedure ReceptionjoverPas encore d'évaluation
- Soussa Abdelbasset PDFDocument95 pagesSoussa Abdelbasset PDFJawher SalemPas encore d'évaluation
- Chimie-Dosages Par TitragesDocument33 pagesChimie-Dosages Par TitragesSleh Ben SoltanPas encore d'évaluation
- Ester Bac Serie 1 202324 1 - 231116 - 153830Document4 pagesEster Bac Serie 1 202324 1 - 231116 - 153830deissemmhidhi3Pas encore d'évaluation
- FiltrationDocument8 pagesFiltrationLamyae SbiliPas encore d'évaluation
- Comment Fabriquer Du Savon Ecologique Et BioDocument5 pagesComment Fabriquer Du Savon Ecologique Et BioRihab khPas encore d'évaluation