Académique Documents
Professionnel Documents
Culture Documents
Chimie Des Solutions Mpsi
Chimie Des Solutions Mpsi
Transféré par
cristyenCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chimie Des Solutions Mpsi
Chimie Des Solutions Mpsi
Transféré par
cristyenDroits d'auteur :
Formats disponibles
Lyce technique Mohamed V
Centre des classes prparatoires
Bni Mellal
M.P.S.I
COURS DE CHIMIE
MPSI
CHIMIE DES SOLUTIONS
EL FILALI SAID
CHIMIE DES SOLUTIONS-M.P.S.I
TABLE DES MATIRES
Table des matires
1 Ractions chimiques
1.1 Dfinitions . . . . . . . . . . . . . . . . . . . . . . . . . . .
1.2 Lavancement de la raction . . . . . . . . . . . . . . . .
1.3 Le quotient de la raction Qr . . . . . . . . . . . . . . . . .
1.4 La constante dquilibre K . . . . . . . . . . . . . . . . . .
1.5 Critre de lvolution . . . . . . . . . . . . . . . . . . . . .
1.6 Quelques proprits utiles de la constante dquilibre K .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
3
3
3
4
4
5
5
2 RACTIONS ACIDO-BASIQUES
2.1 Dfinitions . . . . . . . . . . . . . . . . . . . . . . . . . . . .
2.2 Constante dacidit KA . . . . . . . . . . . . . . . . . . . . .
2.3 Domaine de prdominance . . . . . . . . . . . . . . . . . .
2.4 Aspet quantitatif dune raction chimique acide base A/B
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
7
7
8
11
12
3 RACTIONS DE COMPLEXATION
3.1 Couple donneur/Accepteur . . . . . . . . . . . . . .
3.2 Nomenclature des complexes . . . . . . . . . . . .
3.2.1 Nom de quelques ligands usuels . . . . . .
3.2.2 Applications . . . . . . . . . . . . . . . . . .
3.3 Constante de formation-constante de dissociation
3.4 Tableau des valeurs des log i 25 o C . . . . . . .
3.5 Domaine de prdominance . . . . . . . . . . . . . .
3.6 Applications . . . . . . . . . . . . . . . . . . . . . .
3.6.1 Complexation du cuivre II . . . . . . . . . . .
3.6.2 Dosage complxomtrique . . . . . . . . . .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
14
14
15
15
15
15
17
18
18
18
19
4 RACTIONS DE PRCIPITATIONS
4.1 Couple Donneur/Accepteur . . . . . .
4.2 Ltude quantitative . . . . . . . . . .
4.2.1 Produit de solubilit . . . . . .
4.2.2 La solubilit . . . . . . . . . .
4.2.3 Domaine dexistence . . . . .
4.2.4 Application (Voir TD) . . . . . .
4.3 Facteurs de la solubilit . . . . . . .
4.3.1 Influence de la temprature .
4.3.2 Influence de lion commun . .
4.3.3 Influence du pH de la solution
4.3.4 Influence de la complexation
4.3.5 stabilit relative dun prcipit
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
21
21
21
21
22
23
23
24
24
24
25
29
30
5 Ractions doxydo-rduction
5.1 quilibres redox . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.1.1 Couples redox . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.1.1.1 Dfinitions . . . . . . . . . . . . . . . . . . . . . . . . .
32
32
32
32
CPGE/Bni Mellal
Page -1-
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
. .
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
TABLE DES MATIRES
5.1.1.2 Le nombre doxydation n.o . . . . . .
5.1.1.3 Applications . . . . . . . . . . . . . . .
5.1.2 Couples redox de leau . . . . . . . . . . . . . .
5.2 Piles lectrochimiques . . . . . . . . . . . . . . . . . . .
5.2.1 Dfinitions . . . . . . . . . . . . . . . . . . . . .
5.2.2 Pile Daniell . . . . . . . . . . . . . . . . . . . . .
5.2.3 Potentiel de llectrode . . . . . . . . . . . . . .
5.2.4 Potentiel standard . . . . . . . . . . . . . . . . .
5.2.5 lectrode de Calomel Satur(E.C.S)(Hg2 Cl2 /Hg)
5.2.6 Formule de Nerst . . . . . . . . . . . . . . . . .
5.3 Prvision dune raction redox . . . . . . . . . . . . . .
CPGE/Bni Mellal
Page -2-
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
.
32
32
34
34
34
35
36
36
38
38
39
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
1 Ractions chimiques
1.1 Dfinitions
Soit un systme ,sige dune raction chimique dont lquation chimique est :
(1)
1 A1 + 2 A2 + 1 A1 + 2 A2 +
(2)
(1) dit sens direct et (2) sens indirect.
Ai ractif et Ai produit .
cfficient stchiomtrique.
Remarque : Lquation prcdente peut scrire sous la forme :
N
i Ai = 0
i=1
avec :
i < 0
i > 0
pour les ractifs
pour les produits
1.2 Lavancement de la raction
Lorsque le systme volue pendant le temps dt , la quantit de matire varie.
prenons lexemple suivant :
A
to
nA (to )
to + dt nA (to + dt)
(1)
(2)
nB (to )
nB (to + dt)
nC (to )
nC (to + dt)
D
nD (to )
nD (to + dt)
Si nreactif (to ) < nreactif (to + dt) nproduit (to ) > nproduit (to + dt) = sens indirect cest
dire sens (2).
Si nreactif (to ) > nreactif (to + dt) nproduit (to ) < nproduit (to + dt) = sens direct cest
dire sens (1).
On pose : dn(X) = nX (to + dt) nX (to ) variation lmentaire de la quantit de
matire de llment X, qui peut tre positive ou ngative.
On appelle lavancement lmentaire d de la raction la quantit
d =
1
dn(X)
(en mol)
avec > 0 pour les produits et < 0 pour les ractifs.
Donc pour la raction :
A
CPGE/Bni Mellal
(1)
(2)
Page -3-
D
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
1.3 Le quotient de la raction Qr
on a :
dn(A)
dn(B)
dn(C)
dn(D)
=
=
=
= d
(, , , ) R4
+.
Cette quantit est indpendante des constituants Ai ; elle caractrise le droulement de la raction dans le systme tudi.
Lavancement dune raction est born entre min et max ; en effet :supposons que
1
A est un ractif donc (A) = (nA (t) nA (t = 0)) donc :
1
min = (nA (t = 0) nA (t ))
nA (t = 0)
max =
On retient que vrifie :
min
max
1.3 Le quotient de la raction Qr
Soit la raction chimique :
(1)
1 A1 + 2 A2 + 1 A1 + 2 A2 +
(2)
On appelle le quotient de la raction avec toutes les espces sont en solution
dilue la grandeur sans dimension Qr dfinie par :
Qr =
[A1 ]
Co
[A1 ]
Co
[A2 ]
Co
[A2 ]
Co
i=1
N
i=1
[Ai ]
Co
[Ai ]
Co
Avec : Co = 1 mol/ la concentration standard.
On tire que le quotient de la raction est une grandeur sans dimension qui dpend
des concentrations de toutes les espces en solution ainsi la temprature.
Remarque :
Pour ne pas alourdir lexpression du quotient de la raction ,on remplace la concentration standard par sa valeur sans oublier que le quotient de la raction est une
grandeur sans dimension.
1.4 La constante dquilibre K
Lorsque le systme volue alors les concentrations varient jusqu lavancement
de la raction atteint sa valeur limite et les concentrations restent constantes :
on dit que le systme est dans un tat dquilibre.
CPGE/Bni Mellal
Page -4-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
1.5 Critre de lvolution
On pose :
N
Qr (t +) = Qeq (T ) =
i=1
N
[Ai ]eqi
= K(T )
[Ai ]eqi
i=1
Cest la loi daction de masse dite aussi loi de Guldberg et Waage .
K(T ) : est une grandeur sans unit qui ne dpend que de la temprature , appele
constante dquilibre.
On dfinit le pK par
pK = log K K = 10pK
Si K est grand alors pK est petit et vice versa
1.5 Critre de lvolution
Soit une raction chimique dont le quotient de la raction est Qr et de constante
dquilibre K :
Si Qr = K :le systme nvolue pas ,il est dans son tat dquilibre.
Si Qr > K :le systme volue dans le sens indirect cest dire sens (2).
Si Qr < K :le systme volue dans le sens direct cest dire sens (1).
1.6 Quelques proprits utiles de la constante dquilibre K
Soit la raction chimique :
A
(1)
(2)
Kdirect =
Kindirect
Si on multiplie cette quation par un rel p alors : Kp = (K)p
Soient deux ractions chimiques R1 et R2 chacune est caractrise par sa constante
dquilibre K1 et K2 alors :
K1
K(R1 + R2 ) = K1 K2
et
K(R1 R2 ) =
K2
Soit lavancement dune raction chimique :
Si max alors la raction est dite totale ou quantitative.
Si min = 0 alors le systme nvolue pas : il est dans un tat dquilibre.
Autrement dit :soit la raction chimique :
A
n(t = 0)
100
n(t ) a
CPGE/Bni Mellal
(1)
(2)
100
a
Page -5-
C
0
100 a
D
0
100 a
-SAID EL FILALI-
1.6 Quelques proprits utiles de la constante dquilibre
CHIMIEKDES SOLUTIONS-M.P.S.I
Critre 100% : Un raction est quantitative si 100% des ractifs vont ragir (cest
dire a =0).
K100 +
Critre 99% : Un raction est quantitative si 99% des ractifs vont ragir (cest
dire a =1).
99 99
K99 =
104
11
Critre 90% : Un raction est quantitative si 90% des ractifs vont ragir (cest
dire a =10).
90 90
100
K90 =
10 10
Critre 97% : Un raction est quantitative si 97% des ractifs vont ragir (cest
dire a =3).
97 97
103
K97 =
33
CPGE/Bni Mellal
Page -6-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
2 RACTIONS ACIDO-BASIQUES
2.1 Dfinitions
un acide de Bronsted est une espce molculaire ou ionique susceptible de
donner un proton H + ou de provoquer la liberation dun proton du solvant .
A
H+
+ B
acide
particule echang
ee
base
A et B forment un couple acide base quon note A/B
Exemple
HBr H + +
Br
HN O3 H + +
N O3
+
N H4 H + +
N H3
C6 H5 OH H + + C6 H5 O
CO2 + H2 O H + + HCO3
Cu2+ + 2H2 O 2H + + Cu(OH)2
Remarque
:
H3 P O4 H + + H2 P O4
H2 P O4 H + + HP O42
HP O42 H + + P O43
Lacide phosphorique est un triacide (polyacide).
lacide sulfurique H2 SO4 est diacide.
H2 SO4 H + + HSO4
HSO4 H + + SO42
une base de Bronsted est une espce molculaire ou ionique susceptible de
capter un proton.
Exemple :
N H3 + H + N H4+
CO32 + H + HCO3
HCO3 + H + H2 CO3 (H2 O + CO2 ), pluie acide
H2 P O4 , HP O42 jouent le rle dun acide et dune base : ampholytes
CO32 est une dibase.
Conclusion :
Toute raction chimique acido-basique rsulte de lchange de la particule H + entre lacide dun couple et la base dun autre couple.
Exemple :
CH3 COOH H + + CH3 COO
N H4+ N H3 + H +
CPGE/Bni Mellal
= CH3 COOH + N H3 N H4+ + CH3 COO
Page -7-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
2.2 Constante dacidit KA
Dune faon gnrale lquation dune raction chimique acidobasique scrit :
A1 + B2 B1 + A2
Leau qui joue le rle du solvant prsente deux couples acide-base :
H3 O+ /H2 O : H3 O+
H + + H2 O
H2 O/OH : H2 O H + + OH
On conclut que leau est un amphotre (ou ampholyte)
pH dune solution :
On dfinit le pH dun solution dilu par :
pH = log
[H3 O+ ]
C0
avec C0 = 1mol1 ; Quon peut crire :
pH = log[H3 O+ ] = log h
avec h = [H3 O+ ].
Remarque :
[H3 O+ ] en mo.1 .
H3 O+ reprsente H + solvat en effet
H3 O +
H + + H2 O
Le pH de leau pure 25o C est gal 7. donc [H3 O+ ] = [OH ] = 107 mo.1
Le produit ionique de leau Ke = [H3 O+ ][OH ] = 1014 ne dpend que de la
temprature
pKe = log Ke = pH + pOH(= 14 25 o C) avec pOH = log[OH ]
pH + pOH = pKe
2.2 Constante dacidit KA
Soit la raction acide-base :HA + H2 O
K[H2 O] =
H 3 O + + A
[H3 O+ ][A ]
= KA
[HA]
les concentrations en mo.1 et le solvant est leau.
KA constante dacidit fonction uniquement de la temprature.
On dfinit le pKA dun couple A/B comme :
pKA = log KA = KA = 10pKA
CPGE/Bni Mellal
Page -8-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
2.2 Constante dacidit KA
Exemple : leau est un amphotre
(H3 O+ /H2 O) :
H3 O + + H2 O
A1
B2
KA (H3 O+ /H2 O) =
H3 O + + H 2 O
A2
B1
[H3 O+ ]
= 1 =
[H3 O+ ]
pKA (H3 O+ /H2 O) = 0
(H2 O/OH ) :
H2 O + H2 O
A1
B2
H3 O+ + OH
A2
B1
KA (H2 O/OH ) = [H3 O+ ][OH ] = 1014 =
pKA (H2 O/OH ) = 14
Remarque :
Pour les acides plus forts que H + ([HA]
0, pKA < 0) et les bases plus fortes que
OH ([A ]
0, pKA > 14), on ne peut pas dterminer leur pKA dans leau , on dit
quils sont nivels par leau , il faut utiliser un solvant autre que leau .
Seules les couples ayant un pKA [0, 14] peuvent tre tudier dans leau .
CPGE/Bni Mellal
Page -9-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
2.2 Constante dacidit KA
Valeurs des pKA des couples acide-bases 25o C
NOM DE LACIDE
Formule de lacide Formule de la base pKA
Ion hydronium
H3 O +
H2 O
0
Eau
H2 O
OH
14
Nitrique
HN O3
N O3
-1
Sulfurique
H2 SO4
HSO4
-3
Chlorhydrique
HCl
Cl
-3
Perchlorique
HClO
ClO
-7
+
Ion ammonium
N H4
N H3
9.2
+
Ion anilium
C6 H5 N H3
C6 H5 N H2
4.6
Benzoique
C6 H5 CO2 H
C6 H5 CO2
4.7
Borique
HBO2 ou H3 BO3
HBO2 ou H2 BO3
9.2
Butanoique
C3 H7 CO2 H
C3 H7 CO2
4.8
Carbonique
H2 CO3
HCO3
6.4
2
Ion hydrognocarbonate
HCO3
CO3
10.3
Cyanhydrique
HCN
CN
9.2
Cyanique
HCNO
CN O
3.5
Dichlorotanoique
CHCl2 CO2 H
CHCl2 CO2
1.3
Ethanoique
CH3 COOH
CH3 COO
4.8
Fluorhydrique
HF
F
3.2
Ion hydrognosulfate
HSO4
SO42
2
Hypobromeux
HBrO
Bro
8.6
Hypochloreux
HClO
ClO
7.5
Hypoiodeux
HIO
IO
10.6
Iodique
HIO3
IO3
0.8
Mthanoique
HCO2 H
HCO2
3.8
Monochlorotanoique
CH2 ClCO2 H
CH2 ClCO2
2.9
Nitreux
HN O2
N O2
3.2
Orthophosphorique
H3 P O4
H2 P O4
2.1
2
Ion dihydrognophosphate
H 2 P O4
HP O4
7.2
Ion hydrognophosphate
HP O42
P O43
12.4
Oxalique
H2 C2 O4
HC2 O4
1.25
2
Ion hydrognooxalate
HC2 O4
C2 O4
4.3
Phnol
C6 H5 OH
C6 H5 O
9.9
Ion pyridium
C5 H5 N H +
C5 H5 N
5.2
Sullfhydrique
H2 S
HS
7
2
Ion hydrognosulfure
HS
S
12.9
sulfureux
H2 SO3
HSO3
1.8
2
Ion hydrognosulfite
HSO3
SO3
7.2
2
Trichlorotanoique
CCl2 COOH
CCl2 CO
1.7
E.D.T.A
H4 Y
H3 Y
2
H3 Y
H2 Y 2
2.7
H2 Y 2
HY 3
6.2
3
4
HY
Y
10.3
fin du tableau
CPGE/Bni Mellal
Page -10-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
2.3 Domaine de prdominance
A + H2 O OH + HA
On dfinit la constante de basicit comme :
KB =
On a :KA KB =
Do
[HA][OH ]
= pKB = log KB
[A ]
[H3 O+ ][A ] [HA][OH ]
= Ke
[HA]
[A ]
pKA + pKB = pKe = 14 a
` 25o C
Plus un acide est fort plus son pKA est petit,de mme plus une base est forte
plus son pKA est grand.
0
Lacide faible HA de plus en plus fort
14
pKA
Lacide faible HA de plus en plus faible
2.3 Domaine de prdominance
Soit le couple HA/A :
[A ]
[H + ][A ]
= log KA = log[H + ] + log
KA =
[AH]
[HA]
pH = pKA + log
si [A ] = [HA] = pH = pKA .
si [A ] > [HA] (la base prdomine )
si [A ] < [HA] (lacide prdomine )
Lacide faible HA prdomine
Exemple
pKA
solution
tampon
[A ]
[HA]
= pH > pKA .
= pH < pKA .
pH
La base conjugu A prdomine
: le couple :N H4+ /N H3 on a : pKA = 9.2 = pKB = 14 9.2 = 4.8
[N H4+ ] [N H3 ]
CPGE/Bni Mellal
9,2
Page -11-
pH
[N H4+ ] [N H3 ]
-SAID EL FILALI-
2.4 Aspet quantitatif dune raction chimique acide
CHIMIE
base DES
A/B SOLUTIONS-M.P.S.I
Application : (T-D)
Le diagramme de prdominance de lacide phosphorique.
H3 P O4
H2 P O4
2,15
HP O42
7,2
2.4 Aspet quantitatif dune
A/B
P O43
12,1
raction chimique
pH
acide base
Soient deux couples acide-bases A1 /B1 (pKA1 ) et A2 /B2 (pKA2 )
A1 H + + B1
(pKA1 )
A2 H + + B2
(pKA2 )
Donc :
(1)
A1 + B2 B1 + A2
(2)
Appliquons la relation Guldberg
et Waage :
K=
K=
[B1 ][A2 ]
[B2 ][A1 ]
KA1
= 10pKA2 pKA1 = 10pKA (Base)pKA (acide)
KA2
Consquences
Si pKA2 > pKA1 = K > 1 = la raction est favoris dans le sens (1).
Si pKA2 < pKA1 = K < 1 = la raction est favoris dans le sens (2).
On retrouve la rgle de gamma
pH
B2
pKA2
B1
A2
pKA1
A1
rgle de
A1 et B2 ne peuvent pas coexister tous les deux par contre A2 et B1 peuvent coexister ,donc le sens (1) .
Remarque :
Si on a une raction entre plusieurs couples A/B alors la raction favorise est
celle entre lacide le plus fort(pKA le plus petit) et la base la plus forte (pKA le plus
grand)
Exemple 1 :(nonc voir TD)
CPGE/Bni Mellal
Page -12-
-SAID EL FILALI-
2.4 Aspet quantitatif dune raction chimique acide
CHIMIE
base DES
A/B SOLUTIONS-M.P.S.I
On considre les couples suivants :
HA/A HN O2 /N O2 C6 H5 N H3+ /C6 H5 N H2 N H4+ /N H3 CH3 COOH/CH3 COO
pKA
3.3
4.5
9.2
4.75
1- Tracer le diagramme de prdominance des huit espces chimiques.
2- crire les quations bilans et en dduire les constantes dquilibre K des ractions entre les espces :
a- CH3 COOH et C6 H5 N H2 .
b- N O2 et N H4+
c- C6 H5 N H2 et N H4+
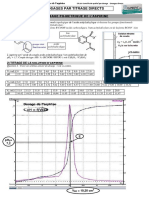
Exemple 2 :(Mthode de Gran nonc voir TD)
CB VB
CB (Ve VB )
;
[N H3 O] =
1- [N H4 O+ ] =
Vo + VB
Vo + VB
h[N H3 O]
= hVB = KA Ve KA VB : cest une droite de pente KA et qui
2- KA =
[N H4 O+ ]
coupe laxe de abscisses en VB = Ve
10
hVB 1012
y = 9535, 3 794, 5x
6
5
3
2
1
VB
0
0
10
11
12
13
On tire que KA = 794, 5.1012
et VB = 12 m
3- Daprs la relation dquivalence on conclut que
CA =
CPGE/Bni Mellal
CB Ve
= CA = 12.103 mol.1
Vo
Page -13-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
3 RACTIONS DE COMPLEXATION
3.1 Couple donneur/Accepteur
Cu2+ + 4H2 O [Cu, 4H2 O]2+ : couleur bleue
2+
Cu2+
: couleur bleue celeste
aq + 4N H3 [Cu(N H3 )4 ]
F e3+ + SCN F eSCN 2+ : couleur rouge sang.
Dune faon gnrale on aura :
A + nL
ALn = D
A :ldifice accepteur ; D : est ldifice donneur ; A/D couple donneur accepteur
Dfinitions :
Un complexe est un difice polyatomique constitu dun atome ou
dun cation mtallique central auquel sont lis des molcules ou des ions
appels ligands ou coordinats.
Latome central ou lion mtallique central : souvent un lment de
transition capable de capter des doublets dlectrons
Exemple : Ag + ; Co3+ ; Cu2+ ; N i2+ ; Zn2+ ; M n2+ ; F e3+ ; Hg 2+ ; Ce4+
Ligands ou coordinats : molcules ou ions possdant au moins un
doublet libre
Exemple : H2 O; N H3 ; OH ; N H2 CH2 CH2 N H2
Un ligand est dit monodentate sil possde un seul doublet libre.
Un ligand est dit bidentate sil possde deux doublets libres.
Un ligand est dit polydentate sil possde plusieurs doublets libres.
Exemple : Ion thylnediamminetetraactate (E.D.T.A) :
-O
OC
CH
O
C
-O
CH
CH
CH
CH
2
O
CH
2
EDTA
4-
C
O-
A + nL D
n est dit indice de coordination si tous les ligands sont monodentate.
CPGE/Bni Mellal
Page -14-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
3.2 Nomenclature des complexes
3.2 Nomenclature des complexes
3.2.1 Nom de quelques ligands usuels
Ligand
H
O2
OH
S 2
I
Br
Cl
F
CO32
P O43
C2 O42
Nom
hydrure
oxo
hydroxo
thio
iodo
bromo
chloro
Fluoro
carbonato
phosphato
oxalato
Ligand
OCN
SCN
N H2
N3
N HOH
N O3
N O2
SO42
NO
en
C6 H4 (COO)2
2
Nom
cyanato
thiocyanato
amido
azido ou azoturo
hydroxylamido
nitrato
nitrito
sulfato
nitrosyl
thylnediamine
phtalato
Ligand
SO32
S2 O32
ClO3
ClO2
O22
H2 O
N H3
CO
CN
CH3 COO
C6 H4 (OH)(COO)
2
Nom
sulfito
thiosulfato
chlorato
chlorito
peroxo
aqua
ammine
carbonyl
cyano
actato
salicylato
en = N H2 CH2 CH2 N H2
3.2.2 Applications
[Cu(H2 O)4 ]2+ : ion ttraaquacuivre (II)
[Cu(N H3 )4 ]2+ : ion ttraamminecuivre (II)
[F eSCN ]2+ : ion thiocyanatofer (III)
[Co(N O2 )3 (N H3 )3 ]2+ : ion trinitrotriamminecobalt(II)
[CrCl2 (H2 O)4 ]+ : ion dichlorottraaquachrome (III)
[F e(CN )6 ]4 : ion hexacyanoferrate (II)
[F e(CO)5 ] : pentacarbonylfer
[Ag(N H3 )2 ]+ : ion diammineargent (I)
3.3 Constante de formation-constante de dissociation
Soit le couple A/D : A + L D (n=1)
On appelle la constante de formation ou constante de stabilit note Kf la grandeur :
[AL]
Co
Kf =
[A] [L]
Co Co
avec C0 = 1 mo.1 ; ou simplement en utilisant lunit de la concentration mo.1 :
Kf 1 = 1 =
[AL]
[A][L]
De mme on dfinit :
pKf 1 = log Kf 1 = log 1
CPGE/Bni Mellal
Page -15-
-SAID EL FILALI-
3.3 Constante de formation-constante de dissociation
CHIMIE DES SOLUTIONS-M.P.S.I
Remarque
1. Plus Kf est grande plus le complexe est stable (KA grand = lacide est fort).
2. On appelle la constante de dissociation Kd la constante relative lquilibre :
AL A + L
Kd =
[A][L]
1
=
[AL]
Kf
pKd = log Kd
3. On peut dcomposer une raction de complexation en une srie de ractions
simples :
[A][L]n
[ALn ]
et
K
=
A + nL ALn
= n =
d
[A][L]n
[ALn ]
quon peut dcomposer :
[AL]
[A][L]
- A + L AL
= Kf 1 =
et
Kd1 =
[A][L]
[AL]
[AL][L]
[AL2 ]
et
Kd2 =
- AL + L AL2
= Kf 2 =
[A][AL]
[AL2 ]
- ..............................................................................................................
[ALn ]
[ALn1 ][L]
-ALn1 + L ALn
= Kf n =
et
Kdn =
[ALn1 ][L]
[ALn ]
On conclut que :
n
n =
i=1
Kf i = log n =
pKf i
i=1
De mme :
n
Kdi = pKd =
Kd =
CPGE/Bni Mellal
pKdi
i=1
i=1
Page -16-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
3.4 Tableau des valeurs des log i 25 o C
3.4 Tableau des valeurs des log i 25 o C
On rappelle que i =
Ligand
N H3
CN
SCN
N H2 (CH2 )2 N H2
S2 O32
C2 O42
Orthophnantroline
E.D.T.A ( Y 4 )
SO42
F
I
CPGE/Bni Mellal
[ALi ]
[A][L]i
Ion
centrale
Ag +
Co3+
Cu2+
Hg 2+
N i2+
Zn2+
Ag +
Cu2+
F e2+
F e3+
Cu2+
F e3+
Co2+
Cu2+
F e2+
N i2+
Ag +
F e2+
Hg 2+
Cd2+
F e3+
M n2+
F e2+
F e3+
Ba2+
Ca2+
M g 2+
F e2+
F e3+
Zn2+
F e2+
F e3+
Ce4+
Ce3+
F e3+
Al3+
Hg 2+
i=1
3,3
7,2
4,13
9
2,6
2,2
i=2
7,2
14
7,61
18
4,8
4,4
20
log i
i=3
i=4
19,2
10,78
20
6,4
6,7
21
i=5
i=6
25,3
12,59
30,5
34,8
7,5
8,7
8,1
8,2
16
34
31
27,3
1,7
3
5,8
10,6
4,3
7,5
8,8
2,1
2,8
9,4
3,8
5,1
7,8
10,7
8,7
14,3
25,1
16,3
2,3
4,2
4,1
4,1
5,5
7,1
12,9
3,6
4,3
10,7
19,7
7,6
12,8
13,5
5
29,8
4,6
14,2
5,3
5,2
4,6
13,9
6,5
9,6
16,5
6,3
32,3
6,8
33,6
20,2
1
21,2
14
7,4
9,7
12
23,8
Page -17-
13,7
15,8
27,6
16,1
20,2
29,8
20,7
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
3.5 Domaine de prdominance
3.5 Domaine de prdominance
Soit la raction :A + L D
[D]
[A][L]
= [L] = Kd
on a : Kd =
[D]
[A]
pL = log[L] = pKd + log
[A]
[D]
[B]
pour les acides et les bases)
[A]
Si [A] > [D] = pL > pKd .
Si [A] < [D] = pL < pKd .
(pH = pKA + log
[A] [D]
Remarque
[A] [D]
pKd
pL
:Analogie entre les ractions de complexation et acido-basique
Complexation
L
C=D : donneur
A : accepteur
pKd
Acido-basique
H+
A : acide
B : base
pKA
3.6 Applications
3.6.1 Complexation du cuivre II
1- Montrer que k et k1 vrifient :
pKdk = log k log k1
2- Lion Cu2+ donne quatres complexes avec N H3 et on donne :
log 1 = 4.13 ; log 2 = 7.61 ; log 3 = 10.78 ; log 4 = 12.59
Tracer le diagramme de prdominance correspondant.
3- Dans une solution de Cu2+ , on impose une concentration de N H3 libre est gale
0.1 mo.1 sous quelle forme se trouve le cuivre(II) ?
Rponse
1-On a :
k
k =
i=1
Kf i = Kf k
k1
i=1
Kf i = k = Kf k k1
= log k log k1 = log Kf k
= pKdk = log k log k1
CPGE/Bni Mellal
Page -18-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
3.6 Applications
Remarque
: Cette relation est valable si k > 1
2- pKd1 = log 1 = 4, 13
- pKd2 = log 2 log 1 = 3, 48
- pKd3 = log 3 log 2 = 2, 87
- pKd4 = log 4 log 3 = 2, 11
[Cu(N H3 )4 ]2+
[Cu(N H3 )3 ]2+
2,11
[Cu(N H3 )2 ]2+
2,87
[Cu(N H3 )]2+
3,48
4,13
Cu2+
pL
3- [N H3 ] = 0.1 mo.1 = pL = 1 ; or daprs le D.P le cuivre se trouve sous la
2+
forme de CuL2+
4 = [Cu(N H3 )4 ]
3.6.2 Dosage complxomtrique
A fin de dterminer la teneur en plomb dune essence on suit le protocole exprimental suivant :
On introduit 50 ml de lessence, chantillon analyse, dans un rfrigrant. On y
ajoute de lacide chlorhydrique concentr pour dtruire le ttrathyle de plomb et
favoriser la formation des chlorocomplexes trs soluble dans la phase aqueuse.
On spare la phase aqueuse, de la phase organique, quon vapore, ainsi on obtient un prcipit blanc( contenant les ions P b2+ ).
Par dissolution du prcit obtenu dans 100 ml deau distille on prpare la solution
quon notera S1 . 25 ml de S1 , 20 ml dun tampon thanoque et quelques gouttes
dorang de xylnol ( Indicateur color (I.C)) sont mises dans un bcher.
On titre ce mlange par une solution S2 de lacide thylnediaminettractique (
E.D.T.A. ) de concentration C2 = 9.104 mo.1
L I.C. vire du violet au jaune aprs addition de V2 = 8, 05 ml de S2 .
1.Rappeler le protocole exprimentale
2. Quelle est la forme majoritaire de l ( E.D.T.A. ) dans un tampon thanoque (
pKA = 7,75 ) ? En dduire l quation bilan de ce dosage.
3. Quel est le titre, en ions P b2+ , de la solution S1 ?
4. Vrifier que llment plomb se trouve sous la forme P b2+ .
5. Pourquoi ralise-t-on un tel dosage dans un tampon thanoque ?
6. En dduire le teneur massique ( g.l1 ) en plomb de l essence examine .
7. La teneur lgale tant de 0, 15 g.l1 . L essence tudie est-elle lgale ou non ?
Justifier.
Donnes :
pKai ( E.D.T.A. ) ( 25o C ) = 2 ; 2,7 ; 6,2 et 10,3.
M ( Pb ) = 207 g.mol1 .
pKs [P b(OH)2 ] = 15, 3 25o C .
Rponse
CPGE/Bni Mellal
Page -19-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
3.6 Applications
1- Protocole exprimentale : description
2- Daprs le diagramme de prdominance la forme majoritaire est H2 Y 2 .
P b2+ + H2 Y 2
P bH2 Y
C2 V2
A.N :
C1 = 3, 86.104 mo.1
V1
4- Tampon ethanoique pour facilit le changement de couleur de lI.C.
3- C1 =
CPGE/Bni Mellal
Page -20-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4 RACTIONS DE PRCIPITATIONS
4.1 Couple Donneur/Accepteur
Soient les exemples suivants :
AgCl(S)
N aCl(S)
CuSO4(S)
D
Ag + + Cl
N a+ + Cl
Cu2+ + SO42
A+P
- Le donneur est le prcipit .
- Laccepteur nest pas dfini :on peut avoir AgCl/Ag + ou AgCl/Cl .
Par analogie avec la complexation on choisit comme accepteur le cation mtallique
Do :
AgCl(S)
CuSO4(S)
Ag2 S(S)
Ag + + Cl
Cu2+ + SO42
2Ag + + S 2
:AgCl/Ag +
:CuSO4 /Cu2+
:Ag2 S/Ag +
4.2 Ltude quantitative
4.2.1 Produit de solubilit
Soit une solution sature de phosphate dargent Ag3 P O4
Ag3 P O4(S) 3Ag + + P O43
Ks = [Ag + ]3e [P O43 ]e
pKs = log Ks
Remarque :
1- Soit lquilibre : CaSO4 Ca2+ + SO42
Le quotient de la raction est : Qr = [Ca2+ ][SO42 ]
Si Qr < Ks = la solution est homogne et le prcipit nexiste pas.
Si Qr Ks = la solution est htrogne et on formation du prcipit.
2- Plus Ks est grand (pKs est petit) plus le complexe est soluble.
CPGE/Bni Mellal
Page -21-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.2 Ltude quantitative
Tableau rcapitulatif des pKs 25o C
PP Aa
P
AcO
M m+ PPP
Ag +
2,7
Br
Cl
C2 O42
CN
CO32
CrO42
12,3
9,7
11
15,3
11
11,8
Al3+
29
Ba2+
Ca2+
Cd2+
Co2+
8,3
Cu+
I
16,2
P O43
S 2
SO32
SO42
49,2
13,8
4,8
10
6,5
4,6
7,6
15,8
33,3
18,2
2,3
22,5
8,3
9,8
5,8
8,6
8,4
4,9
10,5
5,2
26
7,8
13,6
2,2
13,6
32,6
26,1
5,4
12,8
15,6
34,7
23
6,7
19,5
5,4
12,6
Cu2+
7,5
9,6
F e2+
6,7
10,5
5,6
5,6
16
8,7
5,5
14
22
17,9
13
39,3
37
15,1
38
14,7
47,6
18,6
F e3+
Hg22+
OH
17,2
21,9
23,7
47
6,2
28,3
25,4
51,8
1,4
M g 2+
4,1
4,4
10,8
27,2
M n2+
15
9,4
12,7
22
N i2+
7,4
6,9
14,7
10,5
13,1
2,8
4,4
4,8
8,2
12,6
7,8
8,2
16,1
4
8,9
Zn2+
22,6
10,8
AcO : ion thanoate (actate) CH3 COO
2,2
9,6
20
42,1
28,1
Sn2+
Sn4+
85
28,4
Hg 2+
P b2+
35,2
7,8
25
56
16,5
27
70
32
24,5
4.2.2 La solubilit
On appelle solubilit molaire volumique s dun solide , sa quantit de
matire que lon peut dissoudre dans un litre de solution ( mo.1 )
Exemple
1- AgCl(S) Ag + + Cl : pKs = 9.75
s
s
2
Ks = s = s = Ks :
s = 1.33 105 mo.1
+
2- Ag3 P O4(S) 3Ag
+ P O43 : pKs = 15.8
3s
s
Ks
Ks = (3s)3 .s = 27s4 = s = 4
:
s = 4.92 105 mo.1
27
Remarque :
On dfinit la solubilit massique volumique sm par la masse du solide quon
peut dissoudre dans un litre de solution, donc
sm =
Puisque n =
m(solide)
V (solvant)
m
; M tant la masse molaire du solide , alors
M
sm = sM
CPGE/Bni Mellal
Page -22-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.2 Ltude quantitative
De mme on dfinit la solubilit massique Sm comme tant la masse dissoute
du solide par masse de rfrence du solvant (100g ou 1kg deau)
Exemple :rduction La solubilit massique en (g) par 100 g deau
Fluorides
Chlorides
Nitrates
Sulfates
AlF3
0,67
AlCl3
45,8
Al(N O3 )3
73,9
Al2 (SO4 )3
36,4
BaF2
0,16
N H4 Cl
37,2
N H4 N O 3
192
(N H4 )2 SO4
75,4
M nF2
1,06
BaCl2 , 2H2 O
35,8
Ba(N O3 )2
CdSO4
76,6
N iF2
1,2
CaCl2 , 6H2 O
74,5
Cd(N O3 )2
150
CaSO4 , 2H2 O
0,26
KF
94,9
CsCl
187
Ca(N O3 )2 , 4H2 O
129
CoSO4
36,1
AgF
172
CoCl2
52,9
CsN O3
23
CuSO4 , 5H2 O
32
N aF
4,06
CuCl2
73
Co(N O3 )2
97,4
F eSO4 , 7H2 O
48
F eCl2
62,5
Cu(N O3 )2
125
Li2 SO4
34,8
Ba(ClO4 )2 , 3H2 O
336
F eCl3 , 6H2 O
91,8
F e(N O3 )2 , 6H2 O
140
M gSO4
33,7
Cd(ClO4 )2 , 6H2 O
188
P bCl2
F e(N O3 )3 , 9H2 O
138
K2 SO4
11,1
Perchlorates
F e(ClO4 )3
368
LiCl
83,5
P b(N O3 )2
54,3
Ag2 SO4
0,8
LiClO4
56,1
M gCl2
54,6
LiN O3
70,1
N a2 SO4
19,5
ZnSO4
53,8
KClO4
1,68
M nCl2
73,9
KN O3
31,6
N aClO4
201
HgCl2
98
AgN O3
216
N aClO4
201
N iCl2
60,8
N aN O3
87,6
KCl
34,2
K2 CO3
111
N aCl
35,9
N a2 CO3
21,5
Carbonates
Li2 CO3
1,33
4.2.3 Domaine dexistence
Soit lquilibre :
AgCl(S) Ag + + Cl :
pKs = 9.75
+
Cl tant la particule change (H pour les acides).
Ks
= 107.75 mo.1 ;
Si on choisi [Ag + ] = 102 mo.1 alors [Cl ] =
[Ag + ]
donc pCl = log[Cl ] = 7.75
7,75
Domaine dexistence de AgCl
pCl
Domaine de prdominance de Ag +
Remarque
Le domaine frontire (valeur de pCl) dpend de la concentration arbitraire
choisi.
4.2.4 Application (Voir TD)
Tracer le diagramme dexistence pour F e(OH)2 sur laxe des pH.
On donne : pKs (F e(OH)2 ) = 15 ; [F e2+ ] = 0, 01 mo.1
CPGE/Bni Mellal
Page -23-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
4.3 Facteurs de la solubilit
4.3.1 Influence de la temprature
On admet la relation de Vant Hoff :
r H o
d ln Ks
=
dT
RT 2
r H o : lnergie (enthalpie standard ) de la raction de dissolution.
Si r H o > 0 = si T = Ks et s : la solubilit augmente avec la
temprature .
Exemple CuSO4 ; N aCl; P bCl2 ; ........
Si r H o < 0 = si T = Ks et s : la solubilit diminue avec la
temprature .
Exemple Le calcaire = tartre :CaCO3 ;.......
Conclusion :Lorsque la temprature T augmente alors :
r H o >0
P r
ecipit
e r H o < 0 cation + anion
4.3.2 Influence de lion commun
Le produit de solubilit de BaF2 est Ks = 1.37 106
1. Calculer la solubilit molaire s et la solubilit massique sm (en g/l).
2. A un litre de solution de BaF2 , on ajoute une mole de Ba(N O3 )2 ; calculer la
nouvelle solubilit molaire s de BaF2 .
3. A un litre de solution molaire de Ba(N O3 )2 on ajoute 0.02 mol de NaF. Le BaF2
prcipite-t-il ?
On donne : M(BaF2 ) = 177 g/mol ;O=16 ;N=14 ;F=20 ;Ba=137.
On suppose que les nitrates beaucoup soluble dans leau
RPONSE
1-
BaF2 Ba2+ + 2F
Ks = 4s3 = s = 3 Ks /4 : A.N : s = 7. 103 mo.1
sm = s M : A.N : sm = 1.24 g/
2BaF2
te1
t0
te2
CPGE/Bni Mellal
Ba2+
s
s+1
s+1y
Page -24-
2F
2s
2s
2s 2y
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
On pose : s = s y = s < s ;donc :
Ks = (s + 1)(2s )2 = 4s2 (s + 1) = 4s3 (Ks ne depend pas de la concentration ).
Comme s < s 1 = 4s2 = 4s3
= s = s3/2
A.N : s = 5.85 104 mo.1
On constate que la solubilit diminue avec laddition dun ion commun.
3- En milieux aqueux , N aF et Ba(N O3 )2 sont totalement dissocies :
Ba(N O3 )2 Ba2+ + 2N O3 ; N aF N a+ + F
BaF2 se prcipite si Qr Ks .
On a : [Ba2+ ] = 1 mo.1 ; [F ] = 0.02 mo.1
Donc : Qr = [Ba2+ ][F ]2 = 4. 104 > Ks : BaF2 se prcipite
Influence de lion commun
>
>
>
>
>
>
>
restart:Ks:=1.37*10^(-6):eq1:=Ks=4*S^2*(1+S);eq2:=Ks=4*s^2;
eq1 := .1370000000 105 = 4 S 2 (1 + S)
eq2 := .1370000000 105 = 4 s2
solubilite:=fsolve(eq1,S);
solubilite := .9999996575, .0005854063709, .0005850638707
Sexacte:=solubilite[3];
Sexacte := .0005850638707
Solubilite:=fsolve(eq2,s);
Solubilite := .0005852349955, .0005852349955
Sapproche:=Solubilite[2];
Sapproche := .0005852349955
incertitude:=abs(Sexacte-Sapproche);
incertitude := .1711248 106
precision:=incertitude*100/Sexacte;
precision := .02924890915
La prcision est gale 3 pour 10 000 : Cest parfait
4.3.3 Influence du pH de la solution
Le carbonate de calcium est un sel peu soluble dont le produit de solubilit
25 C est Ks = 4, 9.109 .
1- On nglige la basicit des ions CO32 ,calculer la solubilit molaire s de ce sel.
2- En tenant compte de la basicit des ions CO32 , calculer a cette temprature, la
solubilit molaire s de CaCO3 dans leau et le pH de la solution sature.
On rappelle que les constantes dacidits de CO2 et de HCO3 sont respectivement :
K1 = 4, 1.107 et K2 = 4, 9.1011 .
o
CPGE/Bni Mellal
Page -25-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
3- On fait barboter CO2 dans la solution prcdente en prsence de CaCO3 solide,
Montrer que du CaCO3 passe en solution.
tablir, en fonction de la pression P du CO2 au dessus de la solution, les expressions littrales de [Ca2+ ] = x et de [H3 O+ ] = h dans la solution.
On prcise que, suivant la loi de Henry, on a [CO2 ] = k.P , avec k = 4, 9.102 , P
tant en atmosphre et les concentrations en mo.1
A.N : Si lon pose P = 1atm, quelle est la solubilit massique de CaCO3 ? Quel est
le pH de la solution sature. On donne Ca = 40.
La solution des quations :
s4 9, 8.109 s2 1012 s + 2, 4.1017 = 0 = s = 0, 0001272
1 .197 1017
.100 1011 h2 + h = .201 107 +
= h = 12, 6.107
h
h2
RPONSE
A.N
s = 7 105 mo.1
1- s = Ks =
2- On a :
CaCO3 Ca2+ + CO32 ; Ks = [Ca2+ ][CO32 ] (1)
h[HCO3 ]
CO2 + 2H2 O H3 O+ + HCO3
K1 =
(2) (KB1 = 107.6 )
[CO2 ]
h[CO32 ]
HCO3 + H2 O H3 O+ + CO32
K2 =
(3) (KB2 = 103.69 )
[HCO3 ]
puisque Ca2+ est un ion indiffrent alors la solubilit :
s = [Ca2+ ] = [CO2 ] + [HCO3 ] + [CO32 ] (4)
N.E : 2[Ca2+ ] + [H3 O+ ] = [HCO3 ] + 2[CO32 ] + [OH ] (5)
Ke = [H3 O+ ][OH ] (6)
Comme CO32 est une dibase alors le milieu est basique et on peut faire les approximations suivantes quon justifies la fin.
[H3 O+ ] [OH ]
[CO2 ] [HCO3 ]
(4) = [Ca2+ ] [HCO3 ] + [CO32 ] (4)
(5) = 2[Ca2+ ] [HCO3 ] + 2[CO32 ] + [OH ]
= 2[Ca2+ ] [Ca2+ ] + [CO32 ] + [OH ]
donc :
[Ca2+ ] [CO32 ] + [OH ] (6)
(4)et (6) = [HCO3 ] = [OH ] = w (7)
(1) = Ks = [Ca2+ ][CO32 ]
= Ks = [Ca2+ ]([Ca2+ ] [OH ])
s2 Ks
Ks
=
= Ks = s(s w) = w = s
s
s
Ke
(s w)
h[CO32 ]
Ke
w
Or : K2 =
= 2 (s w)
=
w
w
[HCO3 ]
K2 2
K2 s2 Ks 2
s2 Ks
w = s w =
[
] =s
Ke
Ke
s
s
K2 2
(s Ks )2 = Ks .s
=
Ke
CPGE/Bni Mellal
Page -26-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
On tire que :
s4 2Ks s2
Ke Ks
s + K2s = 0
K2
A.N :
s4 9, 8.109 s2 1012 s + 2, 4.1017 = 0
La rsolution par maple donne : s = [Ca2+ ] = 1, 27.104 mo.1
Do les valeurs numriques :
s = [Ca2+ ] = 1, 27.104 mo.1
[CO32 ] = Ks /[Ca2+ ] = 3, 8.105 mo.1
[HCO3 ] = [OH ] = s [CO32 ] = 8, 9.105 mo.1
Ke
= 1, 1.1010 mo.1 = pH = 9, 95
[H3 O+ ] =
[OH ]
[H3 O+ ][HCO3 ]
[CO2 ] =
= 2, 39.108 mo.1 [HCO3 ] = 8, 9.105 mo.1
K1
Donc les approximations sont biens justifies.
3- Lorsque on barbote du CO2 dans la solution en presence de CaCO3 solide alors
[CO32 ] = [Ca2+ ] : dissolution dune partie du calcaire .
On a pK1 = 6.4 et pK2 = 10.3 ainsi les espces majoritaires sont CO2 et CO32 donc
la raction prpondrante est :
H2 O + CO2 + CO32 2HCO3
avec une constante dquilibre K = 1010.36.4 = 103.9 1
La N.E = 2[Ca2+ ] + h = 2[CO32 ] + [HCO3 ] + [OH ]
Or [CO2 ] = KP donc :
K1 KP
K2 [HCO3 ]
[HCO3 ] =
de mme [CO32 ] =
h
h
K
K
KP
2
1
= [CO32 ] =
h2
Ks
Ks h2
Dautre part :[Ca2+ ] =
=
K1 K2 KP
[CO32 ]
Dans la N.E on obtient :
2Ks h2
K1 KP
K2 K1 KP
Ke
Ke
=
=
+2
+
2[Ca2+ ] + h = [HCO3 ] + 2[CO32 ] +
h
K2 K1 KP
h
h2
h
Influence du pH sur la solubilit du carbonate de calcium
restart:
K[A1]:= 4.1*10^(-7);K[A2]:=
4.9*10^(-11);Ks:=4.9*10^(-9);Ke:=10^(-14);P:=1;k:=4.9*10^(-2);
>
>
KA1 := .4100000000 106
KA2 := .4900000000 1010
Ks := .4900000000 108
1
Ke :=
100000000000000
CPGE/Bni Mellal
Page -27-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
>
>
P := 1
k := .04900000000
eqa:=Ks=[Ca2+]*[CO3(2-)];
eqa := .4900000000 108 = [Ca2 +] [CO3 (2 )]
eqb:=K[A1]=h*[HCO3(-)]/[CO2];
eqb := .4100000000 106 =
>
h [HCO3 ()]
[CO2 ]
eqc:=K[A2]=h*[CO3(2-)]/[HCO3(-)];
h [CO3 (2 )]
[HCO3 ()]
solubilite:=[Ca2+]=[CO2]+[HCO3(-)]+[CO3(2-)];
solubilite := [Ca2 +] = [CO2 ] + [HCO3 ()] + [CO3 (2 )]
NE:=2*[Ca2+]+h=[HCO3(-)]+2*[CO3(2-)]+w;
NE := 2 [Ca2 +] + h = [HCO3 ()] + 2 [CO3 (2 )] + w
produitionique:=Ke=h*w;
1
produitionique :=
= hw
100000000000000
inconnue:={h,w,[Ca2+],[CO2],[HCO3(-)],[CO3(2-)]};
inconnue := {[CO3 (2 )], [Ca2 +], [CO2 ], [HCO3 ()], h, w}
systeme:={eqa,eqb,eqc,solubilite,NE,produitionique}:
solution:=[fsolve(systeme,inconnue)];
eqc := .4900000000 1010 =
>
>
>
>
>
>
solution := [{[HCO3 ()] = .00008864400316, h = .1127486353 109 ,
w = .00008869286952, [CO2 ] = .2437680582 107 , [Ca2 +] = .0001271926259,
>
>
[CO3 (2 )] = .00003852424593}]
[H3O(+)]:=.1127486353e-9;
[H3O(+)] := .1127486353 109
pH:=-log[10]([H3O(+)]);
pH := 9.947888706
>
Digits:=3:neutralite:=
2*Ks*h^2/(K[A1]*K[A2]*k*P)+h=K[A1]*k*P/h+2*K[A1]*K[A2]*k*P/h^2+\Ke/h;
>
1 .197 1017
+
h
h2
solution:=fsolve(neutralite,h,0..infinity);
>
solution := .126 105
H:=solution;pH2:=-log[10](solution);
neutralite := .100 1011 h2 + h = .201 107
H := .126 105
pH2 := 5.90
>
C(OH(-)):=Ke/H;C(Ca(2+)):=Ks*H^2/(K[A1]*K[A2]*k*P);C(HCO3(-):=K
[A1]*k*P/H;C(CO3(2-)):=K[A1]*K[A2]*k*P/H^2;
C (OH ()) := .794 108
C (Ca(2 +)) := .00792
C (HCO3 () := .0160
>
C (CO3 (2 )) := .619 106
solubilitemassique:=C(Ca(2+))*(40+12+3*16);
solubilitemassique := .792
CPGE/Bni Mellal
Page -28-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
>
C(CO2):=k*P;
C (CO2 ) := .04900000000
4.3.4 Influence de la complexation
Exercice(13)TD : chimie des solutions
Par addition dune base forte dans une solution dions Al3+ , il se forme tout dabord
un prcipit de Al(OH)3 qui se redissous dans un excs dions hydroxydes (OH )
en formant le complexe Al(OH)
4
1. Calculer les constantes des ractions suivantes :
Al3+ + 3OH Al(OH)3
Al(OH)3 + OH Al(OH)
4
On donne : pKs (Al(OH)3 ) = 32 ; p4 = - 35
2. Quelles sont les valeurs de pH de dbut et de fin de prcipitation lorsque le
pH dune solution contenant initialement 103 mo.1 ?
3. En dduire le domaine de prdominance des ions Al3+ et Al(OH)
4 ainsi que
le domaine dexistence du prcipit Al(OH)3
Rponse
1 - Calcul des constantes des ractions :
Raction de prcipitation :A3+ + 3OH
K1 =
A3+ + 4OH
K2 = 4 Ks
A(OH)
4
A3+ + 3OH
Ks
A(OH)
4
Al(OH)3 + OH
K1
1
= 1032
Ks
Raction de Complexation :A(OH)3 + 3OH
A(OH)3
A(OH)3
A(OH)
K2
4
A.N :
K2
K2 = 103 1
Raction quasi-totale dans le sens direct cest dire formation du complexe
2 - Sachant que [A3+ ] = 103 mo.1 alors :
pHD du dbut de prcipitation :
Le dbut du prcipit si Qr Ks
Ks
3
Ks [OH ]3 [A3+ ] = [OH ]
[A3+ ]
[OH ]
CPGE/Bni Mellal
2, 15.1010 mo.1 = pHD
Page -29-
4, 33
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
pHF du fin de prcipitation :
La disparition du prcipit si Qr = K2
[A(OH)
[A(OH)
4]
4]
K2 =
=
[OH
]
=
= 106 mo.1
[OH ]
K2
Il en rsulte que
pHF 8
3 - Domaines de prdominance et dexistence :
A(OH)
4
A(OH)3
A3+
4,33
Conclusion
pH
:La solubilit augmente avec la complexation
4.3.5 stabilit relative dun prcipit
Exercice(12)TD 1 : chimie des solutions
1. Dterminer la solubilit du chlorure dargent pKs (AgCl ) = 9,75 et celle diodure dargent pKs (AgI) = 16,20 dans leau pure, puis en dduire le compos
le plus soluble.
2. Dterminer la constante de la raction ayant lieu par ajout des ions iodures
I une solution contenant un prcipit de AgCl. Conclure.
3. Calculer la solubilit dans leau pure du chromate dargent pKs (Ag2 CrO4 ) =
12,00. La comparer celle de AgCl. Que peut-on conclure ?
4. Dterminer la constante de la raction quaura lieu lorsquon ajoute des ions
Cl un prcipit de Ag2 CrO4 .
Rponse
1 -La solubilit du :
Chlorure dargent :
AgCl(S)
Ks1 = s21 = s1 =
Ag + + Cl
Ks1 A.N :
s1 = 1, 32.105 mo.1
Iodure dargent :
AgI(S)
CPGE/Bni Mellal
Ag + + I
Page -30-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
4.3 Facteurs de la solubilit
Ks2 = s22 = s2 =
Ks2 A.N :
s2 = 1, 45.108 mo.1
Donc :puisque s1 > s2 alors AgCl est plus soluble que AgI
Remarque : La comparaison des pKs pour en dduire le compos le plus soluble
nest valable que si les composs prsentent des formules semblables cest dire
mme nombre de cations et danions.
2 - On a :
AgCl
Ag + + Cl
Ag + + I
AgCl + I
Avec : K1 =
AgI
AgI + Cl
Ks1
1
Ks2
K1
Ks1
= 10pKs2 pKs1 A.N :
Ks2
K1 = 106,45 = 2, 82.106
Conclusion : AgI moins soluble mais plus stable que AgCl .
3 - La solubilit du chromate dargent :
Ag2 CrO4
2Ag + + CrO42
On a : Ks3 = (2s3 )2 s3 = Ks3 = 4s33 donc s3 =
s3 =
Ks3
4
; A.N :
Ks3
4
s3 = 6, 3.105 mo.1
s3
= 4, 77 donc le chromate dargent Ag2 CrO4 est 4,77 fois plus
s1
soluble que le chlorure dargent AgCl
4 - Dtermination de la constante de raction :
Comparaison :On a :
2AgC
2Ag + + 2C
2Ag + + CrO42
Ag2 CrO4
2AgC + CrO42
Ag2 CrO4 + C
K2s1
1
Ks3
1
K2
On tire que
K2 =
Ks3
= K2 = 107,5 1
2
Ks1
La raction est quantitative dans le sens direct cest dire dans le sens de formation du chlorure dargent AgC, donc AgC est plus stable que le bichromate
dargent.
CPGE/Bni Mellal
Page -31-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5 Ractions doxydo-rduction
5.1 quilibres redox
5.1.1 Couples redox
5.1.1.1 Dfinitions :
Oxydant : une espce chimique capable de capter des lectrons on le note
par ox
Rducteur : une espce chimique capable de capter des lectrons , on le
note red
Oxydation : une raction au cours de laquelle on a perte dlectron.
Rduction : une raction au cours de laquelle on a gain des lectrons.
Raction redox : une raction au cours de laquelle on a change dlectrons
entre deux couples redox ox1 /red1 et ox2 /red2
5.1.1.2 Le nombre doxydation n.o
5.1.1.2.1 Dfinitions :
La charge formelle quelle apparat sur un constituant comme si lentit
est forme par des ions, on le note n.o
Par consquent :
Le n.o dun lment simple est nul.
n.o (Na)=0 ; n.o (Fe)=0.
Le n.o dun ion est gal sa charge.
n.o (F e2+ ) = +II ; n.o (Cl ) = I ; n.o (Cr2 O72 ) = II ; n.o (Ce4+ ) = +IV ;
Le n.o dune molcule est nul.
n.o (CH4 ) = 0 ; n.o (CH3 COOH) = 0 ;n.o (N aCl) = 0 ; n.o (H2 SO4 ) = 0
Le n.o de loxygne dans les composs oxygns est gale (-II) sauf dans
les peroxydes ou son n.o =-I [H2 O2 ; K2 O2 ; N a2 O2 ...] , et dans F2 O ou le n.o = +II.
Le n.o de lHydrogne dans les composs hydrogns est gal +I sauf
dans les hydrures [LiH ;NaH ; KH ; ....] ou son n.o est -I
Remarque : n.o Z
5.1.1.3 Applications
5.1.1.3.1 Loxydorduction et le n.o
Zn2+
2e
+II
R
eduction
oxydant
Zn
0
rducteur
Le n.o passe de +II 0 ( il diminue)
CPGE/Bni Mellal
Page -32-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.1 quilibres redox
oxydation
Cu
0
+ 2e
Cu2+
II
rducteur
oxydant
Le n.o passe de 0 II ( il augmente)
Dfinition :
Un oxydant est une entit dont le n.o peut diminuer.
Un rducteur est une entit dont le n.o peut augmenter.
Une oxydation correspond une augmentation du n.o .
Une rduction correspond une diminution du n.o .
Remarque
Soit lexemple suivant :
2Ag + + Cu
Ag +
1e
Ag
1
Cu
|(n.o )| = +I
|(n.o )| = +II
Cu2+
2e
2Ag + Cu2+
0
+II
Le n.o de loxydant est suprieur celui du rducteur .
Pour chaque lment , la valeur absolue de la variation globale du n.o est
gale au nombre dlectrons transfrs .
On a : 2n.o (Ag) + n.o (Cu) = 0
Dans une raction redox ,la somme algbrique des variations des n.o des lments
affects de leur cfficients stchiomtrique est nulle
5.1.1.3.2 Identification dune raction chimique
HCl +
-I
NaOH H2 O
+ (N a+
, Cl )
+I
-I
+I
-Le n.o (Cl)=-I et reste -I.
-Le n.o (Na)=+I et reste +I.
pas de variation du n.o , par consquent la raction chimique nest pas une raction redox (acidobasique).
CO2
+IV
Mg
C +
2MgO
+II
-Variation du n.o donc la raction chimique est une raction redox.
CPGE/Bni Mellal
Page -33-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.2 Piles lectrochimiques
5.1.1.3.3 quilibrage dune quation redox :
Pour cela :
Bilan redox : calcul du n.o et dduire le nombre des lectrons changs.
Bilan de charge (N.E) : utiliser H + en milieu acide et OH en milieu basique.
Bilan de matire : conservation de H et O par addition de H2 O
Exemple (Voir TD)
Remarque Raction de dismutation
Cest une raction chimique au cours de laquelle un lment joue le rle dun oxydant et dun rducteur .
Exemple : dismutation du chlore.
2OH- + Cl
2
0
ClO - + Cl - +H O
2
+I
-I
oxydation
rduction
On a deux couples redox :
Cl2 /Cl : le chlore joue le rle dun oxydant.
ClO /Cl2 : le chlore joue le rle dun rducteur.
Par consquent le chlore joue le rle dun ampholyte oxydorducteur.
5.1.2 Couples redox de leau
Leau solvant en solution aqueuse possde des proprits acido-basique ainsi
des proprits oxydo-rductrices : Il prsente deux couples redox :
H + /H2 en milieu acide ou H2 O/H2 en milieu basique en effet :
2H + + 2e
2H2 O + 2e
H2
H2 + 2OH
en milieu acide
en milieu basique
O2 /H2 O en milieu acide ou O2 /OH en milieu basique en effet :
O2 + 4H + + 4e
O2 + 2H2 O + 4e
2H2 O
4OH
en milieu acide
en milieu basique
5.2 Piles lectrochimiques
5.2.1 Dfinitions
Une pile lectrochimique est une source de puissance capable de fournir
lnergie au circuit extrieur.
CPGE/Bni Mellal
Page -34-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.2 Piles lectrochimiques
Une pile est constitue de deux cellules distinctes ou demi piles dont la
communication est assure par un pont ionique (dit aussi pont salin constitu dun
sel :KN O3 ; N H4 OH,...).
Une demi pile est constitue dun oxydant est son rducteur (mme lment
chimique).
On appelle lectrode un conducteur assurant la jonction entre la cellule
(demi pile) et le circuit extrieur (lame de cuivre , zinc , fer ,platine, graphite,.....).
Une lectrode sige dune oxydation est dite anode.
Une lectrode sige dune rduction est dite cathode.
5.2.2 Pile Daniell
La pile Daniell est constitue des couples Cu2+ /Cu et Zn2+ /Zn
A
ou
2+
Cations (Zn
)
2Anions (SO
)
4
Zn
2+
Cu
2+
2-
2-
( Cu ,SO )
4
( Zn ,SO4 )
Dans le compartiment du zinc on a :
Zn
Zn2+ + 2e
Cest une oxydation et par consquent llectrode ( lame ) de zinc est une anode.
Dans le compartiment du cuivre on a :
Cu2+ + 2e
Cu
Cest une rduction et par consquent llectrode ( lame ) de cuivre est une cathode.
Lquation bilan :
Zn + Cu2+
Cu + Zn2+
On symbolise la pile par :
Zn|Zn2+ ...... Cu2+ |Cu +
CPGE/Bni Mellal
Page -35-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.2 Piles lectrochimiques
Remarque :
En gnral on symbolise une pile lectrochimique par :
Electrode(1)/red1 /ox1 //P ont ionique//ox2 /red2 /Electrode(2)
Le voltmtre mesure la force lectromotrice de la pile
E = V(Cu2+ /Cu) V(Zn2+ /Zn)
Lampremtre mesure le courant de court-circuit .
Llectrode de cuivre joue le rle du ple positif de la pile.
Dans le compartiment du cuivre on aura un dpt de cuivre sur la lame de
cuivre (sa masse augmente)
Dans le compartiment du zinc , on a dgradation de la lame du zinc (sa
masse diminue)
5.2.3 Potentiel de llectrode
Puisque E reprsente la diffrence de potentiel entre les deux lectrodes ,alors
on dfinit le potentiel de llectrode quon le note E ou qui reprsente le potentiel
de llectrode par rapport la solution.
5.2.4 Potentiel standard
Puisque le potentiel est dfinie une constante additive prs, alors pour le
fixer on choisit une lectrode quon lui attribue le potentiel nul dans les conditions
standards (P = 1 Bar) :Cest llectrode standard dhydrogne ; Par consquent
Eo (H + /H2 ) = 0 (V )
Pt
H2
P(H2)=1bar
HCl
Solution pH= 0 et infinement dilue
La demi quation scrit : 2H + + 2e
H2(g)
+
1
Symbolise par : P t|H2(g) |H3 O (1 mo. )
Son intrt : rfrence lectrique Eo (H + /H2 ) = 0V
Dfinition :
On appelle potentiel standard dune lectrode son potentiel par rapport llectrode standard dhydrogne lorsque toutes les concentrations valent 1 mo.1 ,les
pressions partielles des gaz valent 1 Bar ; on le note Eo
CPGE/Bni Mellal
Page -36-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.2 Piles lectrochimiques
Tableau des potentiels standard Eo 298K
Couple
(Red > H2 O)
Li+ /Li(s)
Ba2+ /Ba(s)
K + /K(s)
Cs+ /Cs(s)
Ca2+ /Ca(s)
N a+ /N a(s)
M g 2+ /M g(s)
H2 /H
Be2+ /Be(s)
Al3+ /Al(s)
M n2+ /M n(s)
Zn2+ /Zn(s)
CO2 /H2 C2 O4
S(s) /S 2
Cd2+ /Cd(s)
P bI2(s) /P b(s)
Co2+ /Co(s)
P bCl2(s) /P b(s)
N i2+ /N i(s)
As(s) /AsH3(g)
Sn2+ /Sn(s)
P b2+ /P b(s)
N2(g) /N H3(aq)
F e3+ /F e(s)
H2 O/H2(g)
CPGE/Bni Mellal
Eo (V )
Couple
Eo (V )
-3,04
-2,92
-2,92
-2,92
-2,84
-2,71
-2,36
-2,25
-1,85
-1,66
-1,18
-0,76
-0,48
-0,45
-0,40
-0,36
-0,28
-0,27
-0,25
-0,22
-0,14
-0,13
-0,09
-0,06
0
Sn4+ /Sn(s)
AgBr(s) /Ag(s)
S4 O62+ /S2 O32+
N iO(s) /N i(s)
CuCl(s) /Cu(s)
Sn4+ /Sn2+
Cu2+ /Cu+
SO42 /H2 SO3
S(s) /H2 S(g)
AgCl(s) /Ag(s)
Hg2 Cl2(s) /Hg()
As3+ /As(s)
Cu2+ /Cu(s)
Cu+ /Cu(s)
I3 /I
M nO4 /M nO42
H3 AsO4 /H3 AsO3
Hg2 SO4(s) /Hg()
I2(aq) /I
Cu2+ /CuBr(s)
SO32 /S2 O32
O2 /H2 O2
F e3+ /F e2+
Ag + /Ag(s)
Hg22+ /Hg()
N O3 /N O2
Hg 2+ /Hg()
HN O2 /N H4+
N O3 /N H4+
Hg 2+ /Hg22+
N O3 /HN O2
P d2+ /P d(s)
Br2(aq) /Br
Br2() /Br
P t4+ /P t(s)
ClO3 /HClO2
IO3 /I2(aq)
P t2+ /P t(s)
ClO4 /ClO3
0,05
0,07
0,08
0,12
0,12
0,15
0,16
0,16
0,17
0,22
0,27
0,30
0,34
0,52
0,54
0,56
0,56
0,61
0,62
0,65
0,67
0,69
0,77
0,80
0,80
0,83
0,85
0,86
0,87
0,91
0,94
0,99
1,05
1,06
1,15
1,18
1,19
1,19
1,20
Page -37-
Couple
(Ox > H2 O)
O2 /H2 O
M nO2(s) /M n2+
HBrO/Br
Cr2 O72 /Cr3+
Cl2(g) /Cl
ClO4 /Cl
Cl2(aq) /Cl
HClO/Cl
M n3+ /M n2+
M nO4 /M n2+
Au3+ /Au(s)
HClO2 /Cl
HClO/Cl2(g)
Au+ /Au(s)
P b4+ /P b2+
M nO4 /M nO2(s)
Ce4+ /Ce3+
H2 O2 /H2 O
Co3+ /Co2+
S2 O82 /SO42
O3 /O2
S2 O82 /HSO4
F2 /F
F2 /HF
Eo (V )
1,23
1,23
1,34
1,36
1,36
1,39
1,39
1,50
1,50
1,51
1,52
1,58
1,63
1,68
1,69
1,70
1,74
1,76
1,84
1,96
2,07
2,08
2,87
3,05
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.2 Piles lectrochimiques
5.2.5 lectrode de Calomel Satur(E.C.S)(Hg2 Cl2 /Hg)
Llectrode au calomel est llectrode de rfrence
la plus couramment utilise. Le calomel est lancien terme dsignant le chlorure de mercure I ;
Hg2 Cl2 . Le systme lectrochimique de llectrode
est constitu de : Hg/Hg2 Cl2 /Cl , KCl satur. Le
potentiel de cette lectrode est : Eo = 0, 244 V
25o C, dans KCl satur. Eo = 0, 282 V dans KCl 1M.
Et Eo = 0, 334 V dans KCl 0,1M. Cette lectrode
est utilise comme lectrode de rfrence pour
les dosages pH-mtriques et pour la plupart des
dosages potentiomtriques excepts ceux o les
ions chlorures seraient susceptibles de ragir
avec un compos prsent dans la solution, comme
avec les ions Ag + avec lesquels les ions chlorures
forment un prcipit, AgCl, dans quel cas on
utilisera une lectrode au sulfate mercureux.
quation scrit : Hg2 Cl2 + 2e
2Hg() + 2Cl
Symbolise par : P t|Hg() |Hg2 Cl2 (s)
Remarque :
Il existe autres lectrodes :
lectrode de verre (utilis pour la mesure du pH)
lectrode combin
Llectrode chlorure dargent
lectrode du sulfate mercureux
5.2.6 Formule de Nerst
Soit le couple ox/red du mme couple :
ox + n e
red
Le potentiel E de cette lectrode est donn par la formule de NERST .
E(ox/red) = Eo (ox/red) +
a (ox)
RT
ln
nF a (red)
T la temprature absolue (K).
R la constante des gaz parfaits.(R = 8.314 JK 1 mo.1 )
F = NA e = 96480 C mo.1 le Farad.
n le nombre dlectrons changs.
a sappelle lactivit qui reprsente pour :
Gaz
a = P (pression)
CPGE/Bni Mellal
Page -38-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.3 Prvision dune raction redox
La phase condens pure sous 1 bar
a=1
Les soluts dilus (ioniques ou molculaires) et sous un bar
a(X) = [X]
5.3 Prvision dune raction redox
Soit la pile :
- red1 |ox1 ||ox2 |red2 +
On a :
Ox2 + n2 e
red2
red1
Ox1 + n1 e
Lquation de la raction :
E2
E1
n1 ox2 + n2 red1
n1 red2 + n2 ox1
Le quotient de la raction Qr est donn par :
Qr =
an2 (ox1 )an1 (red2 )
an1 (ox2 )an2 (red1 )
Appliquons la loi de NERST pour chaque demi quation :
a(ox2 )
RT
a(ox1 )
RT
ln
;
E1 = Eo1 +
ln
E2 = Eo2 +
n2 F a(red2 )
n1 F a(red1 )
On tire que :
E = Eo2 Eo1
RT
ln Qr
n1 n2 F
On pose :
Eo = Eo2 Eo1
on conclut que
E = Eo
RT
ln Qr
n1 n2 F
A lquilibre (la pile ne dbite aucun courant) alors E2 = E1 et Qr = K do :
Eo =
CPGE/Bni Mellal
n1 n2 FEo
RT
ln K = ln K =
n1 n2 F
RT
Page -39-
-SAID EL FILALI-
CHIMIE DES SOLUTIONS-M.P.S.I
5.3 Prvision dune raction redox
Si T = 298K alors on aura
n1 n2 E o
n1 n2 E
log K =
= K = 10 0, 06
0, 06
o
Pour n1 = n2 = 1 on a :
Si Eo = Eo2 Eo1 > 0.25 = K > 1, 5.104 : la raction est quantitative dans le
sens direct.
Si Eo = Eo2 Eo1 < 0.25 = K < 104 : la raction est quantitative dans le
sens indirect .
Si 0, 25 < Eo = Eo2 Eo1 < 0.25 =quilibre.
CPGE/Bni Mellal
Page -40-
-SAID EL FILALI-
Vous aimerez peut-être aussi
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #1D'EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #1Pas encore d'évaluation
- Bac 2023 Physique-Chimie - Sujet - Jour 1Document14 pagesBac 2023 Physique-Chimie - Sujet - Jour 1LETUDIANT100% (5)
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2D'EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Pas encore d'évaluation
- Cours de Chimie Des Solutions F PDFDocument76 pagesCours de Chimie Des Solutions F PDFaziz120786% (7)
- Chimie Des SolutionsDocument65 pagesChimie Des SolutionsMOHAMMED ZAKARIA BAALIPas encore d'évaluation
- Exercices d'intégrales et d'équations intégro-différentiellesD'EverandExercices d'intégrales et d'équations intégro-différentiellesPas encore d'évaluation
- Chromatographie: Les Grands Articles d'UniversalisD'EverandChromatographie: Les Grands Articles d'UniversalisPas encore d'évaluation
- Exercices Et Problèmes CHIMIE - 1re Année MPSI PDocument261 pagesExercices Et Problèmes CHIMIE - 1re Année MPSI PZakariaElkatib100% (4)
- Cours Et Exercice Chimie Des Solution MR Hebbar Nordine PDFDocument103 pagesCours Et Exercice Chimie Des Solution MR Hebbar Nordine PDFNour El Houda100% (1)
- Olympiades Nationales de La Chimie - Annales Vol. 1Document240 pagesOlympiades Nationales de La Chimie - Annales Vol. 1Olympiades_Chimie100% (3)
- Sujets de Concours Physique Et Chimie 2014Document27 pagesSujets de Concours Physique Et Chimie 2014Yasser Dahbi100% (1)
- Exercices Corrigs de Chimie Organique en PDFDocument2 pagesExercices Corrigs de Chimie Organique en PDFKristen92% (13)
- Chimie en SolutionDocument27 pagesChimie en SolutionNabil holmes100% (3)
- Chimie en Solution PDFDocument27 pagesChimie en Solution PDFKhalid Zeg0% (1)
- H Prépa Chimie Exercices Et Problèmes MP by André Durupthy, Odile Durupthy, Alain JaubertDocument210 pagesH Prépa Chimie Exercices Et Problèmes MP by André Durupthy, Odile Durupthy, Alain JaubertAngela100% (1)
- Atomistique & Liaisons Chimique Deug s1Document75 pagesAtomistique & Liaisons Chimique Deug s1almohaydi89% (38)
- ThermochimieDocument9 pagesThermochimieAntes de Partir, A.C.Pas encore d'évaluation
- Thermochimie SMPC - TDDocument26 pagesThermochimie SMPC - TDoulaidPas encore d'évaluation
- Fascicule Chimie OrganiqueDocument65 pagesFascicule Chimie OrganiqueBacksland100% (1)
- Chimie Inorganique ExperiencesDocument61 pagesChimie Inorganique ExperiencesMakhloufi Med100% (1)
- Thermochimie CHAPITRE 4 - Enthalpie Libre - Equilibres Chimiques PDFDocument23 pagesThermochimie CHAPITRE 4 - Enthalpie Libre - Equilibres Chimiques PDFRafik DraPas encore d'évaluation
- Rich - Thermodynamique Chimique SMC4 - 2018 - VF PDFDocument107 pagesRich - Thermodynamique Chimique SMC4 - 2018 - VF PDFMariam Zouhair100% (1)
- ChimieDocument93 pagesChimieBoujemaa Bouhouda100% (3)
- Cours 1 Chimie Des SolutionsDocument14 pagesCours 1 Chimie Des SolutionsLoubna El JehouariPas encore d'évaluation
- Travaux Partiques TP Chimie 1 PDFDocument18 pagesTravaux Partiques TP Chimie 1 PDFOUSSAMA BOUTRIA100% (1)
- Exercices Corriges Chimie en SolutionDocument157 pagesExercices Corriges Chimie en SolutionKhalid Zeg83% (23)
- Chimie GénéraleDocument178 pagesChimie GénéraleBrave LionPas encore d'évaluation
- Chimie OrganiqueS3Document70 pagesChimie OrganiqueS3Akram OmariPas encore d'évaluation
- Chimie Organique Fonctionelle S5Document120 pagesChimie Organique Fonctionelle S5أمين حسونيPas encore d'évaluation
- Exercices Chimie Organique PDFDocument2 pagesExercices Chimie Organique PDFErinPas encore d'évaluation
- Nomenclature OrganiqueDocument10 pagesNomenclature Organiqueshadowkyllers89% (9)
- Cour de Chimie en SolutionDocument20 pagesCour de Chimie en SolutionIhsan Mokhlisse100% (28)
- Exercice Chimie Quantique PDFDocument2 pagesExercice Chimie Quantique PDFKarinaPas encore d'évaluation
- Exercices Corrigs Chimie Quantique PDFDocument2 pagesExercices Corrigs Chimie Quantique PDFJennifer20% (5)
- Exercices Organique Corrige WebDocument3 pagesExercices Organique Corrige WebGelo Ratouvo100% (1)
- Exercices Chimie en Solution PDFDocument2 pagesExercices Chimie en Solution PDFDenarius67% (6)
- Exercices Corrigs Nomenclature Chimie Organique PDFDocument2 pagesExercices Corrigs Nomenclature Chimie Organique PDFMarcus67% (9)
- Chapitre 4 - Benzènes Et Composés AromatiquesDocument12 pagesChapitre 4 - Benzènes Et Composés AromatiquesBeatrice Florin75% (4)
- Atomistique smpc1Document36 pagesAtomistique smpc1Prince Abdoo100% (2)
- La Chimie Des SolutionsDocument65 pagesLa Chimie Des SolutionsSoufiane Bahi100% (1)
- AtomistiqueDocument91 pagesAtomistiqueImadeddine Grouh100% (3)
- Thermochimie Et Cinetique PDFDocument84 pagesThermochimie Et Cinetique PDFBepito DikandaPas encore d'évaluation
- CHM 103 Equilibres en Solution Aqueuse Parcouurs Chimie Physique PDFDocument76 pagesCHM 103 Equilibres en Solution Aqueuse Parcouurs Chimie Physique PDFonuci100% (1)
- Intro Chimie OrganiqueDocument46 pagesIntro Chimie OrganiqueSam H. SalehPas encore d'évaluation
- Chimie Des Solutions - Chapitre 1Document19 pagesChimie Des Solutions - Chapitre 1Aziz DahhaPas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Chapitre 5 - PhénolsDocument8 pagesChapitre 5 - PhénolsBeatrice Florin100% (1)
- Chimie Des SolutionsDocument41 pagesChimie Des SolutionsAbdo Sahara100% (1)
- ChimieDocument47 pagesChimieHaitam El FathiPas encore d'évaluation
- Table Des Matières. Déplacement Des Équilibres Chimiques. S.Boukaddid Déplacement Des Équilibres Chimiques Spé MPDocument19 pagesTable Des Matières. Déplacement Des Équilibres Chimiques. S.Boukaddid Déplacement Des Équilibres Chimiques Spé MPhichamPas encore d'évaluation
- Equilibres Chimiques Et Électrochimiques en Solution Aqueuse (PDFDrive)Document163 pagesEquilibres Chimiques Et Électrochimiques en Solution Aqueuse (PDFDrive)Samah Soltane0% (1)
- Ece 22 PC 16Document6 pagesEce 22 PC 16fbdbhdPas encore d'évaluation
- CH6 Oxydo ReductionDocument3 pagesCH6 Oxydo ReductionkimPas encore d'évaluation
- CH5 CinetiqueDocument17 pagesCH5 CinetiqueMétuschélah Lagouth100% (2)
- Exercice Chimie Solution MPSIDocument32 pagesExercice Chimie Solution MPSIlink225100% (2)
- Tourism Statistics Total 2013M1-2022M1Document5 pagesTourism Statistics Total 2013M1-2022M1hanaaaaaaaaaePas encore d'évaluation
- Finde Voyage PTDocument13 pagesFinde Voyage PThanaaaaaaaaaePas encore d'évaluation
- TD 22014Document1 pageTD 22014yeyaaaPas encore d'évaluation
- 2TDI FF TH Principale Correction PDFDocument6 pages2TDI FF TH Principale Correction PDFhanaaaaaaaaaePas encore d'évaluation
- JLH A Exercices Resolus PDFDocument128 pagesJLH A Exercices Resolus PDFhanaaaaaaaaaePas encore d'évaluation
- M6a Equation Des OndesDocument5 pagesM6a Equation Des OndeshanaaaaaaaaaePas encore d'évaluation
- Exercices Série1Document2 pagesExercices Série1ayoubPas encore d'évaluation
- Série 1 Chimie Solutions 2022-2023Document2 pagesSérie 1 Chimie Solutions 2022-2023hamzaelm802Pas encore d'évaluation
- CEA-N 816: Rapport Semestriel Du Departement de ChimieDocument488 pagesCEA-N 816: Rapport Semestriel Du Departement de Chimietaki djPas encore d'évaluation
- AcidebaseDocument3 pagesAcidebaseabdelkrim salemPas encore d'évaluation
- Force Acide BaseexeDocument2 pagesForce Acide BaseexeAs Ma100% (1)
- 4 - Chimie TLeDocument52 pages4 - Chimie TLeAnas IsmailPas encore d'évaluation
- TP #1 TabDocument3 pagesTP #1 TabNarimane DendenPas encore d'évaluation
- 18 Acido TDDocument3 pages18 Acido TDtos yesPas encore d'évaluation
- Controle 1-2-1er Bac SM Semestre 2 (WWW - Pc1.ma)Document3 pagesControle 1-2-1er Bac SM Semestre 2 (WWW - Pc1.ma)Mohamed WidadPas encore d'évaluation
- Rev Ac Bas ConvertiDocument10 pagesRev Ac Bas ConvertiجعدبندرهمPas encore d'évaluation
- Chap6 Diagrammes EpH CorrDocument14 pagesChap6 Diagrammes EpH CorrDon RihazPas encore d'évaluation
- SMPC s2 CHP 2Document31 pagesSMPC s2 CHP 2Abdelhakim BailalPas encore d'évaluation
- Chapitre IIDocument28 pagesChapitre IIchaima sagiPas encore d'évaluation
- PolyacideDocument3 pagesPolyacideFrederic Wust100% (1)
- Solutions A Que UsesDocument81 pagesSolutions A Que UsesHabib FatimazahraPas encore d'évaluation
- 8 - Les Transformations Chimiques S'effectuant Dans Les Deux SensDocument10 pages8 - Les Transformations Chimiques S'effectuant Dans Les Deux Senspro alixPas encore d'évaluation
- Equilibre ChimiqueDocument42 pagesEquilibre ChimiqueTrekOff OfficielPas encore d'évaluation
- Programme STL CLPI Chimie Terminale 1993Document4 pagesProgramme STL CLPI Chimie Terminale 1993Kalosoiretrotchgmail.com KalosoPas encore d'évaluation
- Reactions Acido Basiques ExercicesDocument3 pagesReactions Acido Basiques ExercicesZineb ZahimPas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Chapitre Acide BaseDocument23 pagesChapitre Acide BaseFakoro Abdul Aziz Doumbia100% (1)
- 27 TD Chimie Termrnale C D Avril N°1Document2 pages27 TD Chimie Termrnale C D Avril N°1AnaëllePas encore d'évaluation
- Examen5 Réactivité Chimique FST-MeknèsDocument19 pagesExamen5 Réactivité Chimique FST-Meknèsyakubuojonugwa32Pas encore d'évaluation
- Offre de Formation BTS-Vol 2 BATIMENTDocument13 pagesOffre de Formation BTS-Vol 2 BATIMENTValentin Ignace MangaPas encore d'évaluation
- TP 2Document5 pagesTP 2Alßẙ Ǿff LłňếPas encore d'évaluation
- Réaction AB Indicateur DosageDocument5 pagesRéaction AB Indicateur DosageSk CissePas encore d'évaluation
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)