Académique Documents
Professionnel Documents
Culture Documents
Combustion PDF
Combustion PDF
Transféré par
Souley BirguiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Combustion PDF
Combustion PDF
Transféré par
Souley BirguiDroits d'auteur :
Formats disponibles
1er avril 2003
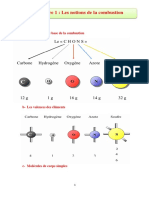
Les combustibles
344
13 Notions sur la combustion
Dans la plupart des cycles moteurs tudis au chapitre 9, les quantits de chaleur
ncessaires au fonctionnement du cycle sont obtenues par combustion
dhydrocarbures, c.--d. par des ractions chimiques doxydation exothermiques.
Ce chapitre est consacr lanalyse des systmes subissant de telles ractions
chimiques, sur base des premier et second principes. On se bornera considrer
des situations dquilibre, et par consquent, on nabordera pas les phnomnes
cintiques.
13.1 Les combustibles
On commencera par une brve prsentation des combustibles courants, savoir les
hydrocarbures. On peut les subdiviser en trois classes : le charbon, les
hydrocarbures liquides, et les hydrocarbures gazeux. On sintressera uniquement
ces deux dernires classes.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les combustibles
345
Les hydrocarbures liquides ou gazeux dusage courant sont des mlanges de
plusieurs hydrocarbures. Ainsi, lessence est un mlange denviron 40 hydrocarbures
principaux. Les hydrocarbures se divisent en plusieurs familles, dont les plus
importantes sont numres dans le tableau suivant.
Famille
Formule
Structure
saturs
Alcanes
Cn H2n+2
Acyclique
oui
Alcnes
Cn H2n
Acyclique
non
Alcynes
Cn H2n2
Acyclique
non
Cyclanes
Cn H2n
Cyclique
oui
Benzniques
Cn H2n6
Cyclique
non
Naphtalniques
Cn H2n12
Cyclique
non
Aromatiques
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les combustibles
346
Leur structure et leur caractre satur ou non sont illustrs ci-dessous.
Les alcools sont aussi parfois utiliss combustibles dans les moteurs combustion
interne. Ils se caractrisent par le fait quun des atomes dhydrogne est remplac
par un radical OH.
La plupart des hydrocarbures liquides sont obtenus par distillation et crackage du
ptrole brut. partir de ce dernier, on obtient donc une varit de combustibles
dont les plus communs sont lessence, le krosne, le gazole et le fuel lourd. Ils se
caractrisent par leur courbe de distillation, qui reprsente la temprature de la
fraction non vaporise en fonction de la proportion de vapeur condense.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les combustibles
347
On prfre souvent considrer les combustibles
liquides comme composs dun seul hydrocarbure. Ainsi, lessence est habituellement considre
comme de loctane C8 H18 , et le gazole comme du
dodcane C12 H26 .
Les combustibles gazeux proviennent principalement soit de gisements de gaz
naturel, soit de procds chimiques de fabrication. Le gaz naturel est constitu
principalement de mthane, contrairement aux gaz de transformation. On donne la
composition de quelques combustibles gazeux dans le tableau ci-aprs titre
indicatif.
Des efforts ont t entrepris au cours des vingt dernires annes pour valoriser
certains gisements de charbon ou de schistes bitumineux en produisant des
combustibles liquides ou gazeux partir de ceux-ci.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les combustibles
Gaz naturels divers
Constituant
Mthane
93,9
60,1
67,4
54,3
thane
3,6
14,8
16,8
16,3
Propane
1,2
13,4
15,8
16,2
Butane, etc.
1,3
4,2
348
Gaz de
Gaz leau
Gaz de
gazogne
carbur
four coke
10,2
32,1
thne
6,1
3,5
Benzne
2,8
0,5
14,0
40,5
46,5
50,9
2,9
8,1
0,6
0,5
0,8
CO
27,0
34,0
6,3
CO2
4,5
3,0
2,2
7,4
Hydrogne
Azote
3,0
7,5
5,8
Oxygne
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les ractions de combustion
349
13.2 Les ractions de combustion
13.2.1 quations chimiques de combustion
Les ractions de combustion, comme toutes les ractions chimiques, se font sans
variation de masse de chacun des lments. Les quations chimiques qui dcrivent
ces ractions doivent donc satisfaire cette contrainte. titre dexemple, les
ractions de combustion du carbone et du mthane sont respectivement
C + O2
CH4 + 2O2
CO2
(13.1)
CO2 + 2H2 O
(13.2)
On distingue dans une telle raction, les ractifs, qui subissent la raction, que lon
spare en combustible, qui est lagent rducteur, tel que ceux mentionns la
section prcdente, et comburant, qui est le corps contenant lagent oxydant, le
plus frquemment lair. Les produits de la combustion dhydrocarbures
comprennent du dioxyde de carbone (CO2 ) et de leau, qui selon les conditions de
pression et de temprature, pourra tre sous forme liquide ou vapeur.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les ractions de combustion
350
Pour un hydrocarbure compos uniquement de carbone et dhydrogne, de formule
C x Hy , la raction de combustion scrit
y
y
(13.3)
C x Hy + (x + ) O2 x CO2 + H2 O
4
2
La raction est dite complte si les gaz brls ne comprennent, outre les lments
inertes, que des produits compltement oxyds.
En ralit, plusieurs produits intermdiaires sont forms au cours dune combustion
relle. Comme on sintresse ici uniquement aux tats dquilibre initial et final, on
ne les considrera pas. Ils savrent nanmoins importants en pratique, en
particulier pour les problmes de pollution.
Dans la plupart des cas, comme on la mentionn prcdemment, le comburant
utilis est lair, plutt que loxygne pur. La composition de lair est
approximativement, en fractions molaires, 21% doxygne, 78% dazote, et 1%
dargon. Ces deux dernires substances sont supposes inertesa , et pour simplifier,
a En
ralit, aux hautes tempratures atteintes dans les moteurs volumtriques, lazote ragit avec
loxygne pour former des oxydes dazote, qui constituent une source de pollution.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les ractions de combustion
351
on considre que lair est compos de 21% doxygne et de 79% d azote
atmosphrique auquel on attribue une masse molaire fictive pour tenir compte de
la prsence dargon. La raction de combustion dun hydrocarbure avec lair devient
donc
79
y
y
79
y
y
C x Hy + (x + ) O2 + (x + ) N2 x CO2 + H2 O + (x + ) N2
4
21
4
2
21
4
(13.4)
13.2.2 Air thorique
La quantit minimale dair ncessaire la combustion complte dun combustible
est appele air strictement ncessaire ou encore air thorique.
Pour raliser la combustion complte avec lair thorique, il faudrait un mlange
parfait. En pratique, pour assurer la combustion complte, il faut un certain excs
dair. Celui-ci est caractris par le coefficient dair thorique
=
JJ J
air utilis
air thorique
Contents Back
I II
Notions sur la combustion
1er avril 2003
Les ractions de combustion
352
ou encore par le coefficient dexcs dair
E =1
Dans les moteurs volumtriques, on emploie galement la richesse , inverse du
coefficient dair thorique. Lquation de combustion complte dun hydrocarbure
avec excs dair devient
79
y
y
y
79
y
y
C x Hy +(x+ ) O2 + (x+ ) N2 x CO2 + H2 O+E(x+ ) O2 + (x+ ) N2
4
21
4
2
4
21
4
(13.5)
On utilise galement pour cararactriser le mlange de ractifs le rapport
air-combustible, le plus souvent en termes massiques, et son inverse, le rapport
combustible-air encore appel dosage dsign par le symbole .
Lorsque lair fourni est infrieur lair thorique, la combustion est incomplte. Si
le manque dair est faible, on observe la formation de monoxyde de carbone. Pour
des manques dair plus importants, il peut subsister des hydrocarbures imbrls, ou
du carbone sous forme de graphite (noir de fume).
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Lenthalpie de formation
353
13.3 Lenthalpie de formation
Lorsquon considre des systmes de composition chimique fixe, comme cela a t
le cas jusqu prsent, on peut sans inconvnient fixer arbitrairement la valeur de
lnergie interne ou de lenthalpie en un point de rfrence arbitraire. Ce nest plus
le cas en prsence de ractions chimiques.
Dans ce cas, il faut en effet fixer le point de rfrence de manire cohrente et
systmatique. On utilise gnralement comme conditions de rfrence une pression
de 0,1 MPa et une temprature de 25 Cb .
Considrons la combustion de carbone solide avec de loxygne dans un systme
ouvert stationnaire.
b Pour
les substances ltat gazeux, on considre en gnral un tat hypothtique de gaz parfait.
Comme on ne considre pas les effets de gaz rels dans ce cours, la distinction na pas lieu dtre
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Lenthalpie de formation
354
On suppose que les deux ractifs entrent dans la chambre de combustion ltat de
rfrence, et que le dioxyde de carbone form sort ltat de rfrence galement.
Si lon pouvait mesurer prcisment la quantit de chaleur cde, on obtiendrait
une valeur de q = 393 522 kJ/kmol de carbone.
Lquation chimique de raction tant
C + O2 CO2
le premier principe scrit
X
X
nC q =
n s h s
ne h e = nCO2 h CO2 nC h C nO2 h O2
P
La mesure de la chaleur change nous fournit donc la diffrence denthalpie entre
les produits et les ractifs aux conditions de rfrence. Supposons que lon attribue
une valeur nulle lenthalpie des corps simples. Alors, on en dduit que
q = h CO2
On appelle cette enthalpie du dioxyde de carbone considr comme gaz parfait
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Lenthalpie de formation
355
ltat de rfrence enthalpie de formation et on la dsigne par le symbole h 0f . Pour
le dioxyde de carbone, on a donc
h 0f = 393 522 kJ/kmol
Lenthalpie du dioxyde de carbone dans dautres conditions de pression et
temprature peut alors se calculer par
refp,T
T ) = h 0 + (h)
h(p,
f
(13.6)
Cette procdure peut sappliquer toute autre molcule compose. Lenthalpie de
formation de nombreuses substances est disponible dans la littrature (notamment
sur le site TESTCenter, module mlange de gaz parfaits).
Remarques complmentaires
1. Le concept denthalpie de formation a t dfini en termes de la chaleur
change lors dune raction chimique idalise. En ralit, lenthalpie de
formation est dtermine par application de la thermodynamique statistique.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Lenthalpie de formation
356
2. La validit de la convention par laquelle on attribue une valeur denthalpie nulle
aux corps simples ltat de rfrence repose sur le fait que la masse des
lments se conserve au cours dune raction chimique.
3. Lorsquun corps simple ou un compos peut exister sous plusieurs formes
ltat de rfrence, il importe de prciser la forme considre. Pour les corps
simples, la valeur nulle est associe la forme chimiquement stable ltat de
rfrence. Par exemple, loxygne peut exister sous forme monoatomique,
diatomique, ou triatomique (ozone). Comme cest la forme diatomique qui est
stable ltat de rfrence, cest cette forme quest attribue la valeur nulle.
4. Dans les tables thermodynamiques, on fournit deux valeurs pour lenthalpie de
formation de leau, lune pour leau ltat liquide, lautre pour leau ltat
hypothtique de vapeur. Il savre commode dutiliser la valeur ltat liquide
conjointement avec les tables thermodynamiques de leau, et la valeur ltat
de vapeur lorsquon emploie le modle de gaz parfait.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du premier principe
357
13.4 Analyse des systmes ractifs laide du premier principe
Lenthalpie de formation est particulirement utile pour lanalyse des systmes
ractifs, car les enthalpies des diverses substances peuvent sadditionner ou se
soustraire. Ainsi, pour un systme ouvert en rgime, le premier principe scrit
X
X
=
Q + W
n s h s
n e h e
P
o les n sont les dbits molaires des diverses substances. En divisant par n comb , on
obtient les grandeurs par kmol de combustible.
Dans la plupart des cas, les ractifs et les produits ne se trouvent pas dans ltat de
rfrence. Pour les solides ou les liquides, la variation dentalpie entre ltat
considr et ltat de rfrence sobtient partir de tables thermodynamiques.
Pour les gaz, avec lhypothse de gaz parfaits, on calculera les variations laide des
tables de gaz parfaits.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Temprature adiabatique de flamme
En dveloppant lexpression du premier principe, on obtient donc
X
X
0
s
e
=
Q + W
n s (h f + h)
n e (h 0f + h)
P
358
(13.7)
13.5 Temprature adiabatique de flamme
Soit une raction de combustion se produisant adiabatiquement, sans travail ni
variation dnergie cintique et potentielle. La temprature des produits dune telle
raction est appele temprature adiabatique de flamme ou de combustion. En
vertu des hypothses dabsence de travail et de variations dnergie cintique et
potentielle, il sagit de la temprature maximum qui peut tre atteinte pour les
ractifs donns.
Pour un combustible donn et des pression et temprature des ractifs donns, la
temprature adiabatique de flamme est maximale pour un mlange
stchiomtrique. La temprature adiabatique de flamme peut tre contrle par
lexcs dair utilis. On la calcule par application du premier principe (13.7) avec
= 0.
Q = W
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Enthalpie et nergie interne de combustion ; pouvoir calorifique
359
13.6 Enthalpie et nergie interne de combustion ; pouvoir calorifique
Lenthalpie de combustion est la diffrence denthalpie entre les produits et les
ractifs pour une combustion complte temprature et pression donnes, rfre
lunit de masse ou lunit molaire de combustible.
X
X
RP
1
h
0
0
e
s
n s (h f + h)
h RP =
ne (h f + h)
hRP =
(13.8)
ncomb P
M
comb
R
On fournit gnralement dans les tables les enthalpies de combustion aux
conditions normales (25 C, 0,1 MPa).
Lnergie interne de combustion est dfinie de manire semblable
X
X
1
0
0
u RP =
ne (h f + h pv)e
n s (h f + h pv) s
ncomb P
R
u RP
uRP =
Mcomb
(13.9)
Si lon considre tous les constituants gazeux comme parfaits, et les volumes des
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Enthalpie et nergie interne de combustion ; pouvoir calorifique
360
constituants liquides et solides ngligeables, alors
(nprod. gaz. nract. gaz. )
u RP = h RP RT
(13.10)
On utilise souvent les expressions chaleur de raction ou pouvoir calorifique, qui
dsignent la chaleur extraite de la chambre de combustion durant une combustion
temprature constante. Dans le cas dune combustion isobare, on a par le premier
principe que cette chaleur est gale loppose de lenthalpie de combustion. On
lappelle pouvoir calorifique isobare.
(PC) p,T = h RP
ou (PC) p,T = hRP
Dans le cas dune combustion volume constant, la chaleur change est gale
loppose de lnergie interne de combustion. On lappelle pouvoir calorifique
isochore.
(PC)v,T = uRP ou (PC)v,T = uRP
On distingue les pouvoirs calorifiques infrieur (PCI) ou suprieur (PCS) selon que
leau contenue dans les produits est sous forme de vapeur ou sous forme liquide.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Enthalpie et nergie interne de combustion ; pouvoir calorifique
361
Lorsquon calcule les pouvoirs calorifiques des hydrocarbures par les expressions
(13.813.9), on constate que lenthalpie de formation de lhydrocarbure contribue
faiblement. Considrant lquation chimique de combustion gnrale avec excs
dair (13.5), et compte tenu de ce que les enthalpies de formation de loxygne et
de lazote molculaire sont nulles, le pouvoir calorifique isobare aux conditions
normales vaut
y 0
y 0
0
0
(PC) = xh f,CO2 h f,H2 O + h f,Cx Hy xh f,CO2 h f,H2 O
2
2
(13.11)
don on dduit que
le pouvoir calorifique de tous les hydrocarbures de mme composition molaire
(ou massique) en C et H est identique en premire approximation, ce qui justifie
lutilisation de la notion de combustible moyen, et
le pouvoir calorifique est indpendant de la quantit despces inertes (azote)
prsentes, et de lexcs dair.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Le troisime principe de la thermodynamique et lentropie absolue
362
Le pouvoir calorifique est mesur exprimentalement par les dispositifs suivants :
Bombe de Mahler appareil dans lequel on ralise une combustion volume
constant avec condensation de la vapeur deau, dont on dduit le pouvoir
calorifique isochore. Convient pour les combustibles solides ou liquides.
Calorimtre de Junkers appareil dans lequel on ralise une combustion isobare en
systme ouvert stationnaire, dont on dduit le pouvoir calorifique isobare.
Convient pour les combustibles gazeux (voir laboratoire).
13.7 Le troisime principe de la thermodynamique et lentropie absolue
Pour pouvoir analyser les ractions chimiques du point de vue du second principe,
se pose, comme pour lapplication du premier principe, la question de ltat de
rfrence appropri pour les diverses substances prsentes. Pour rpondre cette
question, il est ncessaire dinvoquer le troisime principe de la thermodynamique,
formul la suite des travaux de Nernst et Planck, selon lequel
lentropie dun cristal parfait est nulle au zro absolu.
Ce principe fournit donc un point de rfrence absolu partir duquel on peut
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Le troisime principe de la thermodynamique et lentropie absolue
363
valuer lentropie dune substance. Lentropie dfinie de la sorte est dsigne sous
le nom dentropie absolue. On peut la dterminer exprimentalement par des
mesures calorimtriques ou laide de la thermodynamique statistique. Les
entropies absolues des solides et liquides aux conditions normales sont disponibles
dans la littrature (p.ex. livre de Van Wylen et al.). Elles sont dsignes par le
symbole s0 . Pour les gaz parfaits, lentropie absolue une pression p0 = 0, 1 MPa
est tabule en fonction de la temprature. On en dduit lentropie absolue une
pression quelconque par lexpression
!
p
s p,T = s0T R ln
p0
Pour les mlanges de gaz parfaits, on applique la relation (12.13)
!
X
X
yi p
sml =
yi si (T, pi ) =
yi ( s0iT R ln
)
p0
i
i
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du second principe
364
13.8 Analyse des systmes ractifs laide du second principe
On a tabli au chapitre 8 lexpression du travail rversible pour une transformation
de systme ouvert stationnaire en contact avec diverses sources de chaleur. En
labsence de variations dnergie cintique et potentielle, et de sources de chaleur
autres que lambiance, lexpression gnrale (8.11) devient
X
X
rv =
m
e (he T 0 se )
m
s (h s T 0 s s )
W
Dans le cas dune transformation avec raction chimique, cette expression devient,
pour un intervalle de temps donn
X
X
0
Wrev =
ne (h f + h T 0 s)e
n s (h 0f + h T 0 s) s
(13.12)
R
et lirrversibilit vaut, elle,
I=
n s T 0 ss
ne T 0 se Q
(13.13)
Pour une transformation telle que les ractifs et les produits soient en quilibre de
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du second principe
365
temprature avec lambiance, le groupe h T 0 s est gal lnergie libre de Gibbs,
de sorte quen labsence de variations dnergie cintique et potentielle, le travail
rversible devient
X
X
ne g e
n s g s
(13.14)
Wrev =
R
Examinons prsent la question du travail maximum qui peut tre effectu au cours
dune raction chimique, les ractifs tant temprature ambiante. Ce travail sera
obtenu si la raction est rversible et si les produits sont en quilibre de pression et
de temprature avec lambiance, et est donc donn par lexpression prcdente
(13.14), c.--d. quil est gal la diminution de lnergie libre de Gibbs.
Par consquent, le rendement exergtique dun dispositif destin produire du
travail au moyen dune combustion, comme un moteur volumtrique, sexprime
comme le rapport entre le travail rellement fourni et la diminution de lnergie
libre de Gibbs gRP . Or, la dfinition habituellement utilise du rendement est le
rapport entre le travail fourni et le pouvoir calorifique h RP . En pratique, comme
pour les hydrocarbures, g RP h RP , les valeurs sont trs proches.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du second principe
366
Illustrons les irrversibilits se produisant lors des combustions par un exemple.
Considrons la combustion isobare et adiabatique dthne (C2 H4 ) gazeux dans un
systme ouvert stationnaire avec un coefficient dair thorique de 400%, les ractifs
tant aux conditions normales. Lquation chimique gnrale de raction devient
dans ce cas particulier (x = 2, y = 4, = 4)
C2 H4 + 4(3) O2 + 4
79
79
(3) N2 2 CO2 + 2H2 O + 3(3) O2 + 4 (3) N2
21
21
Les donnes thermodynamiques des ractifs et des produits aux conditions
normales sont donnes au tableau ci-dessous :
M (kg/kmol)
h 0 (kJ/kmol)
f
0
s (kJ/kmolK)
C2 H4
O2
N2
CO2
H2 O
28,054
31,999
28,013
44,01
18,015
52 467
-393 522
-241 826
219,330
205,148
191,609
213,794
188,835
Commenons par calculer le pouvoir calorifique isobare (infrieur puisque leau sera
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du second principe
367
ltat de vapeur) aux conditions standard
(PCI) = h 0f,C2 H4 2h 0f,CO2 2h 0f,H2 O = 1 323 163 kJ/kmol
La temprature adiabatique de flamme sobtient par lexpression (13.7)
X
X
X
0
0
s (T ad )
e=
n s (h f + h)
ne (h f + h)
n s h s (T ad ) (PCI)
P
= [2h CO2 + 2h H2 O + 9h O2 + 45, 1h N2 ](T ad ) (PCI) = 0
Rsolvant itrativement cette quation, on trouve T ad = 1016 K. Remarquez que,
avec lhypothse de gaz parfaits, la temprature de flamme ne dpend pas
directement des pressions partielles des constituants.
Calculons prsent le travail rversible. Comme les constituants sont chacun leur
pression partielle de mlange, on calcule dabord les entropies de chaque
constituant sa pression partielle. On trouve
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du second principe
s0R (kJ/kmolK)
C2 H4
O2
N2
253,109
218,267
193,713
220,659
193,713
s0P (kJ/kmolK)
368
CO2
H2 O
241,810
216,851
et par consquent
Wrev
X
X
= (PCI) T 0 [ ne se
n s s s ] = 1 332 387 kJ/kmol
R
qui est effectivement trs proche du pouvoir calorifique, comme on la
prcdemment indiqu.
Lirrversibilit au cours de la transformation est donne par lquation (13.13) avec
Q = 0 puisquil sagit dune combustion adiabatique.
X
X
I=
n s T 0 ss
ne T 0 se = 672 625 kJ/kmol
P
c.--d. peu prs la moiti du travail rversible !
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
Analyse des systmes ractifs laide du second principe
369
On vrifie ce rsultat en calculant lexergie des produits :
X
JP =
I
n s [(h s h 0 ) T 0 ( ss s0 )] = 659 762 kJ/kmol = Wrev
P
Par consquent, si la suite de la combustion adiabatique, on ramenait les produits
lquilibre avec lambiance de manire rversible, le travail effectu ne serait
quenviron la moiti du travail qui pourrait tre effectu si la combustion tait
rversible, et donc le rendement exergtique dun moteur dans lequel se produirait
cette combustion isobare ne pourrait dpasser 50 %.
Se pose ds lors la question de la possibilit de raliser la raction chimique de
combustion de manire rversible. On peut sapprocher de la rversibilit au moyen
dun processus lectrochimique : la pile combustible. Le principe en est connu
depuis longtemps, mais jusquil y a peu, leur puissance spcifique (volumique,
massique) trs faible et leur cot lev les rservait des applications spciales. Des
recherches intensives rcentes entreprises notamment par les constructeurs
automobiles ont permis de faire des progrs spectaculaires, de sorte que lon peut
en entrevoir lapplication grande chelle moyen terme.
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
valuation des procds rels de combustion
370
13.9 valuation des procds rels de combustion
On caractrise lefficacit dun procd rel de combustion au moyen de divers
paramtres, selon lapplication considre.
Chambre de combustion (turbine gaz) Dans ce cas, si la combustion tait
complte et adiabatique, la temprature de sortie serait la temprature
adiabatique de flamme. En ralit, la combustion nest pas parfaite (formation
doxydes dazote p. ex.) et il se produit une perte de chaleur vers lambiance,
de sorte que la quantit de combustible ncessaire pour obtenir une
temprature donne est plus leve que pour une combustion complte et
adiabatique. On dfinit ds lors le rendement de combustion comb comme
comb =
rel
idal
(13.15)
Gnrateur de vapeur Dans ce cas, lobjectif est de transmettre un maximum de
chaleur la vapeur deau. On dfinit ds lors le rendement comme
JJ J
Contents Back
I II
Notions sur la combustion
1er avril 2003
valuation des procds rels de combustion
371
m
v (hv,s hv,e )
Q
gn. de vap. =
=
(13.16)
m
c (PCS)
m
c (PCS)
Moteur volumtrique combustion interne Pour un moteur, leffet utile est le
travail fourni. La manire logique de caractriser sa performance serait par
consquent demployer son rendement exergtique. En pratique toutefois, on
emploie plutt le rendement thermique th dfini comme
W
th =
m
c (PCS)
(13.17)
Comme on la dj soulign, comme la variation dnergie libre lors dune
combustion dhydrocarbures diffre peu de lenthalpie de combustion, le
rendement thermique ainsi dfini est fort proche du rendement exergtique.
On utilise galement cette dfinition pour caractriser le rendement global
dune turbine gaz ou dune centrale thermique vapeur. Comme on la
soulign la section prcdente, lirrversibilit de combustion contribue
grandement la faible valeur du rendement.
JJ J
Contents Back
I II
Notions sur la combustion
Vous aimerez peut-être aussi
- TD N°1 CombustionDocument4 pagesTD N°1 CombustionPaul Julbin NJOCK100% (1)
- BCM2502 Psrtie 1Document129 pagesBCM2502 Psrtie 1Afaf BesbasPas encore d'évaluation
- Examen de Structures en PlasticitéDocument5 pagesExamen de Structures en PlasticitéUrsula Joyce Merveilles Pettang Nana100% (1)
- TD 1Document8 pagesTD 1Houcem Eddine Mechri75% (4)
- TD 1 Combustion M1+corrigéDocument8 pagesTD 1 Combustion M1+corrigéKhaled Chaib100% (2)
- Chapitre 04 - Flammes Laminaires de Prémélange Et de DiffusionDocument29 pagesChapitre 04 - Flammes Laminaires de Prémélange Et de DiffusionFadi Guerrach0% (1)
- Calcul Des ChaudiéresDocument5 pagesCalcul Des ChaudiéresMourad Rabah100% (3)
- Rendement CombustionDocument15 pagesRendement CombustionSABAPas encore d'évaluation
- TD 1Document8 pagesTD 1Houcem Eddine Mechri75% (4)
- Memento F Annexe Production Eau PotableDocument63 pagesMemento F Annexe Production Eau PotableAnas BENCHIKH100% (1)
- Web Combustions ExDocument7 pagesWeb Combustions ExJawad HamritiPas encore d'évaluation
- Combustion - Chap 2 PDFDocument18 pagesCombustion - Chap 2 PDFAlekhya100% (2)
- COURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFDocument36 pagesCOURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFKone Ousmane100% (1)
- CombustionDocument14 pagesCombustionamouhcine100% (1)
- 3774-Cours Combustion Ue1 1011Document26 pages3774-Cours Combustion Ue1 1011abderrahimn100% (2)
- 09 Combustion Exerc6Document5 pages09 Combustion Exerc6KHAOULA AJLANEPas encore d'évaluation
- Chap 1Document104 pagesChap 1MOHNISHKUMARJHA50% (2)
- Combustion 1Document4 pagesCombustion 1Youssef100% (1)
- Chap 2 La CombustionDocument17 pagesChap 2 La CombustionmilanoaaPas encore d'évaluation
- Cours Combustions m1 enDocument18 pagesCours Combustions m1 enAla Edine BeroualPas encore d'évaluation
- Suite 2 Chapitre 1 CombustionDocument3 pagesSuite 2 Chapitre 1 CombustionJerusalem AbrahamPas encore d'évaluation
- Combustion Et CombustibleDocument52 pagesCombustion Et CombustibleAbdou EssamyPas encore d'évaluation
- Ostwald Exercices PDFDocument9 pagesOstwald Exercices PDFoverdose500Pas encore d'évaluation
- La CombustionDocument20 pagesLa CombustionPaul Julbin NJOCKPas encore d'évaluation
- Etude de Cas - CombustionDocument2 pagesEtude de Cas - CombustionDroidy Space100% (1)
- Exposé Chapitre 2 - Combustion1Document27 pagesExposé Chapitre 2 - Combustion1Mohamed SelmiPas encore d'évaluation
- Notions Combustibles Exercices Enonces PDFDocument8 pagesNotions Combustibles Exercices Enonces PDFHoussam HaddaniPas encore d'évaluation
- Machines Thermiques EMSEDocument185 pagesMachines Thermiques EMSELazhar RachdiPas encore d'évaluation
- Fours-Chaudieres CombustionDocument46 pagesFours-Chaudieres CombustionBichou DerresPas encore d'évaluation
- Cours Fours Et Chaudières - Partie 1Document11 pagesCours Fours Et Chaudières - Partie 1sbj100% (1)
- Travaux Diriges de Froid S2Document2 pagesTravaux Diriges de Froid S2Mustapha Elmaghraoui100% (1)
- Combustion ExoDocument2 pagesCombustion ExoSimo El AzaarPas encore d'évaluation
- Devoir SDocument3 pagesDevoir SMourad MatmourPas encore d'évaluation
- TD 2 2020Document4 pagesTD 2 2020Ralf Wolwerine0% (2)
- Chapitre 2 - EE Dans L'industrie-ChaudièreDocument55 pagesChapitre 2 - EE Dans L'industrie-Chaudièrees.aliasmPas encore d'évaluation
- Chapitre III Etude Theorique Et Calcul de RendementDocument17 pagesChapitre III Etude Theorique Et Calcul de RendementfaqdaniPas encore d'évaluation
- 1 - Considération Générales Sur La CombustionDocument52 pages1 - Considération Générales Sur La CombustionChikhi AyoubPas encore d'évaluation
- 4355 - Combustion - V1213Document72 pages4355 - Combustion - V1213Steve WanPas encore d'évaluation
- TD 3Document4 pagesTD 3NessiePas encore d'évaluation
- Série de TD 3 Et 4Document4 pagesSérie de TD 3 Et 4Mourad MatmourPas encore d'évaluation
- Série de TD 3 Et 4Document4 pagesSérie de TD 3 Et 4Mourad MatmourPas encore d'évaluation
- Série1 2 3 PDFDocument47 pagesSérie1 2 3 PDFAminePas encore d'évaluation
- Thermochimie 2020-1Document3 pagesThermochimie 2020-1Salima SouhilaPas encore d'évaluation
- Transfert de Chaleur Et de MasseDocument8 pagesTransfert de Chaleur Et de MassetounsimedPas encore d'évaluation
- Chapitre 1 Combustion Et CombustibleDocument79 pagesChapitre 1 Combustion Et CombustibleRyad AsmaPas encore d'évaluation
- Memoire FinalDocument61 pagesMemoire FinalarabnaceraPas encore d'évaluation
- Syllabus Fours Et Chaudières PDFDocument1 pageSyllabus Fours Et Chaudières PDFBeichaPas encore d'évaluation
- Chap 4 Inst. Cryo Linde 2021Document22 pagesChap 4 Inst. Cryo Linde 2021Abderrahmen MakhebiPas encore d'évaluation
- Travaux Diriges de ThermodynamiqueDocument8 pagesTravaux Diriges de ThermodynamiqueBhuvanPas encore d'évaluation
- Série N°4 - ThermochimieDocument2 pagesSérie N°4 - ThermochimieVonimaharavo Rasoanasoloniaina100% (4)
- Rendement D'un Four1Document2 pagesRendement D'un Four1Hamza OuniPas encore d'évaluation
- Travaux Dirigées Echangeur de ChaleurDocument6 pagesTravaux Dirigées Echangeur de ChaleurOumayma Hdioud100% (2)
- Pre CombustionDocument79 pagesPre Combustionyoussef100% (1)
- Chaudiere À Vapeur - 3Document19 pagesChaudiere À Vapeur - 3Ayoub Azhoum50% (2)
- Machines ThermiqueDocument82 pagesMachines Thermiqueelhoussain allamPas encore d'évaluation
- CHAPITRE 2 - Généralités Sur La CombustionDocument23 pagesCHAPITRE 2 - Généralités Sur La CombustionSamuel DotouPas encore d'évaluation
- Printing Combustion Et ChaudièreDocument1 pagePrinting Combustion Et ChaudièreSirineJamoussiPas encore d'évaluation
- TD CompressedDocument9 pagesTD Compressedhalima benaliPas encore d'évaluation
- Brayton Cycle PDFDocument31 pagesBrayton Cycle PDFBENCHADLI DJILLALI100% (1)
- Application Aux Machines ThermiquesDocument36 pagesApplication Aux Machines ThermiquesZakaria TwailaPas encore d'évaluation
- Conversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanD'EverandConversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanPas encore d'évaluation
- Modélisation Et Simulation Energétique Des BâtimentsDocument1 pageModélisation Et Simulation Energétique Des BâtimentsHoucem Eddine MechriPas encore d'évaluation
- Revue Pratique Des Logiciels SED - 2015-07-08 RevuDocument39 pagesRevue Pratique Des Logiciels SED - 2015-07-08 RevuHoucem Eddine MechriPas encore d'évaluation
- 01 Maghreb VF PDFDocument6 pages01 Maghreb VF PDFHoucem Eddine MechriPas encore d'évaluation
- 01 Maghreb VF PDFDocument6 pages01 Maghreb VF PDFHoucem Eddine MechriPas encore d'évaluation
- Tableau de Bord, Consommation de Combustibles PDFDocument9 pagesTableau de Bord, Consommation de Combustibles PDFHoucem Eddine MechriPas encore d'évaluation
- Chapitre 2 PfeDocument29 pagesChapitre 2 PfeHoucem Eddine MechriPas encore d'évaluation
- Photovol Tunesien 6 4Document13 pagesPhotovol Tunesien 6 4Houcem Eddine MechriPas encore d'évaluation
- Rapport ZaienbV03Document63 pagesRapport ZaienbV03Houcem Eddine MechriPas encore d'évaluation
- N°11-Checklist ÉclairageDocument1 pageN°11-Checklist ÉclairageHoucem Eddine MechriPas encore d'évaluation
- Sarl StatutsDocument10 pagesSarl StatutsÂm-DươngPas encore d'évaluation
- Modules - HVAC SystemsDocument11 pagesModules - HVAC SystemsHoucem Eddine MechriPas encore d'évaluation
- Circuit FrigorifiqueDocument48 pagesCircuit FrigorifiqueHoucem Eddine Mechri100% (1)
- Formation Eclairage ESF 2005 1Document20 pagesFormation Eclairage ESF 2005 1Houcem Eddine MechriPas encore d'évaluation
- TD Alcools TS2 BisDocument2 pagesTD Alcools TS2 Bism82d99h8bvPas encore d'évaluation
- Chapitre 2Document9 pagesChapitre 2saif boukraia2Pas encore d'évaluation
- M Triqui Cours de Biologie Cellulaire 2016-2017 PDFDocument105 pagesM Triqui Cours de Biologie Cellulaire 2016-2017 PDFRami Nadjm80% (5)
- Optimisation Des Paramètres Du Fonctionnement Des Filtres Presse Par Les Plans D'expérience - TIJANE KhalilDocument52 pagesOptimisation Des Paramètres Du Fonctionnement Des Filtres Presse Par Les Plans D'expérience - TIJANE KhalilFouad AdoumazPas encore d'évaluation
- C9620 ST607 Rev.0Document28 pagesC9620 ST607 Rev.0Joseph MidouPas encore d'évaluation
- Presentation P.P. Cours ExplosimetrieDocument37 pagesPresentation P.P. Cours ExplosimetrieSaberDjetPas encore d'évaluation
- Geologie de Combustible SolideqDocument11 pagesGeologie de Combustible SolideqAltess MvulaPas encore d'évaluation
- Construction Métallique - 4 PDFDocument26 pagesConstruction Métallique - 4 PDFBadr ChattahyPas encore d'évaluation
- Exploitation Des Propriétés Adsorbantes de La VermiculiteDocument93 pagesExploitation Des Propriétés Adsorbantes de La Vermiculiteعبد الصمد بوالعيشPas encore d'évaluation
- Memoire de Fin D'etudes FinalDocument82 pagesMemoire de Fin D'etudes FinalIdriss CissePas encore d'évaluation
- Thermistance Et ThermocoupleDocument8 pagesThermistance Et ThermocoupleAssem BensalemPas encore d'évaluation
- Henry Thonier Projet de BA PDFDocument133 pagesHenry Thonier Projet de BA PDFYoussef MalajatiPas encore d'évaluation
- CH IV RevetementsDocument19 pagesCH IV RevetementsWalid Ben AmirPas encore d'évaluation
- Manipulation n1 1176824959876Document4 pagesManipulation n1 1176824959876Besma TTMPas encore d'évaluation
- 2022 CentresEtrangers2 J2 ExoC Sujet PileLithium 5ptsDocument2 pages2022 CentresEtrangers2 J2 ExoC Sujet PileLithium 5ptsasakuma2006Pas encore d'évaluation
- Boukhalfa IkramDocument67 pagesBoukhalfa Ikramfatima BechouniPas encore d'évaluation
- 2009 Pondichery Exo2 Sujet ITER 5 5ptsDocument2 pages2009 Pondichery Exo2 Sujet ITER 5 5ptsManue KalonjiPas encore d'évaluation
- Rapport de StageDocument57 pagesRapport de Stageⵀⴰⵊⴰⵔ ⴰⴱ100% (2)
- Chapitre 1Document48 pagesChapitre 1HassanPas encore d'évaluation
- La Cellule 2021Document13 pagesLa Cellule 2021Morad FerrahPas encore d'évaluation
- 2méthodes de Séparation 2Document10 pages2méthodes de Séparation 2Bouguetaia YacinePas encore d'évaluation
- COURS PCT 3eme APCDocument32 pagesCOURS PCT 3eme APCFamille BangoupPas encore d'évaluation
- Youcef Et Al2014Document12 pagesYoucef Et Al2014Rafraf EzdinePas encore d'évaluation
- Remplir La Liste Des IngredientsDocument9 pagesRemplir La Liste Des IngredientsCesar Miguel JuniorPas encore d'évaluation
- 11Document2 pages11Hajar AttyPas encore d'évaluation
- M2 Envi 2021Document72 pagesM2 Envi 2021benamara AissaPas encore d'évaluation
- Grundfosliterature-5564462 14804398Document36 pagesGrundfosliterature-5564462 14804398mguissePas encore d'évaluation