Académique Documents
Professionnel Documents
Culture Documents
Le Propanoate de Méthyle CH3CH2COOCH3 Est Utilisé Dans L
Transféré par
Med AmmarTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Le Propanoate de Méthyle CH3CH2COOCH3 Est Utilisé Dans L
Transféré par
Med AmmarDroits d'auteur :
Formats disponibles
Le propanoate de méthyle CH3CH2COOCH3 est utilisé dans l’industrie alimentaire et dans les parfumeries
comme arome .
Dans le but d’étudier la réaction d’hydrolyse de cet ester avec l’eau, on réalise un mélange (M1) formé de
l’ester , d’eau et d’acide propanoique
A partir de ce mélange, on prépare dans dix tubes scellés par des réfrigérants à air numérotés de 1 à 10
contenant chacun n1= 0,02 mol de l’ester , n2 = 0,025 mol d’eau et n3 mol d’acide propanoique .
A t=0, 0n place les tubes dans une étuve maintenue à une température constante θ1 sauf le tube n°10 est
placé dans l’eau glacée.
A différents dates , on répète l’opération suivante :
Un tube est retiré de l’étuve, on le refroidit et on dose son contenu avec une solution de base forte de
concentration cB= 1mol.L-1 en présence du phénolphtaléine. A l’équivalence on note le volume V de la
solution de soude ajouté.
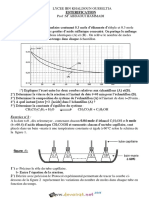
Ce qui a permis de tracer la courbe(1) V = f(t).
1°) a- En utilisant les formules semi développées, écrire l’équation de la réaction.
b-Pourquoi scelle-t-on les tubes ?
c –Dresser le tableau descriptif de la réaction dans chaque tube.
d- Ecrire l’équation de la réaction de dosage de l’acide par la base. Déduire une relation entre
l’avancement x de la réaction dans chaque tube et le volume V.
2°) A partir de la courbe et en le justifiant,
a- Préciser le ou les caractère (s) de la réaction mis (ent) en évidence.
b- Indiquer le volume V(10) de la solution de base nécessaire pour doser le contenu du tube n°10 placé
dans l’eau glacée.
3°) a- Montrer que n3= 10-2 mol .
b- Déduire la composition molaire d’un tube à la fin de la réaction étudiée.
4°) a- Définir un état d’équilibre.
b- Enoncer la loi d’action de masse .
c- Calculer la constante d’équilibre relative à la réaction d’hydrolyse étudiée.
5°) On réalise deux autres mélanges (M2) et (M3) identiques au mélange (M1).
Dans le mélange (M2) en ajoute l’acide sulfurique concentré de volume supposé négligeable.
Dans le mélange (M3) en ajoute l’acide propanoique absolue de volume V0.
On suit, à la température constante θ1 , la même démarche expérimentale effectuée avec le mélange (M1) .
Chaque tube scellé, contient initialement n1= 0,02 mol de l’ester , n2 = 0,025 mol d’eau ce qui a permis de
tracer les courbes (A) et (B).
a- attribuer , en justifiant , chaque courbe au mélange correspondant.
b-Calculer, à l’erat initial, la quantité de matière de l’acide propanoïque dans chaque tube préparé à
partir du mélange (M3).
c-calculer le volume V3 de la solution de base nécessaire pour doser le contenu d’un tube préparé à
partir du mélange (M3) et retiré de l’étuve à la fin de la réaction.
d- Calculer le volume V0 de l’acide propanoïque ajouté dans le mélange (M3) sachant que le volume
de chaque tube représente 1/100 du volume du mélange.
On donne Masse volumique de l’acide propanoïque ρ= 0,99 g.cm-3.
Masse molaire de l’acide propanoïque M= 74 g.mol-1.
Courbe 1 V(0) = 10 mL V(final) =15 ml
Courbe B V(0) = 11,2 mL V(final) = inconnu ( 14,8 ml) plus lente
Courbe A V(0) = 10,2 mL V(final) =15,2 ml plus rapide
Vous aimerez peut-être aussi
- Exercice 1 (7 Points) Propriétés D'un AlcoolDocument7 pagesExercice 1 (7 Points) Propriétés D'un AlcoolKeys of H.A.Pas encore d'évaluation
- Ester Bac Serie 1 202324 1 - 231116 - 153830Document4 pagesEster Bac Serie 1 202324 1 - 231116 - 153830deissemmhidhi3Pas encore d'évaluation
- 7 EsterificationDocument2 pages7 EsterificationsendibedPas encore d'évaluation
- TR Acidobasiques PCDocument11 pagesTR Acidobasiques PCalaeddinePas encore d'évaluation
- Serie Cinetique Chimique 2024Document2 pagesSerie Cinetique Chimique 2024Ferdinand MbayePas encore d'évaluation
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 pagesSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiPas encore d'évaluation
- Chimie PDFDocument6 pagesChimie PDFleilaPas encore d'évaluation
- Cours - Chimie ESTERIFICATION - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMIDocument2 pagesCours - Chimie ESTERIFICATION - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMIMohamed HamdenePas encore d'évaluation
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 pagesExercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeMoussa TraoréPas encore d'évaluation
- Serie4 (Ben Amor)Document1 pageSerie4 (Ben Amor)Malek BerrguebPas encore d'évaluation
- Magazine 17 Esterification PDFDocument5 pagesMagazine 17 Esterification PDFamal mansour0% (1)
- Série D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliDocument6 pagesSérie D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliOussémaM'solli0% (1)
- Serie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1Document4 pagesSerie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1yunuabou3Pas encore d'évaluation
- TD PH COUPLE-ACIDE-BASE 2016Document13 pagesTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréPas encore d'évaluation
- Bac CD ChimieDocument2 pagesBac CD ChimieRonel TsamenePas encore d'évaluation
- EquilibreQoutionReactionExercices 16-17 PDFDocument4 pagesEquilibreQoutionReactionExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Binaires 2Document8 pagesBinaires 2محمد الفاتح100% (1)
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 pagesExercice 1 (7 Points) Cinétique de La Décomposition de L'eau Oxygénéeأمال بلقاسم100% (1)
- Exercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéeDocument8 pagesExercice 1 (7 Points) Cinétique de La Décomposition de L'eau OxygénéefatimazahraPas encore d'évaluation
- Série N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Document4 pagesSérie N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Rams SoloPas encore d'évaluation
- Série N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Document4 pagesSérie N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Hiba JendoubiPas encore d'évaluation
- Examens de Chimie-1Document17 pagesExamens de Chimie-1Anas HajimPas encore d'évaluation
- TD Tampon 2024 LSLLDocument2 pagesTD Tampon 2024 LSLLAmadou Oury DialloPas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- bacCD Chimie 2006Document2 pagesbacCD Chimie 2006Haman Bello OumarouPas encore d'évaluation
- 2022 Asie J1 Exo1 Sujet BeerVin Ester Titrage 10pts - 0Document6 pages2022 Asie J1 Exo1 Sujet BeerVin Ester Titrage 10pts - 0GabrielPas encore d'évaluation
- Devoir de Contrôle N°1 Lycée Pilote - Physique - Bac Mathématiques (2011-2012) MR FekiriDocument5 pagesDevoir de Contrôle N°1 Lycée Pilote - Physique - Bac Mathématiques (2011-2012) MR FekiriDeadly TokyoPas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- Serie 5CDocument3 pagesSerie 5CTwansa WbattalaPas encore d'évaluation
- Le Vin Et Ses Composants Exercice 1 Obligatoire 10 Points Asie Sujet 1 2022 Specialite Physique ChimieDocument6 pagesLe Vin Et Ses Composants Exercice 1 Obligatoire 10 Points Asie Sujet 1 2022 Specialite Physique Chimienoha Abdel bassetPas encore d'évaluation
- Spe Physique Chimie 2022 1 PDFDocument18 pagesSpe Physique Chimie 2022 1 PDFabdallah kheirallahPas encore d'évaluation
- Bac Blanc ChimieDocument5 pagesBac Blanc ChimieMohamed SaidiPas encore d'évaluation
- Acide Base ExercicesDocument36 pagesAcide Base Exerciceschaari abdelouahadPas encore d'évaluation
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 pagesSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Exo T6liqvapDocument8 pagesExo T6liqvapجعدبندرهمPas encore d'évaluation
- Dosages Acide ConvertiDocument6 pagesDosages Acide ConvertiAbir SoujaaPas encore d'évaluation
- Exercices 1 Estérification Et Hydrolyse Des EstersDocument1 pageExercices 1 Estérification Et Hydrolyse Des EstersRedouane ElalamiPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- Dosage Acide Base IndicDocument3 pagesDosage Acide Base IndicAs Ma50% (2)
- Exercices 3 Estérification Et Hydrolyse Des EstersDocument1 pageExercices 3 Estérification Et Hydrolyse Des EstersRedouane ElalamiPas encore d'évaluation
- 16 REVISION CHIMIE (1er TRIMESTRE)Document4 pages16 REVISION CHIMIE (1er TRIMESTRE)Ilyes Ben Jemaa0% (1)
- Dosage Acide BaseDocument4 pagesDosage Acide BaseSaifeddine Makni0% (1)
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- Serie 2 ENSA 22-23Document2 pagesSerie 2 ENSA 22-23ismailPas encore d'évaluation
- Les Transformations Effectuent 2 SensJKDocument3 pagesLes Transformations Effectuent 2 SensJKsouukainazaarPas encore d'évaluation
- Serie 7 ChimieDocument6 pagesSerie 7 ChimieJabri ImenePas encore d'évaluation
- Série D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024Document3 pagesSérie D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024sassin2006Pas encore d'évaluation
- LACH1 Serie 2 2013Document2 pagesLACH1 Serie 2 2013Hassine WajihPas encore d'évaluation
- Binaires ExercicesDocument8 pagesBinaires Exercicesfsk100% (1)
- Serie Acides Forts Et Bases FortesDocument2 pagesSerie Acides Forts Et Bases Fortesawa96213Pas encore d'évaluation
- 21 PH Des Solutions Aqueuses 3Document2 pages21 PH Des Solutions Aqueuses 3Ilyes Ben JemaaPas encore d'évaluation
- Série 4 Esrérification 2021Document6 pagesSérie 4 Esrérification 2021safouen mejbriPas encore d'évaluation
- Exercices Et Problèmes PDFDocument71 pagesExercices Et Problèmes PDFsidi80% (5)
- 01 - 01 - Preparation Solutions TitreesDocument3 pages01 - 01 - Preparation Solutions TitreesEchafaiPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Spectre Fiche El1Document3 pagesSpectre Fiche El1Med AmmarPas encore d'évaluation
- Cours RLC LibreDocument10 pagesCours RLC LibreMed AmmarPas encore d'évaluation
- Exercice #3Document2 pagesExercice #3Med AmmarPas encore d'évaluation
- TP (Ébullition)Document1 pageTP (Ébullition)Med AmmarPas encore d'évaluation
- JL RobertDocument27 pagesJL RobertMed AmmarPas encore d'évaluation
- LC 21-080Document4 pagesLC 21-080Simon HoudePas encore d'évaluation
- RapportDocument25 pagesRapportMolka Ayechi100% (1)
- Td2 Trans StatiqueDocument5 pagesTd2 Trans Statiquesara100% (1)
- Le ZahirDocument3 pagesLe Zahirmounirnet100% (1)
- Le Figaro PDFDocument3 pagesLe Figaro PDFemilie dos santosPas encore d'évaluation
- Les Génies de La Science GaliléeDocument95 pagesLes Génies de La Science Galiléeuser scribd100% (2)
- Catalogue Reles ADocument44 pagesCatalogue Reles AMohammedPas encore d'évaluation
- Avoir Des Loisirs Dans Un Espace UrbainDocument2 pagesAvoir Des Loisirs Dans Un Espace UrbainonerPas encore d'évaluation
- RB SCCDDocument36 pagesRB SCCDsirovic90Pas encore d'évaluation
- Charles Lancelin - Comment On Meurt-Coment On Nait (Les Deux Pôles de La Vie) (FR) PDFDocument101 pagesCharles Lancelin - Comment On Meurt-Coment On Nait (Les Deux Pôles de La Vie) (FR) PDFViviane Tjiovas100% (1)
- Math Brevet 2019 2Document11 pagesMath Brevet 2019 2ddd75% (4)
- Mat2777 Examen Final H2020Document9 pagesMat2777 Examen Final H2020fahfaPas encore d'évaluation
- BAROKA Mémoire Tourisme 2016Document127 pagesBAROKA Mémoire Tourisme 2016Josué BAROKA100% (1)
- Preuve Ponctuelle Obligatoire Eps - Bac GT - Livret Candidat - Tennis de Table - 2024 15860Document6 pagesPreuve Ponctuelle Obligatoire Eps - Bac GT - Livret Candidat - Tennis de Table - 2024 15860moussaidiabdouPas encore d'évaluation
- Gestion Des Déchets 22223 1 PDFDocument101 pagesGestion Des Déchets 22223 1 PDFbehdenna riyanaPas encore d'évaluation
- Zaaf Kerrouche - 2020Document64 pagesZaaf Kerrouche - 2020OUSSAMA BEN OMARPas encore d'évaluation
- Sikadur® Injection LP: Fiche ProduitDocument3 pagesSikadur® Injection LP: Fiche Produitabdelali baaddouchPas encore d'évaluation
- Perception Et IllusionDocument3 pagesPerception Et IllusionSelma AddaPas encore d'évaluation
- Chapitre 3 - Présentation - Loi 13-83Document53 pagesChapitre 3 - Présentation - Loi 13-83BENHIBA WAFAEPas encore d'évaluation
- TD Solution SYSTEME ENDOMEMBRANAIREDocument2 pagesTD Solution SYSTEME ENDOMEMBRANAIREahmedPas encore d'évaluation
- Essai SPT Arvor 2010Document1 pageEssai SPT Arvor 2010Seif EddinePas encore d'évaluation
- Système de Pompage Solaire PFE 2020Document37 pagesSystème de Pompage Solaire PFE 2020issam hmaimessaPas encore d'évaluation
- Pancreatite ÉemDocument8 pagesPancreatite ÉemInfirmier Santé PubliquePas encore d'évaluation
- 3 - CCTP Ouvrage Oued GabesDocument14 pages3 - CCTP Ouvrage Oued GabesqsegaqgPas encore d'évaluation
- Introduction À La Prothèse Partielle FixeDocument42 pagesIntroduction À La Prothèse Partielle FixeBit CoyinPas encore d'évaluation
- 2 - Épreuve 02 - Le SéismeDocument3 pages2 - Épreuve 02 - Le SéismeLįllÿ LįllÿPas encore d'évaluation
- Axtem Mag PRINTEMPS 2012Document16 pagesAxtem Mag PRINTEMPS 2012MTS_47Pas encore d'évaluation
- CAT EASY Catalogue e Sy PDFDocument20 pagesCAT EASY Catalogue e Sy PDFReda NariPas encore d'évaluation
- TD 03 CorrigéDocument5 pagesTD 03 CorrigéTaimocha FatiPas encore d'évaluation
- MQS Science XIthDocument127 pagesMQS Science XIthKrishna KumarPas encore d'évaluation