Académique Documents
Professionnel Documents
Culture Documents
Serie4 (Ben Amor)
Transféré par
Malek BerrguebTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Serie4 (Ben Amor)
Transféré par
Malek BerrguebDroits d'auteur :
Formats disponibles
SERIE 4 LES EQUILIBRES CHIMIQUES 4èmeAnnée (S.
Ben Amor)
Exercice 1: On peut caractériser les ions fer III par la coloration rouge sang de l'ion FeSCN2+ que l'on obtient
lorsqu'on ajoute une solution de thiocyanate de potassium KSCN à une solution d'ion fer III.
1) Ecrire l'équation de la réaction modélisant cette transformation (K+ spectateur).
2) Enoncer la loi d’action de masse.
Donner l’expression de la constante d'équilibre K associée à cette équation.
3) A’ 100 mL d'une solution de FeCl3 de concentration molaire C= 10–2 mol.L–1, on ajoute une
millimole d'ions SCN– (aq) (sans variation sensible du volume).
Déterminer la quantité d'ion Fe3+ dans la solution à l'état d'équilibre sachant que K = 160.
Exercice 2 : On étudie la réaction en solution aqueuse à 37°C : ATP4– (aq) + AMP2– (aq) 2 ADP3– (aq)
de constante d'équilibre K = 25. (AMP : adénosine monophosphate, D : di et T : tri).
1) On part d'un mélange équimolaire d'ions ATP4– et AMP2–. Calculer le taux d'avancement final de la réaction.
2) On considère que le mélange réactionnel contient initialement uniquement de l' ADP3– de concentration
1,40.10–2 mol.L–1. Déterminer les concentrations des 3 espèces à l'état d'équilibre.
3) A ce système en équilibre, on ajoute 1,50.10–3 mol.L–1 de ATP4– et 1,50.10–3 mol.L–1 de ADP3–.
a) Dans quel sens, ce système va-t-il évoluer ?
b) Déterminer les concentrations des 3 espèces chimiques au nouvel état d'équilibre.
Exercice 3: On réalise l’estérification du méthanol par l’acide propanoïque.
1) Ecrire l’équation de la réaction d’estérification et donner sa fonction des concentrations.
2) On mélange 0,6 mol de l’acide (de densité d1 = 1,05) et 0,6 mol de l’alcool (de densité d2 =0,8)
en présence d'acide sulfurique H2SO4. Quel volume de chacun des réactifs a-t-on pris?
On donne (en g.mol–1) : H = 1 ; C = 12 et O = 16.
3) On divise ce mélange en plusieurs prélèvements identiques dans des tubes à essai qu'on fait sceller, puis
placer, à une date t0 =0, dans un bain marie bouillant. Après un temps t, on prend l'un des tubes, on lui
ajoute de l'eau glacée et 2 gouttes de phénolphtaléine, puis on dose l'acide restant par une solution de
soude NaOH de concentration CB. Soit VB le volume de soude ajouté à l'équivalence.
a) Préciser le rôle de l'acide sulfurique, de l'eau glacée et de la phénolphtaléine.
b) Ecrire l'équation de la réaction de dosage de l’acide propanoïque.
c) Soit VB0 le volume de soude ajouté pour le dosage fait à t0 =0. Exprimer la quantité x d'acide réagi
à la date t, en fonction de CB, VB et VB0.
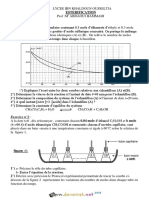
4) On donne la courbe n = f (t) avec n la quantité d’acide restant.
a) Quels caractères de l'estérification sont mis en évidence par
cette courbe ? Expliquer.
b) Déterminer les quantités initiales des réactifs.
Dresser le tableau d'évolution du système.
c) Calculer le taux d'avancement final de la réaction.
d) A quelle date, a-t-on un taux d'avancement de 50%.
Calculer la vitesse de la réaction à cette date.
e) Calculer la constante d’équilibre K de l'estérification.
5) On mélange, dans une 2ème expérience, 0,5 mol d’acide et 0,3 mol d’alcool.
a) Déterminer la composition du système à l’équilibre chimique.
b) Quel est le taux d'avancement final f de la réaction.
6) On mélange n0 mol d’acide avec 0,3 mol de cet alcool. Calculer n0 pour avoir f = 0,95.
Exercice 4: Pour réaliser l’hydrolyse de l’éthanoate de méthyle, on mélange 1,5 mol de cet ester avec
1mol d’eau.
1) Ecrire l’équation de l’hydrolyse et donner les noms des produits formés.
2) Dresser le tableau d'évolution du système. Calculer l'avancement maximal xm de la réaction.
3) Lorsque l'équilibre est atteint, on prélève le vingtième du volume du mélange et on dose l'acide formé
par une solution de soude de concentration CB = 2 mol.L–1. Le volume de soude ajouté à l'équivalence
est VB = 10,1mL. Calculer le taux d'avancement final de la réaction d'hydrolyse.
4) a- Donner la composition du système à l'équilibre dynamique.
b- Quel est le pourcentage d’ester hydrolysé à la fin de la réaction ?
c- Calculer la constante d’équilibre de cette réaction d'hydrolyse.
5) a- Calculer l'avancement x lorsque la fonction des concentrations de la réaction est = 0,1.
b- Quelle quantité d’acide faut-il ajouter pour que ce mélange n’évolue plus.
6) On mélange 1mol d’ester, 1mol d’eau, 1mol d’acide et 1mol d’alcool. Qu’obtient-on à l’équilibre ?
Vous aimerez peut-être aussi
- Ester Bac Serie 1 202324 1 - 231116 - 153830Document4 pagesEster Bac Serie 1 202324 1 - 231116 - 153830deissemmhidhi3Pas encore d'évaluation
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 pagesSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Série D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliDocument6 pagesSérie D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliOussémaM'solli0% (1)
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Série de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesDocument3 pagesSérie de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesأشرفالمبروكPas encore d'évaluation
- Série Loi Daction de MasseDocument2 pagesSérie Loi Daction de MasseimedPas encore d'évaluation
- Série Loi Daction de MasseDocument2 pagesSérie Loi Daction de Masseimed100% (1)
- Serie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1Document4 pagesSerie 2 Les Transformations S'effectuants en Deux Sens Etat D'equilibre (2) - 1yunuabou3Pas encore d'évaluation
- Tdtsen 15 (Physique-Chimie) : Academie D'Enseignement de San Lycee Public de SanDocument5 pagesTdtsen 15 (Physique-Chimie) : Academie D'Enseignement de San Lycee Public de SanAlassane TraorePas encore d'évaluation
- Série 1 - équilibre Chimique (WWW - Pc1.ma)Document6 pagesSérie 1 - équilibre Chimique (WWW - Pc1.ma)b01554837Pas encore d'évaluation
- Série Est-Hyd-Loi D'action de MasseDocument3 pagesSérie Est-Hyd-Loi D'action de Masseأسماء النخليPas encore d'évaluation
- Serie Ester 2023Document6 pagesSerie Ester 2023dhouabenrhoumaPas encore d'évaluation
- Série 5 Loi D'action de Masse 2022Document4 pagesSérie 5 Loi D'action de Masse 2022safouen mejbriPas encore d'évaluation
- TD Equilibre Chimique 2016Document4 pagesTD Equilibre Chimique 2016Oumar TraoréPas encore d'évaluation
- Yyy Suppexos cm4 cm5 Chimie Acides Bases PDFDocument16 pagesYyy Suppexos cm4 cm5 Chimie Acides Bases PDFKurosaki AimarPas encore d'évaluation
- Série 1 - Équilibre ChimiqueDocument6 pagesSérie 1 - Équilibre ChimiqueMed RT100% (1)
- Révision Equilibre ChimiqueDocument6 pagesRévision Equilibre ChimiquechadaPas encore d'évaluation
- Série N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Document4 pagesSérie N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Hiba JendoubiPas encore d'évaluation
- Magazine 17 Esterification PDFDocument5 pagesMagazine 17 Esterification PDFamal mansour0% (1)
- 16 REVISION CHIMIE (1er TRIMESTRE)Document4 pages16 REVISION CHIMIE (1er TRIMESTRE)Ilyes Ben Jemaa0% (1)
- TD TransfMat01-1Document4 pagesTD TransfMat01-1Chaymae OuahmanePas encore d'évaluation
- 2003 Pondichery Sujet Exo1 Esterification 6ptsDocument3 pages2003 Pondichery Sujet Exo1 Esterification 6ptsDaniela DinicaPas encore d'évaluation
- 7 EsterificationDocument2 pages7 EsterificationsendibedPas encore d'évaluation
- Acide Base ExercicesDocument36 pagesAcide Base Exerciceschaari abdelouahadPas encore d'évaluation
- Devoir de Contrôle N°1 Lycée Pilote - Physique - Bac Mathématiques (2011-2012) MR FekiriDocument5 pagesDevoir de Contrôle N°1 Lycée Pilote - Physique - Bac Mathématiques (2011-2012) MR FekiriDeadly TokyoPas encore d'évaluation
- Série+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFDocument21 pagesSérie+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFBen Salem Noureddine0% (2)
- Série D'exercices N°1 Lycée Pilote - Chimie - AVANCEMENT - Bac Sciences Exp (2018-2019) MR Mabrouki SalahDocument6 pagesSérie D'exercices N°1 Lycée Pilote - Chimie - AVANCEMENT - Bac Sciences Exp (2018-2019) MR Mabrouki SalahMôlkà Trabelsi0% (1)
- Examens de Chimie-1Document17 pagesExamens de Chimie-1Anas HajimPas encore d'évaluation
- Chimie PDFDocument6 pagesChimie PDFleilaPas encore d'évaluation
- TddeuxchimieDocument2 pagesTddeuxchimieZAguirPas encore d'évaluation
- Exercices Corriges Chimie en SolutionDocument157 pagesExercices Corriges Chimie en SolutionKhalid Zeg83% (23)
- Exercices 3 Estérification Et Hydrolyse Des EstersDocument1 pageExercices 3 Estérification Et Hydrolyse Des EstersRedouane ElalamiPas encore d'évaluation
- Bac 2015Document3 pagesBac 2015DaniokoPas encore d'évaluation
- Exercices PDFDocument4 pagesExercices PDFالغزيزال الحسن EL GHZIZAL Hassane100% (3)
- Série D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFDocument2 pagesSérie D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFAzizElheni100% (1)
- DS1 2022-2023 Sujet Corrige BaremeDocument10 pagesDS1 2022-2023 Sujet Corrige Baremearnaud.bedouinPas encore d'évaluation
- tp11 Evolution Spontanee D Un Systeme Chimique EleveDocument4 pagestp11 Evolution Spontanee D Un Systeme Chimique Elevemohamed laghribPas encore d'évaluation
- 2008 AmNord Exo1 Sujet ReactionsTotalesDocument2 pages2008 AmNord Exo1 Sujet ReactionsTotalesla physique selon le programme Français100% (1)
- Série N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Document4 pagesSérie N°4 Chimie Esterification 2013 2014 (Barhoumi Ezzedine)Rams SoloPas encore d'évaluation
- EXERCICES DE CHIMIE confinement 2Document4 pagesEXERCICES DE CHIMIE confinement 2yalhsankonPas encore d'évaluation
- 2006 - Contrôle 4Document1 page2006 - Contrôle 4Essaid AjanaPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- EquilibreQoutionReactionExercices 16-17 PDFDocument4 pagesEquilibreQoutionReactionExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2008 AmNord Exo1 Sujet ReactionsTotalesDocument2 pages2008 AmNord Exo1 Sujet ReactionsTotalesbaptlaser.fortnitePas encore d'évaluation
- Solutionaqueusechap 3TDDocument2 pagesSolutionaqueusechap 3TDzouzoumina680Pas encore d'évaluation
- 656b8f3dd2c85 - Serie Chimie N°8 Eq CHDocument2 pages656b8f3dd2c85 - Serie Chimie N°8 Eq CHbenkadriaaziz0Pas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- Olympiade-Chimie Maroc 2016 Serie 4Document4 pagesOlympiade-Chimie Maroc 2016 Serie 4mrPas encore d'évaluation
- AcademicaDocument4 pagesAcademicaJules Milson RazanajaoPas encore d'évaluation
- TD Chimie Analytique 1 Tms II Ngong 2023 - 2024Document8 pagesTD Chimie Analytique 1 Tms II Ngong 2023 - 2024Derquino YoumssiePas encore d'évaluation
- Loi de ModérationDocument2 pagesLoi de ModérationAhmed Ben Romdhane0% (1)
- Série D'exercices 4, État D'équilibre D'un Système Chimique, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID - Unlocked PDFDocument6 pagesSérie D'exercices 4, État D'équilibre D'un Système Chimique, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID - Unlocked PDFkhaled nawiPas encore d'évaluation
- Bestcours NS 28FDocument8 pagesBestcours NS 28Frobi jungkookPas encore d'évaluation
- Exercice 1 (7 Points) Propriétés D'un AlcoolDocument7 pagesExercice 1 (7 Points) Propriétés D'un AlcoolKeys of H.A.Pas encore d'évaluation
- TDchimiesol 1Document5 pagesTDchimiesol 1MyFeed ClubPas encore d'évaluation
- Equilibre ChimiqueDocument2 pagesEquilibre ChimiqueBoussetta ZouhaierPas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- Serie4 (Ben Amor)Document1 pageSerie4 (Ben Amor)Malek BerrguebPas encore d'évaluation
- FR ProjetDocument5 pagesFR ProjetMalek BerrguebPas encore d'évaluation
- Devoir de Contrôle N°2 2011 2012 (Sassi Lassaad)Document2 pagesDevoir de Contrôle N°2 2011 2012 (Sassi Lassaad)Malek BerrguebPas encore d'évaluation
- Série N°1 Cinématique de Translation 1 2010 2011 (Boussada Atef)Document2 pagesSérie N°1 Cinématique de Translation 1 2010 2011 (Boussada Atef)Malek Berrgueb100% (1)
- Devoir de Contrôle N°2 Correction 2019 2020 (MR Amine Touati)Document7 pagesDevoir de Contrôle N°2 Correction 2019 2020 (MR Amine Touati)Malek BerrguebPas encore d'évaluation
- Série N°4 Étude Cinématique de MVT de Translation 2010 2011 (Ben Amara Maher)Document2 pagesSérie N°4 Étude Cinématique de MVT de Translation 2010 2011 (Ben Amara Maher)Malek BerrguebPas encore d'évaluation
- Cinématique 1 2013 2014 (Affi Fethi)Document3 pagesCinématique 1 2013 2014 (Affi Fethi)Malek BerrguebPas encore d'évaluation
- Devoir de Synthèse N°3 - Sciences PhysiquesDocument3 pagesDevoir de Synthèse N°3 - Sciences PhysiquesHadhri HadhriPas encore d'évaluation
- Eau Purifiée: Aqua PurificataDocument3 pagesEau Purifiée: Aqua PurificataCreative Brain100% (1)
- Controle 1 S1 BACSEF Prof - Doumi (WWW - Pc1.ma)Document1 pageControle 1 S1 BACSEF Prof - Doumi (WWW - Pc1.ma)hajarelgouirtiPas encore d'évaluation
- C Gilbert - Exercice Essais Pressio Pieux Corrige-2Document22 pagesC Gilbert - Exercice Essais Pressio Pieux Corrige-2ishaq AllalPas encore d'évaluation
- TP Dosage PH MétriqueDocument2 pagesTP Dosage PH MétriqueAbidine CHAHIR100% (2)
- AspirineDocument14 pagesAspirinetareq derridaPas encore d'évaluation
- CE1. Cahiers. Luciole GUIDE de L ENSEIGNANT. Les. de La. A. Courdent D. DessobryDocument28 pagesCE1. Cahiers. Luciole GUIDE de L ENSEIGNANT. Les. de La. A. Courdent D. DessobryAbderrahim ADADIPas encore d'évaluation
- Catálogo Repuestos Agrícolas Campo AgrícolaDocument152 pagesCatálogo Repuestos Agrícolas Campo AgrícolaSergio MagañaPas encore d'évaluation
- Réaction D'estérification: Comment Augmenter Son Rendement?Document3 pagesRéaction D'estérification: Comment Augmenter Son Rendement?boustakatb0% (1)
- Chimie 2Document2 pagesChimie 2tcheva jokhanan Tiambi100% (1)
- Procedes de Transfert de La MatiereDocument8 pagesProcedes de Transfert de La Matiereben yahya ezzeddinePas encore d'évaluation
- TP4 Prépartion Du SavonDocument2 pagesTP4 Prépartion Du SavonTAKOUK HoudaPas encore d'évaluation
- DosageDocument6 pagesDosageDreamm AllPas encore d'évaluation
- MéthodesDocument3 pagesMéthodesZiad HabbounPas encore d'évaluation
- Devoir de Révision 3éme Tech 1ere TriDocument3 pagesDevoir de Révision 3éme Tech 1ere TriMohamed HamdenePas encore d'évaluation
- Master SiliciumDocument56 pagesMaster SiliciumMohamed EL FAGHLOUMIPas encore d'évaluation
- Cours Catalyse Cinétique en Catalyse Hétérogène A. BENAMARDocument53 pagesCours Catalyse Cinétique en Catalyse Hétérogène A. BENAMARLi NaPas encore d'évaluation
- Tp3 Chie AnalytiqueDocument71 pagesTp3 Chie AnalytiquesumaleePas encore d'évaluation
- Projet de Fin D'etudeDocument18 pagesProjet de Fin D'etudesararazali2015Pas encore d'évaluation
- Rapport de Projet Tutore s4Document8 pagesRapport de Projet Tutore s4Ęmm Blåčk-BøyPas encore d'évaluation
- Chapitre II (Partie1)Document4 pagesChapitre II (Partie1)Kenza BrahamiPas encore d'évaluation
- DistillationDocument51 pagesDistillationkhatibPas encore d'évaluation
- 2021 - GCH2525 - TD1Document6 pages2021 - GCH2525 - TD1Eya LamouchiPas encore d'évaluation
- Bulletin 014 02Document2 pagesBulletin 014 02AminPas encore d'évaluation
- Iso 3696 1987Document8 pagesIso 3696 1987ChérubinPas encore d'évaluation
- Serie 2 (2019-2020)Document6 pagesSerie 2 (2019-2020)samiraPas encore d'évaluation
- IB Chemistry 2020 Nov Paper 3 ANSDocument43 pagesIB Chemistry 2020 Nov Paper 3 ANSMONICA LOHPas encore d'évaluation
- Chapitre17-Composes OxygenesDocument3 pagesChapitre17-Composes OxygenesSoule Oueder100% (1)
- Correction ApplicationsDocument14 pagesCorrection Applicationsbilal.khelifiPas encore d'évaluation
- D'une: Cu SODocument2 pagesD'une: Cu SOThe KuuPas encore d'évaluation
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- Puissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéD'EverandPuissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéÉvaluation : 3.5 sur 5 étoiles3.5/5 (3)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- La Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeD'EverandLa Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeÉvaluation : 5 sur 5 étoiles5/5 (1)