Académique Documents
Professionnel Documents
Culture Documents
Série D'exercices 1, Transformations Rapides Et Transformations Lentes, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID
Transféré par
الغزيزال الحسن EL GHZIZAL HassaneTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Série D'exercices 1, Transformations Rapides Et Transformations Lentes, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID
Transféré par
الغزيزال الحسن EL GHZIZAL HassaneDroits d'auteur :
Formats disponibles
Pr : JENKAL RACHID Série d’exercices N° 1 Etablissement: AIT BAHA
Matière : Physique Transformations rapides et DP: CHTOUKA AIT BAHA
Niveau : 2 BAC , SM, PC , SVT , BIOF transformations lentes Année scolaire : 2019 / 2020
Exercice 1 : Réaction d’oxydoréduction
On met en contact une masse m1 = 2,00 g d’aluminium dans une solution d’acide chlorhydrique (H+ (aq), Cl-(aq) )
de concentration C1 = 1,00 mol.L-1 et de volume V1 = 100 mL. Il se dégage un gaz qui explose au contact de
l’oxygène de l’air (quand on enflamme ce mélange). On réalise les tests suivants en fin de réaction :
- un test au papier pH indique pH = 2,5, et il n’y a plus d’aluminium
- l’ajout d’une solution contenant des ions hydroxyde provoque la formation d’un précipité blanc d’hydroxyde
d’aluminium Al(OH)3.
1. Décrire l’état initial et final du système en indiquant les réactifs et les produits de la réaction.
2. Écrire l’équation chimique. Qui sont les ions spectateurs ?
3. Dresser le tableau d’avancement en faisant intervenir les ions spectateurs. Vous calculerez les quantités de
matière initiales des réactifs et vous écrirez leur valeur dans le tableau.
4. En déduire la valeur de xmax
5. Déterminer le volume de gaz V2 qui se dégage.
Données : M(Al) = 27,0 g.mol-1 ; Vm = 24,0 L.mol-1
Exercice 2 : Facteurs cinétiques
On réalise l’oxydation des ions iodures (aq) par les ions peroxodisulfate (aq) . Cette réaction ,lente et
totale , met en jeu les couples ox / red suivants : I2(aq) / I-(aq) et (aq) / S (aq)
1. Établir l’équation bilan de la réaction chimique
2. Afin d’étudier les facteurs cinétiques influant sur la durée de cette réaction, on réalise les 3 expériences
suivantes :
Expériences [ ] ( en mol .L-1 ) [ ] ( en mol .L-1 ) Température ( en °C )
1 2,0 .10-2 1,0 .10-2 20
-2 -2
2 4,0 .10 2,0 .10 20
-2 -2
3 4,0 .10 2,0 .10 35
3. Sans justifier, répondre par Vrai ou Faux aux affirmations suivantes :
3. 1 C’est dans l’expérience 2 que la vitesse de réaction est la plus faible
3. 2 Par comparaison entre les expériences 1 et 3 , on étudie l’influence de la température
3. 3 C’est dans l’expérience 3 que la vitesse de réaction est la plus grande
3. 4 Les ions iodure sont toujours en excès
3. 5 La quantité finale de diode formé dans l’expérience 2 est le double de celle formée dans l’expérience 1
Exercice 3 : l’effet de la concentration initiale des réactifs sur la vitesse de la réaction chimique
On réalise successivement les trois mélanges ci-dessous (pour chacun des trois mélanges, l'eau oxygéné est
introduite à l'instant t=0 s); dans les trois mélanges, l'acide sulfurique est en large excès.
Réactifs Mélange A Mélange B Mélange C
Acide sulfurique 0,1 mol/L 10 mL 10 mL 10 mL
Solution iodure 0,1 mol/L 18 mL 10 mL 10 mL
Eau oxygénée 0,1 mol/L 2 mL 2 mL 1 mL
Eau distillée 0 mL 8 mL 9 mL
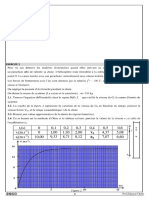
Le document ci-dessus donne les concentrations en diiode formé en fonction du temps.
Étude de l'état initial :
1. 1 Écrire l'équation de la réaction étudiée. On donne : I2(aq)/I-(aq) et
H2O2 (aq) /H2O(l)
1. 2 Calculer, la concentration molaire de l'eau oxygénée et des
ions iodure, pour chaque mélange.
Étude des courbes :
2. 1 Préciser (en justifiant) dans chaque cas le réactif limitant en
déduire pour chaque mélange, les concentrations finales en
diiode lorsque la réaction est terminée.
2. 2 Attribuer à chaque courbe numérotée le mélange
correspondant A, B ou C en justifiant.
2. 3 A t= 30 min, les réactions sont-elles terminées dans les trois cas ? Justifiez la réponse
Site : www.chtoukaphysique.com Gmail : prof.jenkalrachid@gmail.com Page 1
Vous aimerez peut-être aussi
- Exercices d'optique et d'électromagnétismeD'EverandExercices d'optique et d'électromagnétismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Examen Blanc SM FR 2020 2021Document8 pagesExamen Blanc SM FR 2020 2021Abderrazzak Elhaimer100% (1)
- Série 2 2 Bac SMDocument3 pagesSérie 2 2 Bac SMYns Frakchi92% (12)
- Corrigé Série 1Document5 pagesCorrigé Série 1Mohamed ECHAMAI100% (2)
- Cours Physique-Chimie 1bac BIOF .S1Document47 pagesCours Physique-Chimie 1bac BIOF .S1الغزيزال الحسن EL GHZIZAL Hassane100% (1)
- C9Chim Transformations Forcees PDFDocument2 pagesC9Chim Transformations Forcees PDFAzizElheni100% (1)
- Exem PCDocument6 pagesExem PCwfwgPas encore d'évaluation
- 13-Induction + Auto-Induction SGDocument2 pages13-Induction + Auto-Induction SGAnonymous hbpCoy4100% (1)
- Série D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument7 pagesSérie D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDRima El100% (2)
- Les Transformations Lentes Et Les Transformations Rapides Exercices Non Corriges 1Document2 pagesLes Transformations Lentes Et Les Transformations Rapides Exercices Non Corriges 1Faysal Douhdouh0% (2)
- Série D'exercices - Sciences Physiques Energie Cinétique - Les Alcools - 3ème Technique (2010-2011) MR Adam Bouali PDFDocument3 pagesSérie D'exercices - Sciences Physiques Energie Cinétique - Les Alcools - 3ème Technique (2010-2011) MR Adam Bouali PDFSaoussen Grolli75% (4)
- Welding InspectorDocument38 pagesWelding InspectorMalek RekikPas encore d'évaluation
- Acide Et Base - DosageDocument33 pagesAcide Et Base - Dosagemohamed saidi0% (1)
- Exercices 2 Les Lois de NewtonDocument1 pageExercices 2 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (5)
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Document3 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Ibtihel BoughanmiPas encore d'évaluation
- Blanc Taiba FBDocument8 pagesBlanc Taiba FBsine abdellah0% (1)
- Examen Blanc 2021 Physique Chimie SMDocument9 pagesExamen Blanc 2021 Physique Chimie SMTesteur MohammediaPas encore d'évaluation
- DS2 (05 03 10)Document9 pagesDS2 (05 03 10)Seif Souid100% (5)
- Examen Blanc N1Document8 pagesExamen Blanc N1Abdo H.LPas encore d'évaluation
- Devoir N 1SII 2021 Bac BiofDocument4 pagesDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Devoir N 1SII 2021 Bac BiofDocument4 pagesDevoir N 1SII 2021 Bac Biofالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Cours Chimie 1BACDocument43 pagesCours Chimie 1BACالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Série D'exercices 6, Dipôle RC, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID PDFDocument9 pagesSérie D'exercices 6, Dipôle RC, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHID PDFFadwa KouhraPas encore d'évaluation
- Travaux Dirigés D'induction N°3: Exercice 1: Rails de Laplace VerticauxDocument4 pagesTravaux Dirigés D'induction N°3: Exercice 1: Rails de Laplace VerticauxEL Ansari Jalal100% (1)
- Examen Blanc 4 - Final PDFDocument8 pagesExamen Blanc 4 - Final PDFAymane LchPas encore d'évaluation
- Examen - Blanc - 1 - SM - Biof 2020Document9 pagesExamen - Blanc - 1 - SM - Biof 2020Omar Erraji100% (3)
- Série N°1Document1 pageSérie N°1alae el jarmouniPas encore d'évaluation
- Examen Blanc SC Math Num 3Document10 pagesExamen Blanc SC Math Num 3Yasmine Ine100% (1)
- PilesDocument17 pagesPilesOthmane HassounPas encore d'évaluation
- Chute Libre Verticale D Un Solide Exercices Non Corriges 2 1Document4 pagesChute Libre Verticale D Un Solide Exercices Non Corriges 2 1Ahid ImadPas encore d'évaluation
- Cours de Renforcement: Série D'exercices Champ MagnétiqueDocument2 pagesCours de Renforcement: Série D'exercices Champ Magnétiquealphonse100% (1)
- Serie N°1 Avec Correction - Physique - Ondes Mécaniques Progressives - MR Zribi - SfaxDocument32 pagesSerie N°1 Avec Correction - Physique - Ondes Mécaniques Progressives - MR Zribi - SfaxIlyes Bouallagui0% (2)
- Examen Blanc n1 PC 2emebac PDFDocument9 pagesExamen Blanc n1 PC 2emebac PDFŤăhã ÊìîPas encore d'évaluation
- Série D'exercices N°14 - Physique La Diffraction - Bac Sciences Exp (2013-2014) MR BARHOUMI EzedineDocument4 pagesSérie D'exercices N°14 - Physique La Diffraction - Bac Sciences Exp (2013-2014) MR BARHOUMI EzedineAfef Afef0% (1)
- DC3 (19 04 08)Document6 pagesDC3 (19 04 08)Seif Souid100% (3)
- Série D'exercices Vitesse de RéactionDocument4 pagesSérie D'exercices Vitesse de Réactionothmane GbPas encore d'évaluation
- Ultrasons MétalDocument4 pagesUltrasons MétalAicha Daou100% (6)
- Exercice 30 Suivi Temporel D'une Transformation ChimiqueDocument5 pagesExercice 30 Suivi Temporel D'une Transformation ChimiqueMoulayMoulyPas encore d'évaluation
- Exercices Ondes Corriges PDFDocument7 pagesExercices Ondes Corriges PDFhocine100% (2)
- BIOF-Suivi Temporel D'une Transformation Et Vites 2018-ChajraouiDocument6 pagesBIOF-Suivi Temporel D'une Transformation Et Vites 2018-ChajraouiChajraouiAhmed50% (2)
- Série 1 - Les Réactions D'oxydo-RéductionsDocument20 pagesSérie 1 - Les Réactions D'oxydo-RéductionsMed Amine Hattaki100% (3)
- Contrôle 25Document3 pagesContrôle 25nabla199100% (1)
- Exercice 9 Suivi Temporel Dune Transformation ChimiqueDocument1 pageExercice 9 Suivi Temporel Dune Transformation ChimiqueCatuk Ella100% (2)
- Devoir 2 Hikma 2020 2bac SM Prof - Kraidy (WWW - Pc1.ma)Document4 pagesDevoir 2 Hikma 2020 2bac SM Prof - Kraidy (WWW - Pc1.ma)Majed Gharib100% (1)
- 2.0 Série Onde 2Document4 pages2.0 Série Onde 2frikha farahPas encore d'évaluation
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- Activité 1: Charge Et Décharge D'un Condensateur: ExploitationDocument5 pagesActivité 1: Charge Et Décharge D'un Condensateur: ExploitationFATIMA fatiii100% (2)
- Transformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1Document4 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Exercices Non Corriges 1 1boufdili0% (2)
- Série D'exercices #14 - Sciences Physiques PH Des Solutions Aqueuses - Oscillations Mécaniques Forcées - Bac Sciences Exp (2014-2015) MR Adam Bouali PDFDocument4 pagesSérie D'exercices #14 - Sciences Physiques PH Des Solutions Aqueuses - Oscillations Mécaniques Forcées - Bac Sciences Exp (2014-2015) MR Adam Bouali PDFDadati SouPas encore d'évaluation
- C1Phy Ondes Mecaniques ProgressivesDocument2 pagesC1Phy Ondes Mecaniques Progressiveskarimzid100% (1)
- Série D'exercices - Sciences Physiques Dipôle RC - Bac Technique (2011-2012) MR FRADIDocument2 pagesSérie D'exercices - Sciences Physiques Dipôle RC - Bac Technique (2011-2012) MR FRADIWiem Benchahboun0% (1)
- Série A. Fort A. Faible B.Forte. B. FaibleDocument2 pagesSérie A. Fort A. Faible B.Forte. B. FaibleJalel Belfelah0% (1)
- ' ' Premier Exercice (7 Points) Pendule Élastique HorizontalDocument6 pages' ' Premier Exercice (7 Points) Pendule Élastique HorizontalAli Rammal50% (2)
- 1 - Cinétique ProfDocument16 pages1 - Cinétique Profyahya chbaniPas encore d'évaluation
- Série de Révision (++corrigé) N°11 ..Spectres Atomiques PDFDocument7 pagesSérie de Révision (++corrigé) N°11 ..Spectres Atomiques PDFMoufida Zouaghi100% (1)
- Devoir 5 SM Biof Arsalan PDFDocument3 pagesDevoir 5 SM Biof Arsalan PDFMed BriniPas encore d'évaluation
- Série 1 - Dosage Acido-BasiqueDocument2 pagesSérie 1 - Dosage Acido-BasiqueAzdine MC100% (1)
- Devoir Surveillé #1 Semestre 1, 2BAC BIOF, SVT, SP Et SM, 2019-2020, PR JENKAL RACHID PDFDocument3 pagesDevoir Surveillé #1 Semestre 1, 2BAC BIOF, SVT, SP Et SM, 2019-2020, PR JENKAL RACHID PDFadder webPas encore d'évaluation
- Ahim NoureddineDocument4 pagesAhim NoureddineAlaoui Amine100% (1)
- Cours Onde Mecanique ProgressiveDocument4 pagesCours Onde Mecanique Progressiveياسين أوطالب100% (1)
- Les Reactions D Oxydo Reduction Exercices Non Corriges 2Document1 pageLes Reactions D Oxydo Reduction Exercices Non Corriges 2rihabPas encore d'évaluation
- Série D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Document8 pagesSérie D'exercices N°10 - Sciences Physiques Dosage Acido Basique - Bac Sciences Exp (2011-2012) MR ALIBI ANOUAR 3Tawfiq Weld EL Arbi75% (4)
- Chapitre 7, Transformations Spontanées Dans Les Piles Et Récupération de L'énergie, Activités, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDDocument3 pagesChapitre 7, Transformations Spontanées Dans Les Piles Et Récupération de L'énergie, Activités, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDaristide mabialaPas encore d'évaluation
- Serie N°1 Les Reactions D OxydoreductionDocument3 pagesSerie N°1 Les Reactions D OxydoreductionMahmoud Essahbi Sahbi Daghsni100% (1)
- 1 Revision FrancaisDocument5 pages1 Revision Francaisthe girlPas encore d'évaluation
- Serie 1 TransfoDocument2 pagesSerie 1 TransfoIbtissam AttaouanziPas encore d'évaluation
- Alcootest Et Oxydoreduction, Exercice de Chimie - 232424Document3 pagesAlcootest Et Oxydoreduction, Exercice de Chimie - 232424الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Physique 1 Et 2-Fi12999646Document58 pagesPhysique 1 Et 2-Fi12999646الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exos OMP CorrigesDocument6 pagesExos OMP Corrigesالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Travail Et Energie Cinetique Cours 2Document9 pagesTravail Et Energie Cinetique Cours 2Smove Oner100% (1)
- Exercices Qte de MatiereDocument5 pagesExercices Qte de Matiereالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2005 Reunion Correction Exo2 Ammoniac 6 5ptsDocument2 pages2005 Reunion Correction Exo2 Ammoniac 6 5ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercices Qte de Matiere2Document5 pagesExercices Qte de Matiere2الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- MECANIQUE en LIGNE - Exercice de Cinématique - TreuilDocument1 pageMECANIQUE en LIGNE - Exercice de Cinématique - Treuilالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2005 Antilles Spe Sujet Exo3 ModulationDocument2 pages2005 Antilles Spe Sujet Exo3 Modulationالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2010 Metropole Exo2 Correction Nucleaire Medecine 5 5ptsDocument2 pages2010 Metropole Exo2 Correction Nucleaire Medecine 5 5ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Evaluations CorrectionDocument6 pagesEvaluations Correctionالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Mouvement Particule Chargée MagnétiqueDocument6 pagesMouvement Particule Chargée Magnétiqueالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Les Lois de MecaniqueDocument13 pagesLes Lois de MecaniqueBordeauxMeknesAlamesPas encore d'évaluation
- Correction de Devoir SurveilléDocument2 pagesCorrection de Devoir Surveilléالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- C6 La Pile ElectrochimiqueDocument7 pagesC6 La Pile ElectrochimiquePecorellaPas encore d'évaluation
- Serie 10 Lois de Newton FBDocument5 pagesSerie 10 Lois de Newton FBالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Devoir SurveilléDocument3 pagesDevoir Surveilléالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Devoir Surveillé de Physique NucléaireDocument2 pagesDevoir Surveillé de Physique Nucléaireالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Devoir 2bacspf 11Document1 pageDevoir 2bacspf 11الغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Chapitre 11 Les Lois de NewtonDocument12 pagesChapitre 11 Les Lois de Newtonالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Chapitre3-Exercice Cinematique Dynamique NewtonDocument8 pagesChapitre3-Exercice Cinematique Dynamique Newtonالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Site TS C 08 Les PilesDocument9 pagesSite TS C 08 Les PilesPecorellaPas encore d'évaluation
- Chapitre 2 2011-2012 Les Piles ElectrochimiqueDocument8 pagesChapitre 2 2011-2012 Les Piles ElectrochimiqueHAMADA19720% (1)
- Les Piles PDFDocument38 pagesLes Piles PDFKONAN ABO PHILEMON ARONOU100% (1)
- Question Discussion Réponse: LimiteDocument19 pagesQuestion Discussion Réponse: Limiteالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercices Etat D Equilibre D Un Systeme ChimiqueDocument4 pagesExercices Etat D Equilibre D Un Systeme Chimiqueالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Cours M2 Distil Complexe PDFDocument26 pagesCours M2 Distil Complexe PDFAyoub Magroud100% (2)
- QCD-CHIMIE 2022 À 2007 PDFDocument6 pagesQCD-CHIMIE 2022 À 2007 PDFYacouba CamaraPas encore d'évaluation
- 06-Cinétique Enzymatique à Deux SubstratsDocument8 pages06-Cinétique Enzymatique à Deux SubstratsSlimkhane DzPas encore d'évaluation
- Présentation Du LogicielDocument8 pagesPrésentation Du LogicielBALKIS MGHAIETHPas encore d'évaluation
- Norme Marocaine: Qualité de L'eauDocument17 pagesNorme Marocaine: Qualité de L'eauYousri OfficePas encore d'évaluation
- Méthode Des ColiformesDocument21 pagesMéthode Des Coliformeskhaldi malikaPas encore d'évaluation
- Chap 3 AlcynesDocument24 pagesChap 3 AlcynesWahab HoubadPas encore d'évaluation
- PolycopieTP Chimie Orag - S4-2016Document16 pagesPolycopieTP Chimie Orag - S4-2016blaksitoPas encore d'évaluation
- Travaux Pratiques CorrosionDocument8 pagesTravaux Pratiques CorrosionFadwa AsriPas encore d'évaluation
- O.U TP1Document2 pagesO.U TP1Adel Adaika85% (13)
- C1 Diagrammes Potentiel PH TD PDFDocument12 pagesC1 Diagrammes Potentiel PH TD PDFNourchaine MadiouniPas encore d'évaluation
- Fragilisation Par Hydrogene For - b4 Lfor2Document2 pagesFragilisation Par Hydrogene For - b4 Lfor2pedro66Pas encore d'évaluation
- Pathologies Et Durabilité Des BétonsDocument30 pagesPathologies Et Durabilité Des BétonsMaxime AmiraultPas encore d'évaluation
- L'Opération de DégraissageDocument1 pageL'Opération de Dégraissagepedro66Pas encore d'évaluation
- 000586658 (1)Document88 pages000586658 (1)Imene ImenePas encore d'évaluation
- Cours Acides Carboxyliques Et DerivesDocument46 pagesCours Acides Carboxyliques Et Deriveswissal1111 blmPas encore d'évaluation
- Donnéés de Conception SORAZDocument93 pagesDonnéés de Conception SORAZharouna souley hega100% (1)
- Chapitre I.MatériauxDocument17 pagesChapitre I.MatériauxOuehnia tynaPas encore d'évaluation
- Sulfate D'ammonium Et de Fer (III)Document4 pagesSulfate D'ammonium Et de Fer (III)sumaleePas encore d'évaluation
- Devoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Document8 pagesDevoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Boubaker ChaabaniPas encore d'évaluation
- DS1 1bac S1 SM Prof - Izaran (WWW - Pc1.ma)Document7 pagesDS1 1bac S1 SM Prof - Izaran (WWW - Pc1.ma)alaebangui28122007Pas encore d'évaluation
- Acide and BaseDocument80 pagesAcide and BaseMBOTAKE LawsonPas encore d'évaluation
- Art19-1 9Document19 pagesArt19-1 9Bakhta ChPas encore d'évaluation
- Livre LABO CHIMIE PrepaDocument54 pagesLivre LABO CHIMIE PrepaJonas lumbuPas encore d'évaluation
- Moule D Injection Plastique 1705769404Document11 pagesMoule D Injection Plastique 1705769404Labzai YasSinePas encore d'évaluation
- Livret Révision 3éme Modfié-1Document20 pagesLivret Révision 3éme Modfié-1legogothe.1Pas encore d'évaluation
- Corrigé Type (1) (6837)Document3 pagesCorrigé Type (1) (6837)Dina DerichePas encore d'évaluation
- UntitledDocument30 pagesUntitledgamingo YTBPas encore d'évaluation