Académique Documents
Professionnel Documents
Culture Documents
Controle1 1bio10version2007
Transféré par
Kerherve JulienTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Controle1 1bio10version2007
Transféré par
Kerherve JulienDroits d'auteur :
Formats disponibles
Contrôle de Physique 1Bio
Date : 15 / 01 / 10 Durée : 1h
Barème : Exercice 1(9 points) ; Exercice 2 (5 points) ; Exercice 3 (6 points).
Toutes les calculatrices sont autorisées. Toute réponse sera convenablement justifiée
Sources : Alcan Rio Tinto – Laboratoire de génie chimique – CNRS – UPS – INPT
Exercice 1 :
Certaines prothèses de hanche sont en acier revêtu d’une couche d’alumine Al2O3. Cet oxyde d’aluminium
se forme naturellement et protège le métal. Mais cette couche ne fait que quelques microns d’épaisseur et
peut aisément être détériorée par action mécanique. Ainsi, on renforce la protection en augmentant
l’épaisseur d’alumine par électrolyse.
Dans les conditions standards, celle-ci se fait sous une forte intensité de 20 A en milieu acide. La pièce est
reliée à l’anode et on utilise une cathode en Aluminium solide. On donne l’équation bilan de ce dépôt :
2Al(s) + 3H2O(l) = Al2O3(s) + 3 H2(g)
1. Donner le schéma du montage en indiquant le sens du courant, le sens de déplacement des porteurs
de charge dans le circuit externe et les polarités des électrodes.
2. Quel type de réaction a-t-on à l’anode?
3. Donner la demi-équation de la réaction à la cathode.
4. Quels sont les mécanismes permettant la migration des espèces en solution ?
5. Que dire des potentiels d’équilibre Eeq en se plaçant dans les conditions standards ?
6. Représenter la courbe Intensité-Potentiel de cette électrolyse (on supposera qu’il n’apparait aucune
limite de diffusion)
7. Est-ce un système rapide ou lent ?
On souhaite faire un dépôt de 100 microns supplémentaires sur une prothèse d’une surface développée de 40
cm². Celui-ci correspond à une masse de 1,588 g et donc une quantité d’alumine de 1,557.10-5 moles.
8. En vous appuyant sur l’équation bilan, déterminer le nombre d’électrons mis en jeu. Etablir la
relation entre la quantité d’électrons et d’alumine. En déduire la quantité d’électrons échangée.
9. Quelle est la durée de traitement électrolytique de la prothèse ?
Données :
Les potentiels standards :
E°(H+ / H2) = 0,00 V ; E°(Al2O3/ Al3+) = – 1,66 V ; E°(O2 / H2O) = + 1,23 V
La surtension cathodique du plomb en solution acide ηc = – 0,30 V
La surtension anodique de l’aluminium en solution acide ηa = + 0,11 V
La masse volumique de l’alumine ρ = 3,97 g/cm3
Les masses molaires : M(H) = 1 g.mol-1 ; M(O) = 16 g.mol-1 ; M(Al) = 27 g.mol-1
Exercice 2 :
On considère toujours l’électrolyse
précédente. On constate une chute de la
circulation du courant après le début de la
transformation.
h
Celle-ci n’est pas due à un facteur cinétique
mais à un phénomène de « chute ohmique ».
Des bulles de dihydrogène « adhèrent » à
l’électrode et interdisent la bonne circulation
du courant comme le montre le schéma ci-
contre :
1. Le gaz est-il mouillant ou non mouillant sur l’électrode ?
2. Faut-il augmenter ou diminuer la mouillabilité pour favoriser la circulation du courant ?
On peut déterminer approximativement le coefficient de tension superficiel en fonction de la hauteur « h »
de la bulle :
h=
√2 γ +2 γ . cos( 180−θ)
ρg
On mesure la hauteur h = 300.10 m et les tables nous donnent la masse volumique de dihydrogène ρ =
-6
0,0899 kg/m3
3. Calculer le coefficient de tension superficielle du dihydrogène sur l’électrode.
4. Que dire de « h » si le gaz est parfaitement non mouillant. Y a–t-il une analogie avec la loi de
Laplace ?
Exercice 3 :
Un oscillateur peut être modélisé par un condensateur de capacité C et une inductance pure de valeur L = 25
mH. Dans le but de connaître la variation de l'intensité i du courant en fonction du temps, on place un
conducteur ohmique de faible résistance r dans le circuit. La tension observée aux bornes de r à
l'oscilloscope permet de déterminer i.
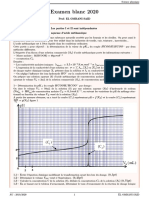
Sur l'écran de l'oscilloscope on observe i(t) avec un balayage horizontal de 25 µs / cm et une sensibilité de
déviation verticale de 2 mA / cm, on observe la courbe représentée ci-dessous.
1. Que dire des oscillations de ce système ?
2. Que pouvez-vous en déduire quant à la résistance r ?
3. Quelle est l’intensité circulant dans le circuit ?
4. Etablir l’équation différentielle du système en fonction de la tension du condensateur.
5. Donner l’expression de la tension aux bornes de la bobine. Que devient-elle lors de l’établissement
du régime permanent ?
Vous aimerez peut-être aussi
- Memotech Plus Electrotechnique PDF FRENCH - by Heraiz RachidDocument719 pagesMemotech Plus Electrotechnique PDF FRENCH - by Heraiz RachidHeraiz Rachid94% (47)
- Exercices d'optique et d'électromagnétismeD'EverandExercices d'optique et d'électromagnétismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Bac Mali Physique-Chimie-1Document85 pagesBac Mali Physique-Chimie-1Bourama100% (5)
- TD Electronique Fondamentale j1Document33 pagesTD Electronique Fondamentale j1halim otmane100% (3)
- 07 Cinétique de L'oxydo-RéductionDocument26 pages07 Cinétique de L'oxydo-RéductionMatis FellahPas encore d'évaluation
- Cours CompletDocument270 pagesCours Completأبو مارية محمد بغداديPas encore d'évaluation
- Devoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDocument8 pagesDevoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDadati Sou80% (5)
- Exem PCDocument6 pagesExem PCwfwgPas encore d'évaluation
- TD - Electrochimie - IUT Bobo Mai 2022Document5 pagesTD - Electrochimie - IUT Bobo Mai 2022Abdoul Kader OUATTARAPas encore d'évaluation
- LasombraDocument7 pagesLasombraKerherve JulienPas encore d'évaluation
- Akkari ds1Document5 pagesAkkari ds1Mhamed CherchariPas encore d'évaluation
- PilesDocument17 pagesPilesOthmane HassounPas encore d'évaluation
- Classification Des Principales Méthodes Électrochimiques D'analyse PDFDocument11 pagesClassification Des Principales Méthodes Électrochimiques D'analyse PDFFatima BenPas encore d'évaluation
- Bacc TC Com Physique ChimieDocument59 pagesBacc TC Com Physique ChimieAfrit Komt100% (2)
- ENSA2023 Phys ChemDocument4 pagesENSA2023 Phys Chembadrwadi55Pas encore d'évaluation
- Solutions TD PDFDocument24 pagesSolutions TD PDFKIAS Djahid100% (1)
- SalubriDocument11 pagesSalubriKerherve JulienPas encore d'évaluation
- Serie 4 Phy Corrigé 2TIDocument4 pagesSerie 4 Phy Corrigé 2TISofiane BenyettouPas encore d'évaluation
- Bacs Oblig 2009 Antilles Sept Sujet PDFDocument13 pagesBacs Oblig 2009 Antilles Sept Sujet PDFaa.aa1Pas encore d'évaluation
- lc28 Cinetique ElectrochimiqueDocument12 pageslc28 Cinetique ElectrochimiqueMohamed LamsaafPas encore d'évaluation
- 2010 09 Antilles Exo1 Sujet Zinc 6 5ptsDocument4 pages2010 09 Antilles Exo1 Sujet Zinc 6 5ptsPablo VidalPas encore d'évaluation
- Piles ElectrolyseursDocument6 pagesPiles Electrolyseursranaater008Pas encore d'évaluation
- Sec Minesponts 2010 Chi PSI - 2 PDFDocument8 pagesSec Minesponts 2010 Chi PSI - 2 PDFMag ManPas encore d'évaluation
- Dev 1 Sem2Document4 pagesDev 1 Sem2Mohamed MOUSSEPas encore d'évaluation
- Université Abdelmalek Essaâdi Ecole Nationale Des Sciences Appliquées D'al HoceimaDocument4 pagesUniversité Abdelmalek Essaâdi Ecole Nationale Des Sciences Appliquées D'al Hoceimalatifa aqchachPas encore d'évaluation
- LPro ElectroDocument23 pagesLPro ElectroYoussef Akr100% (1)
- N-2010 PC (F)Document6 pagesN-2010 PC (F)Sïmø EL Hãjøuï JřPas encore d'évaluation
- Devoir de Synthèse N°1 - Physique - Bac SC Exp Math (2009-2010) MR BLaaroussi MR L.Akkari.DDocument5 pagesDevoir de Synthèse N°1 - Physique - Bac SC Exp Math (2009-2010) MR BLaaroussi MR L.Akkari.DhammouazizPas encore d'évaluation
- Travaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreDocument4 pagesTravaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreAbderrahman IGHNIHPas encore d'évaluation
- Série Les PilesDocument4 pagesSérie Les Pilesookayokay15Pas encore d'évaluation
- Examen National Physique Chimie SPC 2010 Normale SujetDocument6 pagesExamen National Physique Chimie SPC 2010 Normale SujetŤăhã ÊìîPas encore d'évaluation
- Chimie C Chap11 ElectrolyseDocument5 pagesChimie C Chap11 Electrolysemghaete100% (1)
- ESTP Physique Chimie 2020Document6 pagesESTP Physique Chimie 2020Adam Akon DonzoPas encore d'évaluation
- TP 02 Vitesse D'hydratationDocument4 pagesTP 02 Vitesse D'hydratationNourhane KebirPas encore d'évaluation
- En PC Biof 2010 SNDocument6 pagesEn PC Biof 2010 SNEL MEHDI EL HAMDOUCHIPas encore d'évaluation
- Courant Electrique PDFDocument33 pagesCourant Electrique PDFMim MounaPas encore d'évaluation
- Examen National Physique Chimie SPC 2011 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2011 Normale SujetHassanHajjiPas encore d'évaluation
- Examen 2012Document5 pagesExamen 2012Nouvitch NouvitchePas encore d'évaluation
- Cci2 CorrigeDocument2 pagesCci2 CorrigerolandPas encore d'évaluation
- TP ElectrochromieDocument17 pagesTP Electrochromie123456789Pas encore d'évaluation
- Cours Electrolyse PilesDocument5 pagesCours Electrolyse PilesLeroy NafogoPas encore d'évaluation
- Ts08phc HTMDocument17 pagesTs08phc HTMssgPas encore d'évaluation
- Chapitre2 Lois de Faraday PDFDocument13 pagesChapitre2 Lois de Faraday PDFOussama El BouadiPas encore d'évaluation
- BAC 2013 DEVOIR DE SYNTHESE N°1 4éme SC Info Prof Daghsni SahbiDocument3 pagesBAC 2013 DEVOIR DE SYNTHESE N°1 4éme SC Info Prof Daghsni SahbiSahbi DaghsniPas encore d'évaluation
- 2000 13ForumDBO PDFDocument11 pages2000 13ForumDBO PDFMý ÇhãäìÿPas encore d'évaluation
- TSP1SP3Ch14T4-Ch14 Correction Exos p365 A 374Document7 pagesTSP1SP3Ch14T4-Ch14 Correction Exos p365 A 374hsebillalPas encore d'évaluation
- Electrochimie-Chapitre 1-R-KIHALDocument15 pagesElectrochimie-Chapitre 1-R-KIHALManar Smith100% (1)
- TPSaponifDocument3 pagesTPSaponifAnis SouissiPas encore d'évaluation
- Devoir 3è PCDocument2 pagesDevoir 3è PCAdams KOURAOGO100% (1)
- Devoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Document3 pagesDevoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Marouane AkkaPas encore d'évaluation
- Chimie Série 4 FBDocument10 pagesChimie Série 4 FBZayd Taibi0% (1)
- Devoir de Synthèse N°3 Avec Correction - Sciences Physiques - Bac Technique (2015-2016) MR Ridha SlimiDocument7 pagesDevoir de Synthèse N°3 Avec Correction - Sciences Physiques - Bac Technique (2015-2016) MR Ridha SlimiMeriam KooliPas encore d'évaluation
- TP03 S3N 2016-2017Document18 pagesTP03 S3N 2016-2017zalhatammadi18Pas encore d'évaluation
- Cours Corrosion - IC 2Document34 pagesCours Corrosion - IC 2thomas yapiPas encore d'évaluation
- SMC S5 Électrochimie Normale 2021Document3 pagesSMC S5 Électrochimie Normale 2021Bøũdįāf Khäwlå100% (1)
- 8199 E4 U41 Ab Bts TM 2013 Partie 1 SujetDocument6 pages8199 E4 U41 Ab Bts TM 2013 Partie 1 SujetChokri AtefPas encore d'évaluation
- TP CorrosionDocument8 pagesTP CorrosionSeghier HichemPas encore d'évaluation
- Chimie Chapitre4 ConductimetrieDocument4 pagesChimie Chapitre4 ConductimetrieSamira ElAllaouiPas encore d'évaluation
- PSI PHYSIQUE CCP 2 2005.extraitDocument4 pagesPSI PHYSIQUE CCP 2 2005.extraitzuxehigreini-3295Pas encore d'évaluation
- RapportDocument8 pagesRapportAbderrahman AmelougouPas encore d'évaluation
- RLCDocument12 pagesRLCالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Jauge de Déformation PDFDocument71 pagesJauge de Déformation PDFAlemPas encore d'évaluation
- TDEEG0304Document9 pagesTDEEG0304Prince Abdoo100% (2)
- SetitesDocument6 pagesSetitesKerherve JulienPas encore d'évaluation
- RavnosDocument9 pagesRavnosKerherve JulienPas encore d'évaluation
- TremereDocument54 pagesTremereKerherve JulienPas encore d'évaluation
- WW Armes A FeuDocument47 pagesWW Armes A FeuKerherve JulienPas encore d'évaluation
- VentrueDocument16 pagesVentrueKerherve JulienPas encore d'évaluation
- Controle 2-1BGB03Document1 pageControle 2-1BGB03Kerherve JulienPas encore d'évaluation
- Le Culte de CainDocument20 pagesLe Culte de CainKerherve JulienPas encore d'évaluation
- NosferatuDocument9 pagesNosferatuKerherve Julien100% (1)
- ElcairobynightDocument92 pagesElcairobynightKerherve JulienPas encore d'évaluation
- Controle 2-1BGB07Document1 pageControle 2-1BGB07Kerherve JulienPas encore d'évaluation
- Regress IDocument36 pagesRegress IKerherve JulienPas encore d'évaluation
- DS Final TEnsSciDocument3 pagesDS Final TEnsSciKerherve JulienPas encore d'évaluation
- Controle 1-1BGB07Document1 pageControle 1-1BGB07Kerherve JulienPas encore d'évaluation
- Controle 1-1BGB09Document1 pageControle 1-1BGB09Kerherve JulienPas encore d'évaluation
- Controle 1-1BGB06Document1 pageControle 1-1BGB06Kerherve JulienPas encore d'évaluation
- ToréadorDocument5 pagesToréadorKerherve JulienPas encore d'évaluation
- Controle 1-1BGB02Document2 pagesControle 1-1BGB02Kerherve JulienPas encore d'évaluation
- CappadociensDocument8 pagesCappadociensKerherve JulienPas encore d'évaluation
- Devoir Thème 2Document4 pagesDevoir Thème 2Kerherve JulienPas encore d'évaluation
- Controle2 1bio10version2007Document3 pagesControle2 1bio10version2007Kerherve JulienPas encore d'évaluation
- Exo de VacancesDocument2 pagesExo de VacancesKerherve JulienPas encore d'évaluation
- TP15 FPHDocument2 pagesTP15 FPHKerherve JulienPas encore d'évaluation
- Annexe ADocument5 pagesAnnexe AKerherve JulienPas encore d'évaluation
- TP18 InductionDocument5 pagesTP18 InductionKerherve JulienPas encore d'évaluation
- Analyse Statistiques Des RésultatsDocument18 pagesAnalyse Statistiques Des RésultatsKerherve JulienPas encore d'évaluation
- TP16 RLCDocument3 pagesTP16 RLCKerherve JulienPas encore d'évaluation
- TP18 Pont-ImpédanceDocument4 pagesTP18 Pont-ImpédanceKerherve JulienPas encore d'évaluation
- TP17 HystérésisDocument3 pagesTP17 HystérésisKerherve JulienPas encore d'évaluation
- Devoir de Contrôle N°2 - Sciences Physiques - 2ème Sciences Exp (2011-2012) Mlle Mhaouek SoniaDocument3 pagesDevoir de Contrôle N°2 - Sciences Physiques - 2ème Sciences Exp (2011-2012) Mlle Mhaouek SoniaAhmed Yassine HdhiriPas encore d'évaluation
- Sensepoint XCD TechMan MAN0873 Iss8 0913 FRDocument83 pagesSensepoint XCD TechMan MAN0873 Iss8 0913 FRAmiroucheBenlakehalPas encore d'évaluation
- Initiation A La Technologie SolaireDocument25 pagesInitiation A La Technologie SolaireGuerrier ChelotPas encore d'évaluation
- Mesures de RésistancesDocument4 pagesMesures de RésistancesSanaa HidanePas encore d'évaluation
- Diffusion ThermiqueDocument15 pagesDiffusion ThermiqueJoe NucodPas encore d'évaluation
- Chap 4Document88 pagesChap 4Ayoub BenPas encore d'évaluation
- Extrait 42270210Document64 pagesExtrait 42270210anwarPas encore d'évaluation
- Transporter de Lenergie Coute de Lenergie Enseignement Scientifique TerminaleDocument3 pagesTransporter de Lenergie Coute de Lenergie Enseignement Scientifique TerminaleOscar GregotPas encore d'évaluation
- Cours Et TD Propriètés ElectriquesDocument61 pagesCours Et TD Propriètés ElectriquesWiame NaimPas encore d'évaluation
- IncertitudesDocument10 pagesIncertitudesAchraf AABI100% (1)
- Calcul Theorique Du Barreau de CuivreDocument11 pagesCalcul Theorique Du Barreau de CuivreJulien MicoliPas encore d'évaluation
- Les CapteursDocument15 pagesLes Capteursaymendab100% (1)
- Cours de Mesures Electrques1Document12 pagesCours de Mesures Electrques1TOM MBOT Rhydel ArnoldPas encore d'évaluation
- SONDESDocument24 pagesSONDESMustapha EL Amine GHERDAINEPas encore d'évaluation
- Ppt-La Loi D'ohmDocument18 pagesPpt-La Loi D'ohmmohamed aoubyPas encore d'évaluation
- Conversion Electromagnetique StatiqueDocument16 pagesConversion Electromagnetique StatiqueAbdo Sahara100% (1)
- Reponse TD 3Document13 pagesReponse TD 3Kamal VerdePas encore d'évaluation
- Div de Tension Et Courant Et Theoreme de Theveninl PDFDocument2 pagesDiv de Tension Et Courant Et Theoreme de Theveninl PDFKadri MongiPas encore d'évaluation
- Chapitre Ii Objectifs Pedagogiques Et Stratégies D'enseignementDocument8 pagesChapitre Ii Objectifs Pedagogiques Et Stratégies D'enseignementAbderrahemane JiddouPas encore d'évaluation
- TD Le Moteur À Courant ContinuDocument2 pagesTD Le Moteur À Courant ContinuNasit MohammedPas encore d'évaluation
- Les Pertes Des TransfoDocument5 pagesLes Pertes Des TransfoOussama Mohammad MessadiPas encore d'évaluation
- Module Electricite GeneraleDocument60 pagesModule Electricite GeneraleTHONYPas encore d'évaluation
- Cours - Sciences Physiques Chap3 Récepteurs Passifs - 2ème Sciences (2011-2012) MR Sakhraoui NoureddineDocument4 pagesCours - Sciences Physiques Chap3 Récepteurs Passifs - 2ème Sciences (2011-2012) MR Sakhraoui NoureddineELPIG ELPIGPas encore d'évaluation
- ASD1Document32 pagesASD1Habib DhahriPas encore d'évaluation
- Dev23 24 2ieme SC MR Taoufik TrabelsiDocument2 pagesDev23 24 2ieme SC MR Taoufik Trabelsiعبد الفتاح الشقراويPas encore d'évaluation