Académique Documents
Professionnel Documents
Culture Documents
Chim
Transféré par
MetyTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chim
Transféré par
MetyDroits d'auteur :
Formats disponibles
2011
Chimie
TSI
2 heures Calculatrices autorisées
Toutes les données nécessaires à la réalisation de cette épreuve sont fournies en fin d’énoncé. Le problème est
constitué de deux parties complètement indépendantes.
Le soufre est un élément qui était déjà connu dans l’Antiquité. Il est présent dans plusieurs composés et, avec
le sel, la chaux, la houille, le pétrole, est l’une des matières premières de base de l’industrie chimique. Quatre-
vingt-cinq pour cent de sa production sert à la fabrication d’acide sulfurique, le reste étant utilisé sous forme
de soufre pur ou combiné dans, par exemple, les allumettes, les fongicides, les peintures, la poudre noire, les
médicaments ou la vulcanisation du caoutchouc.
I L’élément soufre et les sources naturelles de soufre
La production mondiale, qui vient en grande partie de gisements de soufre natif et, pour plus du quart, du gaz
naturel, des gaz industriels et du pétrole, a été au moins multipliée par 50 depuis le début du siècle. Le soufre
se trouve également en grande quantité, associé à d’autres éléments sous forme de sulfures et de sulfates.
I.A – Configuration électronique, isotopes stables du soufre
I.A.1) Donner la configuration électronique du soufre dans son état fondamental en énonçant les règles
utilisées. Préciser quels sont les électrons de cœur et ceux de valence.
I.A.2) En déduire les deux nombres d’oxydation les plus fréquemment rencontrés pour l’élément soufre.
I.A.3) Déduire de la question I.A.1 la place de l’élément soufre dans la classification périodique. Citer un
autre élément appartenant à la même colonne. Que pouvez-vous en déduire ?
I.A.4) Comment évolue l’énergie de première ionisation Ei des éléments au sein d’une même période ? Au
sein d’une même colonne ? Commenter brièvement.
Le soufre naturel est constitué de quatre isotopes stables dont deux présents en majorité : x% de l’isotope 32 S
et y% de l’isotope 34 S. La masse molaire de l’isotope 34 est de 33,968 g · mol−1 et celle de l’isotope 32 est de
31,972 g · mol−1 .
I.A.5) Calculer les pourcentages isotopiques x et y sachant que la masse molaire atomique du soufre est de
32,066 g · mol−1 et en supposant que les autres isotopes sont en quantité négligeable.
I.A.6) Une des structures du soufre moléculaire est cyclique et de formule brute S8 . Dans cette structure,
les angles S S S valent 107◦ .
a) Donner la structure de Lewis de S8 .
b) Commenter la valeur de cet angle en vous appuyant sur la méthode VSEPR.
I.B – Précipitation sélective de sulfures métalliques
Les sulfures métalliques font partie des principaux minerais de soufre.
Le sulfure d’hydrogène est un gaz très soluble dans l’eau. On fait buller du sulfure d’hydrogène H2 S(g) sous la
pression de 1,0 bar jusqu’à l’obtention d’une solution saturée. La concentration molaire de H2 S(aq) dans l’eau
est alors de C0 = 0,10 mol · L−1 .
À 1,0 L de la solution précédente, on ajoute (sans variation de volume) deux sels très solubles : 1,2 g de nitrate
de manganèse(II) Mn(NO3 )2(s) et 1,2 g de nitrate de fer(II) Fe(NO3 )2(s) . On peut faire varier le pH de la
solution par addition d’acide fort ou de base forte, tout en maintenant la saturation de H2 S(aq) en continuant
à faire buller H2 S(g) ; on admet donc que la concentration molaire en H2 S(aq) reste égale à C0 = 0,10 mol · L−1
indépendamment du pH obtenu.
I.B.1) Classer les sulfures métalliques susceptibles de précipiter par ordre de solubilité décroissante. Justifier
en vous appuyant sur les données numériques.
I.B.2) Écrire la condition de précipitation de chacun de ces solides.
I.B.3) Exprimer le pH de début de précipitation en fonction de pKs pour chacun des sulfures métalliques.
I.B.4) Effectuer l’application numérique pour chaque sulfure métallique et représenter les pH d’apparition
des précipités sur un axe gradué.
I.B.5) Dans quel domaine de pH doit-on se placer pour précipiter sélectivement au moins 99% de l’un des
ions sans faire précipiter l’autre ?
I.B.6) En déduire une méthode de séparation des cations métalliques considérés.
16 mai 2011 17:13 Page 1/4
II Dérivés oxygénés du soufre
II.A – Étude de quelques dérivés oxygénés du soufre
Considérons le dioxyde de soufre SO2 : c’est un gaz incolore, dense et toxique dont l’inhalation est fortement
irritante. Il est libéré dans l’atmosphère terrestre par les volcans. Produit par de nombreux procédés industriels,
il est soumis à des traitements chimiques pour en limiter les rejets dans l’atmosphère.
II.A.1) Donner la structure de Lewis de cette molécule, l’atome de soufre étant l’atome central. Proposer
alors une géométrie pour ce composé.
II.A.2) Que représente l’électronégativité d’un atome ? Comment évolue cette propriété dans une même
colonne de la classification périodique ? En déduire qui, de l’oxygène ou du soufre, est l’atome le plus électroné-
gatif.
II.A.3) Lorsque deux atomes différents sont liés par une liaison covalente, les électrons mis en jeu dans la
liaison peuvent être plus attirés par un atome que par l’autre. Il en résulte une charge partielle sur chacun des
atomes de la liaison et donc un moment dipolaire.
Représenter le vecteur moment dipolaire de la liaison soufre–oxygène.
II.A.4) Une molécule de plus de deux atomes peut posséder un moment dipolaire résultant de l’addition
vectorielle des moments dipolaires de chacune de ses liaisons. Le moment dipolaire mesuré du dioxyde de soufre
est de 1,65 D (Debye) avec 1 D = 0,333 × 10−29 C · m. L’angle des deux liaisons S O est α = 119◦ .
En déduire la valeur de la norme du moment dipolaire de liaison soufre-oxygène.
II.B – Préparation de l’acide sulfurique : procédé de contact
La matière première est le dioxyde de soufre SO2 . En 1891, BASF découvre un catalyseur efficace pour trans-
former le dioxyde de soufre en trioxyde de soufre SO3 : le pentoxyde de divanadium V2 O5 . La réaction mise en
jeu est l’oxydation du dioxyde de soufre par le dioxygène :
+ 1
SO2(g) 2 O2(g) = SO3(g)
II.B.1) Calculer la variance de cet équilibre dans le cas général, puis quand le dioxyde de soufre et le
dioxygène sont introduits en quantités stœchiométriques.
II.B.2) a) Grâce aux données thermodynamiques fournies en fin d’énoncé, calculer ∆r H10 (298 K),
l’enthalpie standard de cette réaction ainsi que ∆r S10 (298 K), l’entropie standard de réaction.
b) En supposant que l’enthalpie standard de réaction et l’entropie standard de réaction ne dépendent pas de
la température, exprimer alors ∆r G0 , l’enthalpie libre standard de réaction en fonction de la température T .
II.B.3) Lors de la synthèse industrielle du trioxyde de soufre par le procédé de contact, la réaction est
effectuée à 740 K en présence d’un catalyseur : le pentoxyde de divanadium.
La présence d’un catalyseur a-t-elle une influence sur la constante thermodynamique de l’équilibre ? Déterminer
la valeur de K 0 (740 K), la constante d’équilibre à 740 K.
II.B.4) Quelle est l’influence, sur l’état d’équilibre, d’une élévation de température à pression constante ?
II.B.5) Quelle est l’influence, sur l’état d’équilibre, d’une élévation de pression isotherme ?
II.B.6) On part d’un mélange comportant le même nombre de moles de dioxygène et de dioxyde de soufre.
Exprimer la constante d’équilibre K 0 (740 K) en fonction de la pression totale P et de α, rapport entre la
quantité de dioxygène ayant réagi et la quantité de dioxygène initiale. Calculer la pression totale P nécessaire
pour obtenir une valeur α = 0,45.
II.C – Titrage d’une solution d’acide sulfurique
II.C.1) Titrage pH-métrique et conductimétrique
L’acide sulfurique H2 SO4 est un diacide dont la première acidité est forte.
a) L’acide commercial utilisé est une « solution aqueuse » à 98% en masse de H2 SO4 , de masse volumique
1,84 g · cm−3 . Déterminer la valeur de la concentration molaire de l’acide sulfurique commercial.
b) Un volume V0 = 5,0 mL d’une solution aqueuse d’acide sulfurique est introduit avec 10 mL d’eau dans
un bécher. Cette solution est titrée par une solution aqueuse d’hydroxyde de sodium de concentration molaire
CB = 0,5 mol · L−1 . Le titrage est suivi par pH-métrie.
Quelle(s) électrode(s) est (sont) utilisée(s) avec le pH-mètre ?
c) Quels sont les acides présents, en quantités non négligeables, avant tout ajout de la solution titrante ?
Justifier avec soin votre réponse.
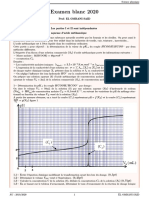
d) Une simulation de ce titrage est donnée figure 1. Attribuer à chacune des courbes les représentations
suivantes : pH = f (V ), %[HSO− 2−
4 ] = g(V ) et %[SO4 ] = h(V ).
16 mai 2011 17:13 Page 2/4
pH %C
15 100
90
Courbe 1
12 80
Courbe 3
70
9 60
50
6 40
30
Courbe 2
3 20
10
0 0
0 2 4 6 8 10 12 14 16 18 20 22 24
V (mL)
Figure 1 Titrage de l’acide sulfurique
e) En déduire la ou les réactions prépondérantes qui ont lieu avant l’équivalence. Déterminer la valeur de
leur constante d’équilibre à 25◦ C.
f) Quelle la concentration molaire CA de l’acide sulfurique titré ?
g) Le titrage pH-métrique met-il en évidence les deux acidités ? Justifier.
h) Ce titrage est également réalisé par conductimétrie. Les conditions expérimentales sont identiques.
Décrire le fonctionnement d’une cellule conductimétrique.
i) Le conductimètre doit-il être étalonné ? Justifier.
j) En supposant que l’effet de la dilution peut être négligé, représenter l’allure du graphique σ = f (V )
(V désignant le volume de soude versé). Indiquer, pour chaque partie du graphique, la réaction prépondérante
associée et justifier les changements de pente en utilisant les valeurs des conductivités ioniques molaires fournies
dans les données.
k) Combien de volumes équivalents détecte-t-on ? Déterminer ces volumes équivalents.
l) Comparer les deux méthodes : titrage pH-métrique et titrage conductimétrique.
II.C.2) Titrage d’un mélange d’acides : acide sulfurique et dioxyde de soufre dissout dans l’eau
On réalise maintenant le titrage de V0 = 40 mL d’une solution aqueuse contenant de l’acide sulfurique à la
concentration molaire C1 et du dioxyde de soufre dissout (SO2 , H2 O encore noté H2 SO3 ) à la concentration
molaire C2 par la solution aqueuse d’hydroxyde de sodium à CB = 0,5 mol · L−1 .
On réalise deux titrages.
− Le premier titrage est réalisé en présence de quelques gouttes de rouge de métacrésol. Le changement de
couleur a alors lieu pour VE1 = 20 mL.
− Lors d’un deuxième titrage en présence de rouge de crésol, le virage de l’indicateur coloré est observé pour
VE2 = 32 mL.
a) Sur un axe de pH, faire apparaître tous les couples acido-basiques mis en jeu dans ce titrage, ainsi que
leur pKA .
b) Quelles espèces ont été titrées lors de l’équivalence observée en présence de rouge de métacrésol ? En
déduire les réactions prépondérantes qui ont eu lieu et déterminer la valeur de leur constante d’équilibre.
16 mai 2011 17:13 Page 3/4
c) Répondre à la même question lors de l’équivalence observée en présence de rouge de crésol.
d) En déduire les valeurs des concentrations C1 et C2 des deux acides titrés.
DONNÉES
Constante d’Avogadro NA = 6,02 × 1023 mol−1
Charge élémentaire e = 1,6 × 10−19 C
Constante des gaz parfaits R = 8,31 J · K−1 · mol−1
H Fe Mn N O P S
Numéro atomique 1 26 25 7 8 15 16
Masse molaire (g · mol−1 ) 1,0 55,8 54,9 14,0 16,0 31,0 32,1
Données thermodynamiques à 298K
Espèce pKS Indicateur Couleur Couleur pKA
forme forme
FeS 17,2 acide basique
Rouge de Rouge Jaune 1,7
MnS 9,6 métacrésol
Couple pKA Rouge Jaune Rouge 8,2
de crésol
H2 S/HS− 7,0
HS− /S− 13,0 Produit ionique de l’eau : Ke = 10−14
2
RT
HSO− 2−
4 /SO4 1,9 2,3 ≈ 0,059 V
F
H2 SO3 /HSO−
3 2,0 Enthalpies standards de formation
HSO− 2−
3 /SO3 7,6
∆f H 0 (SO2(g) ) = −296,8 kJ · mol−1
0 2 −1
Ion λ (mS · m · mol )
∆f H 0 (SO3(g) ) = −395,8 kJ · mol−1
Na+ 5,01
Entropies molaires standard
+
H3 O 34,99
S 0 (SO2(g) ) = 248,2 J · mol−1 · K−1
HSO−
4 5,20
S 0 (SO3(g) ) = 256,8 J · mol−1 · K−1
1 2−
2 SO4 8,00 S 0 (O2(g) ) = 205,2 J · mol−1 · K−1
HO− 19,92
• • • FIN • • •
16 mai 2011 17:13 Page 4/4
Vous aimerez peut-être aussi
- Chapitre II-Fabrication Industrielle de Acide SulfuriqueDocument24 pagesChapitre II-Fabrication Industrielle de Acide SulfuriqueAca Chch100% (1)
- Exem PCDocument6 pagesExem PCwfwgPas encore d'évaluation
- AluminiumDocument19 pagesAluminiumDhikrane NafaaPas encore d'évaluation
- Chapitre 2 Les Équilibres de ComplexationDocument21 pagesChapitre 2 Les Équilibres de ComplexationLlouis PhysicsPas encore d'évaluation
- Examen Blanc PC ResiDocument10 pagesExamen Blanc PC ResiMouad ChakerPas encore d'évaluation
- Obs4 Ste ch1 003-024Document22 pagesObs4 Ste ch1 003-024Viktor MarushkaPas encore d'évaluation
- Les 7 MetauxDocument107 pagesLes 7 Metauxredvelvetmask2343Pas encore d'évaluation
- TD 4 La ThermochimieDocument12 pagesTD 4 La ThermochimiekoumaPas encore d'évaluation
- Serie1-Chimie Des Solutions-Ch5Document7 pagesSerie1-Chimie Des Solutions-Ch5KOUKI SOFIENPas encore d'évaluation
- Q - Révision - ZM Oxydoreduction - EnoncéDocument4 pagesQ - Révision - ZM Oxydoreduction - EnoncéOut Of (Order)Pas encore d'évaluation
- MP CHIMIE CCP 1 2008.enonceDocument5 pagesMP CHIMIE CCP 1 2008.enonceyassine91Pas encore d'évaluation
- ChimieDocument5 pagesChimieMohamedPas encore d'évaluation
- Les Calculatrices Sont AutoriséesDocument5 pagesLes Calculatrices Sont AutoriséesIk RamPas encore d'évaluation
- Sceance - de - Revisions - Avant - Concours CHIMI PDFDocument19 pagesSceance - de - Revisions - Avant - Concours CHIMI PDFKhawla El HamdaouiPas encore d'évaluation
- DS Chapitre 10-11Document4 pagesDS Chapitre 10-11DekapeusePas encore d'évaluation
- DS PH Équilibre Pile ÉlectrolyseDocument3 pagesDS PH Équilibre Pile Électrolysemx52cvj9qgPas encore d'évaluation
- 2021 09 Metro Sujet2 ExoB Pile 5ptsDocument6 pages2021 09 Metro Sujet2 ExoB Pile 5ptsMartin SALEHPas encore d'évaluation
- Cinetique ConductimetrieDocument10 pagesCinetique ConductimetrieMouad Arrad100% (1)
- CO1 TS2 2016 LSLL WahabdiopDocument4 pagesCO1 TS2 2016 LSLL WahabdiopMed BriniPas encore d'évaluation
- DS1-Solutions Aqueuses - Premier PrincipeDocument13 pagesDS1-Solutions Aqueuses - Premier PrincipeadnanPas encore d'évaluation
- TD Chimie Analytique - L2CDocument2 pagesTD Chimie Analytique - L2Cmeyemarion99Pas encore d'évaluation
- Lacide ButyriqueDocument3 pagesLacide Butyriquemaxence.boronat2006Pas encore d'évaluation
- PC Gene 007 Correction Exo1 Chi Titrageso2Document4 pagesPC Gene 007 Correction Exo1 Chi Titrageso2hafidiyazid07Pas encore d'évaluation
- MP CHIMIE CCP 1 2013.enonceDocument7 pagesMP CHIMIE CCP 1 2013.enonceMohssine ElaissaouiPas encore d'évaluation
- TP N° 5 SolutionsDocument6 pagesTP N° 5 SolutionsMohamed EL AminePas encore d'évaluation
- Sujet Chimie FMSB 2004Document10 pagesSujet Chimie FMSB 2004Bile DjetouanPas encore d'évaluation
- Chimie 2014Document9 pagesChimie 2014blinePas encore d'évaluation
- PC GENE 007 SUJET Exo1 Chi TitrageSO2Document3 pagesPC GENE 007 SUJET Exo1 Chi TitrageSO2hafidiyazid07Pas encore d'évaluation
- TD Cinetique 2021 LSLL WahabDiopDocument2 pagesTD Cinetique 2021 LSLL WahabDiopNajimou Alade TidjaniPas encore d'évaluation
- Sciences Physiques S2 S4 S5Document4 pagesSciences Physiques S2 S4 S5bipPas encore d'évaluation
- Bac CD ChimieDocument2 pagesBac CD ChimieRonel TsamenePas encore d'évaluation
- Contrôle Chapitre 6Document4 pagesContrôle Chapitre 6ilyessbg41Pas encore d'évaluation
- Polyc SMC s5 2021-22Document17 pagesPolyc SMC s5 2021-22Lamsaaf MohamedPas encore d'évaluation
- SV Chim 2021 2 FRDocument7 pagesSV Chim 2021 2 FRanthony nehmePas encore d'évaluation
- DS2 Tspé 2020-2021-5Document5 pagesDS2 Tspé 2020-2021-5hanaemaaroufPas encore d'évaluation
- Le TP Se Déroule en 4 Étapes. Documents FournisDocument9 pagesLe TP Se Déroule en 4 Étapes. Documents FournisAnacleto AlfredoPas encore d'évaluation
- 18-Devoir de Vacances - Chimie 1S - TSDocument4 pages18-Devoir de Vacances - Chimie 1S - TSHussein AbdallahPas encore d'évaluation
- 2021 03 Metro Sujet2 Exo1 Aquarium 10pts CorrectionDocument8 pages2021 03 Metro Sujet2 Exo1 Aquarium 10pts Correctionzebi IncomprisPas encore d'évaluation
- Exercices Révision GénéraleDocument3 pagesExercices Révision Généraleklunx0% (1)
- CCP 2013 Psi Physique 2 EpreuveDocument16 pagesCCP 2013 Psi Physique 2 Epreuveyassirtm el outmaniPas encore d'évaluation
- DM6 ThermodynamiqueDocument4 pagesDM6 ThermodynamiqueabderrahimnPas encore d'évaluation
- Epreuve Chimie 1 Preparation Au CNC 2021Document7 pagesEpreuve Chimie 1 Preparation Au CNC 2021Meriem El AbzazePas encore d'évaluation
- Physique ChimieDocument8 pagesPhysique Chimieabdellilah777hattabPas encore d'évaluation
- Cin ExoDocument10 pagesCin ExoHarakat ElhoucinePas encore d'évaluation
- 15chi1es E1Document6 pages15chi1es E1Hussein AbdallahPas encore d'évaluation
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- 2021 03 Metro Sujet2 ExoA Aquarium 10ptsDocument4 pages2021 03 Metro Sujet2 ExoA Aquarium 10ptsYassinePas encore d'évaluation
- 08devoir 4 Rev 2 TR BacSc 2023 (Fini)Document5 pages08devoir 4 Rev 2 TR BacSc 2023 (Fini)Nour NessahPas encore d'évaluation
- MPSI2 TD1 R Acido BasiqueDocument4 pagesMPSI2 TD1 R Acido Basiquehidamohamed326Pas encore d'évaluation
- TD Séries 1 À 4 Lst-Tacq Octobre 2021Document8 pagesTD Séries 1 À 4 Lst-Tacq Octobre 2021imad sahliPas encore d'évaluation
- PC GENE SUJET 042 Exo1 Chi VertMalachiteBeerDocument4 pagesPC GENE SUJET 042 Exo1 Chi VertMalachiteBeerElias AthanassiadisPas encore d'évaluation
- Auteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGODocument28 pagesAuteur: ALLOH Yaovi Robert Professeur de Sciences Physiques Au TOGORodrigueWafoPas encore d'évaluation
- DS 2 BCPSTDocument5 pagesDS 2 BCPSTyakhafrPas encore d'évaluation
- Spe Physique Chimie 2021 Metropole 2 CorrigeDocument11 pagesSpe Physique Chimie 2021 Metropole 2 CorrigeChahid OUAAZIZIPas encore d'évaluation
- DM Chimie RevisionDocument2 pagesDM Chimie RevisionMolka HarbaouiPas encore d'évaluation
- Chimie TD 3 Cinétique ChimiqueDocument4 pagesChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- DS 7 E PH + Electrolyse + OrgaDocument10 pagesDS 7 E PH + Electrolyse + Orgavitalfire58Pas encore d'évaluation
- CNC Chimie Tsi 2010Document5 pagesCNC Chimie Tsi 2010Hamza SadikPas encore d'évaluation
- TPC05 DeterminationdepKaDocument3 pagesTPC05 DeterminationdepKaArnold Murphy Elouma NdingaPas encore d'évaluation
- Compte Rendu TP Electro Chimie 2Document3 pagesCompte Rendu TP Electro Chimie 2yasserPas encore d'évaluation
- Compte Rendu TP Electro Chimie 2Document3 pagesCompte Rendu TP Electro Chimie 2yasserPas encore d'évaluation
- TP7 Cinétique Chimique Du Premier Ordre.Document14 pagesTP7 Cinétique Chimique Du Premier Ordre.Sellam Anis100% (1)
- dm6 optionPSIcorrigeDocument7 pagesdm6 optionPSIcorrigeabderrahmane lalaouiPas encore d'évaluation
- Examens TP Semestre 2Document3 pagesExamens TP Semestre 2Mamadou lamine DiattaPas encore d'évaluation
- COURS-Géométrie de Quelques MoléculesDocument5 pagesCOURS-Géométrie de Quelques MoléculesHamza AskharPas encore d'évaluation
- 1cqoamqq7 671468Document2 pages1cqoamqq7 671468Cheikh lô MbayePas encore d'évaluation
- On DonneDocument3 pagesOn Donnek4rr8bpfz6Pas encore d'évaluation
- Graissage LubrificationDocument90 pagesGraissage LubrificationdjalikadjouPas encore d'évaluation
- Laboratoire de Dimensionnement Des Structures - Coefficients Frottement Et AdhérenceDocument2 pagesLaboratoire de Dimensionnement Des Structures - Coefficients Frottement Et AdhérencewalidgouiaaPas encore d'évaluation
- Dosage de L'antipyrineDocument16 pagesDosage de L'antipyrineRanim GhazouaniPas encore d'évaluation
- MémoireDocument49 pagesMémoireRIHAB ABASSIPas encore d'évaluation
- Propriétés Physico de LeauDocument7 pagesPropriétés Physico de LeauSoufi NrHdPas encore d'évaluation
- Le Zinc ChimiqueDocument2 pagesLe Zinc ChimiqueKeniel EldorPas encore d'évaluation
- General Catalogo DisplaysDocument23 pagesGeneral Catalogo DisplaysAki LeoPas encore d'évaluation
- Chimie Probatoire Blanc 1 PDFDocument2 pagesChimie Probatoire Blanc 1 PDFWilliam YemeliPas encore d'évaluation
- DS1 2016 Chim3 SolutionDocument5 pagesDS1 2016 Chim3 SolutionWardia Ben talebPas encore d'évaluation
- Acier OuelletteDocument62 pagesAcier OuelletteBaris YeltekinPas encore d'évaluation
- LANO - Laboratoire Agronomique NOrmand - Matière OrganiqueDocument1 pageLANO - Laboratoire Agronomique NOrmand - Matière Organiquelaboratoire rabatPas encore d'évaluation
- L'orDocument2 pagesL'orVoldi Bok BokangaPas encore d'évaluation
- Evaluation Sommative MathPhy CAP1Document6 pagesEvaluation Sommative MathPhy CAP1Thierry Pano Doubleface DucosPas encore d'évaluation
- Fascicule-Chimie Organométallique-2022-2023Document84 pagesFascicule-Chimie Organométallique-2022-2023Mohamed Teigne FayePas encore d'évaluation
- DésinfectionDocument5 pagesDésinfectionamel amoulPas encore d'évaluation
- COURS LES DIFFÉRENTS TYPES DE GISEMENTSDocument8 pagesCOURS LES DIFFÉRENTS TYPES DE GISEMENTSsaidiadamyounes711Pas encore d'évaluation
- Utiliser La Constante DDocument19 pagesUtiliser La Constante DElvis Wilfried PossiPas encore d'évaluation
- Cours 11a Alliages Non FerreuxDocument34 pagesCours 11a Alliages Non Ferreuxbeey2001Pas encore d'évaluation
- Extrait 42337210 PDFDocument134 pagesExtrait 42337210 PDFYacinePas encore d'évaluation
- L'alchimisteDocument2 pagesL'alchimisteYanoussa TEBAYAPas encore d'évaluation
- Le Chlorure de SodiumDocument5 pagesLe Chlorure de SodiumBANGA PrincePas encore d'évaluation
- Tabelul Periodic Al Elementelor - Tabelul - Periodic - Al - ElementelorDocument1 pageTabelul Periodic Al Elementelor - Tabelul - Periodic - Al - ElementelorcosstefanPas encore d'évaluation