Académique Documents
Professionnel Documents
Culture Documents
MPSI2 TD1 R Acido Basique
Transféré par
hidamohamed326Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
MPSI2 TD1 R Acido Basique
Transféré par
hidamohamed326Droits d'auteur :
Formats disponibles
LM6E RÉACTIONS ACIDO-BASIQUES Chimie
EXERCICE 1 (C ARACTÈRE ACIDE ET C ARACTÈRE BASIQUE ) .
:::::::::::::
Écrire la formule du couple correspondant et le schéma formel de transfert de protons pour les espèces chi-
miques suivantes :
1.1- Acides : HCOOH ,HN O3 ,H2 S, CO2 , H2 SO4 , H3 P O4 .
1.2- Bases : CH3 N H2 , N H3 , CH3 O− , C2 O42−
EXERCICE 2 (D IAGRAMME DE PRÉDOMINANCE DE L’ ACIDE PHOSPHORIQUE ) .
:::::::::::::
Tracer le diagramme de prédominance de l’acide phosphorique H3 P O4 ;les valeurs des pKa sont : 2.15 – 7.2 et
12.1
EXERCICE 3 (C ONSTANTE D ’ ÉQUILIBRE ) .
:::::::::::::
On considère les couples suivants :
HA/A− HN O2 /N O2− C6 H5 N H3+ /C6 H5 N H2 N H4+ /N H3 CH3 CO2 H/CH3 CO2−
pKa 3, 3 4, 5 9, 2 4, 75
1. Tracer le diagramme de prédominance des huit espèces
2. Ecrire les équations bilans des réactions et en déduire leurs constantes d’équilibre :
(a) CH3 COOH + C6 H5 NH2
−
(b) NH+
4 + NO2
(c) C6 H5 NH2 + NH+
4
EXERCICE 4 (É QUILIBRE ACIDO - BASIQUE ) .
:::::::::::::
On dissout dans de l’eau distillée 0,25 g de benzoate de sodium C6 H5 COON a de pKa1 = 4,2 et un volume V0 =
10 ml d’une solution S d’acide formique HCOOH de pKa2 = 3,7 à C2 = 0,1 mol.L−1 pour obtenir un volume
total V = 100 ml.
1. Tracer un diagramme de prédominance vertical pour les espèces mises en jeu.
2. Écrire l’équation de la réaction prépondérante, calculer sa constante et faire un premier bilan.
3. Écrire les équations bilans de toutes les réactions qui peuvent alors se produire, calculer leurs constantes
d’équilibre et conclure.
4. Déterminer la composition finale du système en déduire une valeur approchée de pH.
On donne M(C6 H5 COON a) = 144,11 g.mol−1 .
EXERCICE 5 (C ONSTANTE D ’ ÉQUILIBRE ET RÉACTIONS PRÉPONDÉRANTES ) .
:::::::::::::
Considérons les mélanges suivants dans un litre d’eau.
Mélange 1 : composé de 0,1 mol de NH4 Cl(s) et 0,2 mol de NaF(s) .
Mélange 2 : composé de HF de concentration 0,01 mol.L−1 ; HBO2 à 0,02 mol.L−1 et 0,01 mol de Na2 S(s).
1. Déterminer les concentrations initiales de chaques espèces présentes dans chaque mélange.
2. En déduire la ( les ) réaction (s ) prépondérante(s) de chaque mélange..
3. Déterminer le pH et la composition finale de chaque mélange.
Couples acide / base pka à 25˚C
NH+4 / NH3 9,2
HF / F− 3,1
HBO2 / BO− 2 9,2
H2 S / HS− 7,0
HS− / S2− 12,9
CPGE Page -1/ 4- MPSI-2
LM6E RÉACTIONS ACIDO-BASIQUES Chimie
EXERCICE 6 (ACIDITÉ DE L’ EAU DE PLUIE ) .
:::::::::::::
Les sources de pollution telles que les transports et les usines libèrent en quantité importante des oxydes d’azote,
des oxydes de carbone et du dioxyde de soufre. Ces oxydes se transforment dans l’atmosphère respectivement en
acide nitrique HN O3 , en acide carbonique CO2 et en acide sulfurique H2 SO4 . Ces acides jouent un rôle im-
portant dans le processus d’acidification des eaux de pluies. Les gaz rejetés dans l’atmosphère augmentent aussi
artificiellement l’effet de serre.
Ce problème propose une étude de l’acidification de l’eau de pluie, de quelques effets des pluies acides et en fin
d’une solution alternative pour réduire l’émission de l’oxyde de carbone.
On considère que, dans les conditions expérimentales mises en œuvres dans le problème, les solutions sont diluées
et idéales. La concentration de référence C o et la pression de référence P o sont prises égales respectivement à
1,molL−1 et 1 bar.
Tous les gaz rencontrés dans le problème seront considérés comme parfaits.
1. L’eau de pluie, loin des zones polluées, est-elle acide, neutre ou basique ? Justifier.
Dissolution du dioxyde de carbone.
Le dioxyde de carbone présent dans l’air se dissout dans l’eau et donne lieu à des équilibres acido-basiques.
On assiste ainsi aux trois réactions suivantes :
(1) CO2(g) CO2(aq) , K
(2) CO2 (aq) + 2H2 O HCO3− + H3 O+ pKa1 = 6, 4
(3)HCO3− + H2 O CO32− + H3 O+ pKa2 = 10, 3
Dans la suite de cette partie, on prendra K = 3, 4.10−2 .
Dans l’atmosphère, la pression partielle en CO2 est supposée constante et vaut P (CO2(g) ) = 3.10−4 bar .
2. Montrer que la concentration en CO2 dans une solution d’eau distillée restée en contact avec l’atmosphère
à 25o C est constante et calculer sa valeur.
3. Rappeler la définition d’un acide et d’une base selon Brönsted.
4. L’acide carbonique CO2(aq) est un diacide. Représenter le diagramme de prédominance des trois espèces
carbonatées en solution en fonction du pH.
5. Calculer le pH de la solution aqueuse de la question 2. Sous quelle forme est le CO2 dissous ?
6. Calculer à 25o C le volume de dioxyde de carbone gazeux qui a été dissous par litre de cette solution.
7. Calculer le pH d’une eau de pluie sachant que la concentration de dioxyde de carbone dissous est constante
et vaut 7, 0.10−5 mol.L−1 . Retrouve-t-on le résultat de la question 1 ?
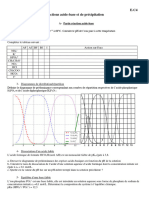
Le diagramme de la figure 1 donne les proportions des différentes espèces carbonatées issues du dioxyde de
carbone dissous dans l’eau de pluie en fonction du pH.
CPGE Page -2/ 4- MPSI-2
LM6E RÉACTIONS ACIDO-BASIQUES Chimie
8. Attribuer les trois courbes du diagramme aux différentes espèces carbonatées en solution.
9. Déduire du diagramme, en le justifiant, les valeurs des pKa associés aux couples acido-basiques du dioxyde
de carbone dissous. Retrouve-t-on les valeurs données dans la partie (Dissolution du dioxyde de carbone) ?
EXERCICE 7 (AUTOUR DE L’ ACIDE TARTRIQUE ) .
:::::::::::::
L’acide tartrique est un diacide d’origine naturel, très présent dans les fruits comme par exemple, l’ananas,
le raisin... On notera formellement H2 T (HOOC-CHOH-CHOH-COOH.). En cédant respectivement un et deux
protons, il devient l’ion hydrogénotartrate HT − puis l’ion tartrate T 2− . Le diagramme suivant a été obtenu par
mise en solution de 1, 0.10−3 mol d’acide tartrique dans 10, 0 mL d’eau puis ajout progressif d’une solution
aqueuse d’hydroxyde de sodium à 1, 0 mol.L−1 .
CPGE Page -3/ 4- MPSI-2
LM6E RÉACTIONS ACIDO-BASIQUES Chimie
1. Montrer que la première acidité de l’acide tartrique est faible.
2. Déterminer les pKa des couples H2 T /HT − et HT − /T 2− .
3. Représenter le diagramme de prédominance relatif à l’acide tartrique.
4. Expliquer pourquoi l’ion hydrogénotartrate HT − est susceptible de réagir avec lui même. Ecrire l’équation
de la réaction et calculer la constante de cet équilibre. Commenter.
EXERCICE 8 (L E DIACIDE SULFUREUX EN SOLUTION AQUEUSE ) .
:::::::::::::
Les courbes de distribution des différentes formes acido-basiques du diacide sulfureux H2 SO3 sont représentées
dans la figure suivante.
1. Donner les deux couples associés au diacide H2 SO3 .
2. Attribuer les courbes aux différentes formes acido-basiques.
3. Déterminer les pKa (pKa1 et pKa2 ) des couples successifs du diacide sulfureux.
4. Construire le diagramme de prédominance associé.
On considère une solution de pH = 2.5 telle que la concentration totale en espèces soufrées soit égale à
Co =2,0.10−3 mol·L−1 .
5. Déterminer les concentrations des différentes formes par lecture des courbes de distribution.
Soit une solution So de l’ion HSO3− à la concentration C=0.1mol/l.
6. Que peut-on dire de l’ion HSO3− .
7. Déterminer la réaction prépondérante qui a lieu à la mise en solution de l’ion HSO3− dans l’eau.
8. En déduire que le pH de la solution est pH = 12 (pKa1 + pKa2 ).
A un litre de solution So , on ajoute 0.1 mol d’acide chlorydrique fort et 0.1 mol de base forte NaOH.
9. En se basant sur la méthode de la réaction prépondérante, déterminer la composition moliare finale du
système.
10. En déduire le pH de la solution .
CPGE Page -4/ 4- MPSI-2
Vous aimerez peut-être aussi
- Solutionaqueusechap 2TDDocument2 pagesSolutionaqueusechap 2TDHamzaPas encore d'évaluation
- Série 4 en Chimie Générale EIB S1Document3 pagesSérie 4 en Chimie Générale EIB S1M'VOULABOLOPas encore d'évaluation
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 pagesE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Pas encore d'évaluation
- C6 TDDocument2 pagesC6 TDKld Mnt0% (1)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaPas encore d'évaluation
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Exos21 Acides BasesDocument4 pagesExos21 Acides BasesSohaib LaminePas encore d'évaluation
- CNC Chimie Tsi 2010Document5 pagesCNC Chimie Tsi 2010Hamza SadikPas encore d'évaluation
- Chimie 5Document2 pagesChimie 5Med OuahdaniPas encore d'évaluation
- TD 2Document2 pagesTD 2Ayoub HmPas encore d'évaluation
- MP CHIMIE CCP 1 2008.enonceDocument5 pagesMP CHIMIE CCP 1 2008.enonceyassine91Pas encore d'évaluation
- TD PHDocument7 pagesTD PHghada gattouch100% (1)
- Chimie en Solution PDFDocument27 pagesChimie en Solution PDFKhalid Zeg0% (1)
- Sem 1 S10405Document4 pagesSem 1 S10405jamjamalPas encore d'évaluation
- Exercices Révision GénéraleDocument3 pagesExercices Révision Généraleklunx0% (1)
- TD 4 La ThermochimieDocument12 pagesTD 4 La ThermochimiekoumaPas encore d'évaluation
- TD Réactions Acido-Basiques: L Mol HCO CDocument3 pagesTD Réactions Acido-Basiques: L Mol HCO ChassouiooPas encore d'évaluation
- 6 Exercices Réactions Acido-Basique 1Document1 page6 Exercices Réactions Acido-Basique 1RIDA SAMIPas encore d'évaluation
- TD Chimie Analytique 2 AnneeDocument11 pagesTD Chimie Analytique 2 AnneeMeryem ZouarhiPas encore d'évaluation
- Exercices 1, Réactions Acido-Basique, Chtoukaphysique - 2Document1 pageExercices 1, Réactions Acido-Basique, Chtoukaphysique - 2boudhar mohamedPas encore d'évaluation
- Chimyaeaa 3 AedadzDocument66 pagesChimyaeaa 3 Aedadzsoufyane el ouahabiPas encore d'évaluation
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 pagesTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhPas encore d'évaluation
- TD Exercices-Corrigés PDFDocument21 pagesTD Exercices-Corrigés PDFabdelouahed.rhaouiPas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- TD1 Acide BaseDocument3 pagesTD1 Acide BaseAnass Badre-EddinePas encore d'évaluation
- 18-Devoir de Vacances - Chimie 1S - TSDocument4 pages18-Devoir de Vacances - Chimie 1S - TSHussein AbdallahPas encore d'évaluation
- TD CG - 01 Acides BasesDocument5 pagesTD CG - 01 Acides BasesMed BriniPas encore d'évaluation
- Chimie en Solution TDDocument15 pagesChimie en Solution TDChk YahyaPas encore d'évaluation
- Fichier Produit 2232Document48 pagesFichier Produit 2232FlorinaPas encore d'évaluation
- Exos CH 06Document2 pagesExos CH 06lol testPas encore d'évaluation
- TD4 - Réaction Acido BasiqueDocument8 pagesTD4 - Réaction Acido Basiquemelo.lasserrePas encore d'évaluation
- Série TD 3 Chimie 2Document2 pagesSérie TD 3 Chimie 2salma koudriPas encore d'évaluation
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 pagesS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirPas encore d'évaluation
- TD 5Document2 pagesTD 5Serena SouaibyPas encore d'évaluation
- Solutions Aqueuses IpDocument13 pagesSolutions Aqueuses IpEmmanuel PolvenskyPas encore d'évaluation
- Feuille de TD N°1-1 PageDocument8 pagesFeuille de TD N°1-1 Pagesalma BahoPas encore d'évaluation
- Chimie en SolutionDocument27 pagesChimie en SolutionNabil holmes100% (3)
- TD Risa Uman 2017 Final 2Document9 pagesTD Risa Uman 2017 Final 2Sa Majesté David50% (2)
- Serie 12 Acide BaseDocument4 pagesSerie 12 Acide Basemazen chebbiPas encore d'évaluation
- Exercice Chimie 02Document3 pagesExercice Chimie 02matmatijamelPas encore d'évaluation
- Exam B Dec 2021Document2 pagesExam B Dec 2021Carmel BABAPas encore d'évaluation
- Fascicule Exercices Corrigés de ChimieDocument51 pagesFascicule Exercices Corrigés de Chimieneyangom100% (1)
- PH Des Solutions Aqueuses EnonceDocument8 pagesPH Des Solutions Aqueuses Enonceaziz0% (1)
- Risa Exercices Application CH2 TC Epss 2020Document2 pagesRisa Exercices Application CH2 TC Epss 2020Jean Luc KonanPas encore d'évaluation
- Couple Acide Base PDFDocument10 pagesCouple Acide Base PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Corrigé Série 2Document8 pagesCorrigé Série 2Chk YahyaPas encore d'évaluation
- SA-Exos - 1 - 1112 Acido Basique ExocorrigéDocument12 pagesSA-Exos - 1 - 1112 Acido Basique ExocorrigéLarbii BadrourPas encore d'évaluation
- Acides Bases PDFDocument8 pagesAcides Bases PDFHafidi AhmedPas encore d'évaluation
- AcademicaDocument4 pagesAcademicaJules Milson RazanajaoPas encore d'évaluation
- 2 2020 Tle SPE Sujetzero Exo1 Sujet CaptureCO2 4ptsDocument2 pages2 2020 Tle SPE Sujetzero Exo1 Sujet CaptureCO2 4ptsalbert einschteinPas encore d'évaluation
- Sem 2 BghyuDocument3 pagesSem 2 BghyuAnonymous FikOnlapPas encore d'évaluation
- Reaction Acido Basique - 022730Document2 pagesReaction Acido Basique - 022730Alaoui AminePas encore d'évaluation
- Les Calculatrices Sont AutoriséesDocument5 pagesLes Calculatrices Sont AutoriséesIk RamPas encore d'évaluation
- SolubiDocument5 pagesSolubiAdil ELPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Traité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresD'EverandTraité élémentaire de chimie: Tomes 1&2: Présenté dans un ordre nouveau et d'après les découvertes modernes; avec FiguresPas encore d'évaluation
- Maths - MPSI-MP2I - Classe Prépas: Cours, Exercices Et Problèmes Corrigés. Première Année, Nouveau Programme (2022)Document7 pagesMaths - MPSI-MP2I - Classe Prépas: Cours, Exercices Et Problèmes Corrigés. Première Année, Nouveau Programme (2022)hidamohamed326Pas encore d'évaluation
- Cours - Limite D'une SuiteDocument21 pagesCours - Limite D'une Suitehidamohamed326Pas encore d'évaluation
- Préparation À La Rentrée en Maths Approfondies, ECG 2ème AnnéeDocument2 pagesPréparation À La Rentrée en Maths Approfondies, ECG 2ème Annéehidamohamed326Pas encore d'évaluation
- Oraux X-ENSDocument1 690 pagesOraux X-ENShidamohamed326Pas encore d'évaluation
- Les Solutions TamponsDocument8 pagesLes Solutions Tamponsmagloire amivaPas encore d'évaluation
- 31 TamponphDocument5 pages31 TamponphAbde TamPas encore d'évaluation
- Séquence 1 Séance 10 (FHL)Document2 pagesSéquence 1 Séance 10 (FHL)sarah.elbaPas encore d'évaluation
- Cours de PCT EN 3ème EN APCDocument34 pagesCours de PCT EN 3ème EN APCDarhel Birova100% (10)
- Programme de Physique Chimie TSDocument15 pagesProgramme de Physique Chimie TSismael587Pas encore d'évaluation
- MEKHATRIAFatima PDFDocument104 pagesMEKHATRIAFatima PDFFriha Kchiche0% (1)
- Le PH de La PiscineDocument2 pagesLe PH de La PiscineGet AlabPas encore d'évaluation
- TP Chimie Des Solutions 2015 2016 - 1Document24 pagesTP Chimie Des Solutions 2015 2016 - 1Ábdėrrâhman Ča-d100% (1)
- KLINGER INDICATEURS DE NIVEAU Insttruction de Montage 2Document6 pagesKLINGER INDICATEURS DE NIVEAU Insttruction de Montage 2Danyldh KalouzodiPas encore d'évaluation
- Corrige Sujet 1 s2 S2a s4 s5Document10 pagesCorrige Sujet 1 s2 S2a s4 s5Massamba DiopPas encore d'évaluation
- Correction Des Exercices Acides-Bases PDFDocument4 pagesCorrection Des Exercices Acides-Bases PDFbenkrimaPas encore d'évaluation
- Compréhension Dune Analyse de SolDocument10 pagesCompréhension Dune Analyse de SolNico. BenoitPas encore d'évaluation
- TP 5 - Acidité de LaitDocument5 pagesTP 5 - Acidité de LaitH HPas encore d'évaluation
- Kaleidoscope ST-STE Sec4 Extrait GuideDocument12 pagesKaleidoscope ST-STE Sec4 Extrait GuideMuffinPas encore d'évaluation
- Polycopi de Cours Traitement Et Dessalement Des Eaux T - HADBI 3Document177 pagesPolycopi de Cours Traitement Et Dessalement Des Eaux T - HADBI 3pc takouachetPas encore d'évaluation
- Catalogue FrancaisDocument59 pagesCatalogue FrancaisbigwebPas encore d'évaluation
- Le Cuivre Dans Le SolDocument3 pagesLe Cuivre Dans Le SolBelkacem ElouafiPas encore d'évaluation
- WWW Devoir TN PDFDocument9 pagesWWW Devoir TN PDFBechir Ben MezhoudPas encore d'évaluation
- Les Acides Bases PDFDocument68 pagesLes Acides Bases PDFBoűmřãh FōüĀdPas encore d'évaluation
- Spirale 38Document28 pagesSpirale 38Rui RatoPas encore d'évaluation
- Adulte Admin Medic InjDocument19 pagesAdulte Admin Medic InjAna AyanePas encore d'évaluation
- Acidite D Un VinaigreDocument6 pagesAcidite D Un Vinaigreboudriat ahmedPas encore d'évaluation
- Chimie Générale 2019-2020-ch.7Document42 pagesChimie Générale 2019-2020-ch.7SAIDOU ONGOIBAPas encore d'évaluation
- Subiect Chimie DNL 2011Document4 pagesSubiect Chimie DNL 2011Christian Ian0% (1)
- 03 Etincelle Manuels 3ac PC Biof Guide FinaleDocument82 pages03 Etincelle Manuels 3ac PC Biof Guide FinaleMarwan SalmyaPas encore d'évaluation
- 1b6SeWFNpSujI1iBdajAYRh1-QiTQTiNZ e Download GD TrueDocument9 pages1b6SeWFNpSujI1iBdajAYRh1-QiTQTiNZ e Download GD Trueahlam zerroukiPas encore d'évaluation
- 2021 03 Metro Sujet2 Exo1 Aquarium 10pts CorrectionDocument8 pages2021 03 Metro Sujet2 Exo1 Aquarium 10pts Correctionzebi IncomprisPas encore d'évaluation
- Suivi de La Décantation de l'US À L'hydrolyse Par Floculation PDFDocument33 pagesSuivi de La Décantation de l'US À L'hydrolyse Par Floculation PDFMamane BachirPas encore d'évaluation
- Saadoune Souhila PDFDocument102 pagesSaadoune Souhila PDFMariam ZouhairPas encore d'évaluation
- 08 Exercice RDM Torsion Simple ArbreDocument4 pages08 Exercice RDM Torsion Simple ArbreAbderrahim SaifiPas encore d'évaluation