Académique Documents
Professionnel Documents
Culture Documents
Chapitre 4-Prof-2020-Corrigé-Exos
Transféré par
lecallo.jessieTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 4-Prof-2020-Corrigé-Exos
Transféré par
lecallo.jessieDroits d'auteur :
Formats disponibles
Terminale Générale spécialité Physique Chimie programme 2020
Chapitre 4 Chimie : suivi temporel et modélisation macroscopique
Corrigé des exercices
N° 8 pages 83 à 91
La tangente à la courbe à la date t = 0 passe par les points B et A de coordonnées (40 ; 180) et (0 ; 0).
𝑦𝐵 – 𝑦𝐴 40−0
Sa pente est : 𝑝 = = = 0,222 𝑚𝑚𝑜𝑙. 𝐿−1 . 𝑠 −1
𝑥𝐵 – 𝑥𝐴 180−0
N° 15 pages 83 à 91
a. C’est le diiode qui colore les solutions ; plus celles-ci sont colorées, plus la concentration de diiode
dans les béchers est élevée, d’après la loi de Beer-Lambert 𝐴 = 𝜀 × ℓ × [𝐼2 ].
La coloration est de plus en plus foncée, ce qui signifie que l’absorbance est plus grande, donc que la
concentration en diiode est plus élevée dans le bécher 3 que dans le bécher 2 et que dans le bécher 1
au même instant.
b. Calculons les quantités de matière initiales : (𝑛X )𝑖 = [𝑋] × 𝑉
mélange n° 1 n° 2 n° 3
(𝑛𝐼− )𝑖 𝑒𝑛 𝑚𝑚𝑜𝑙 2,0 4,0 6,0
(𝑛H2 𝑂2 )𝑖 𝑒𝑛 𝑚𝑚𝑜𝑙 0,50 0,50 0,50
L’ion iodure est en excès dans les trois mélanges car (𝑛𝐼− )𝑖 > 2(𝑛H2 𝑂2 )𝑖 .
Le peroxyde d’hydrogène est donc toujours le réactif limitant.
c. La quantité de matière de réactif limitant introduit est la même dans les trois mélanges, donc la
quantité de diiode formé à l’état final est la même.
D’après l’équation de la réaction : (𝑛𝐼2 )𝑓 = (𝑛H2 𝑂2 )𝑖 = 0,50 𝑚𝑚𝑜𝑙
Le volume total des solutions est lui aussi identique : 𝑉𝑇𝑂𝑇 = 𝑉1 + 𝑉2 + 𝑉3 + 𝑉4 = 100 𝑚𝐿
Donc la concentration finale est la même dans tous les béchers :
(𝑛𝐼2 ) 0,50
𝑓
[𝐼2 ]𝑓 = = = 5,0 𝑚𝑚𝑜𝑙. 𝐿−1
𝑉𝑇𝑂𝑇 0,100
d. La coloration finale sera donc identique dans les trois béchers.
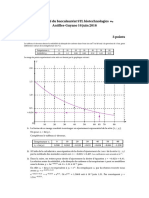
N° 20 pages 83 à 91
a. Puisque la transformation est totale,
(𝑛𝐷𝐴𝑀 )𝑓 = (𝑛DAM )𝑖 − 𝑥𝑚𝑎𝑥 = 0
Donc 𝑥𝑚𝑎𝑥 = (𝑛DAM )𝑖 = 9,0 𝑚𝑚𝑜𝑙 d’après le
graphique.
𝑥
b. 𝑥(𝑡1/2 ) = 𝑚𝑎𝑥 = 4,5 𝑚𝑚𝑜𝑙.
2
On reporte cette valeur sur le graphique et on
en déduit 𝑡1/2 = 70 𝑚𝑖𝑛
N° 24 pages 83 à 91
a. Tracé 𝑛 = 𝑓(𝑡) pour les deux températures :
b. A température élevée, la quantité de matière
s’annule plus rapidement qu’à basse
température : la température accélère la
transformation chimique.
N° 26 pages 83 à 91
Pour simplifier la rédaction on
pose [𝑋] = [𝐶2 𝐻4 𝑂] et on utilise
un tableur pour tracer [X] =f(t)
[𝑋] = 𝑓(𝑡), ainsi que la tangente 100
à la courbe à l’origine : A
80
(pas facile, il y a peu de points,
pas d’autre choix que de 60
s’aligner sur les deux premiers
points du nuage…) 40
B
20
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140
a. La vitesse volumique initiale est l’opposé de la pente de la tangente à l’origine de la courbe
représentative de l’évolution temporelle de [𝑋]. La tangente à l’origine (en rouge), passe par les
points A(0 ; 86) et B(60 ; 40) :
𝑑[𝑋] ∆[𝑋] 40 − 86
𝑣𝑐,𝑋 (𝑡0 ) = − (𝑡0 ) = − =− = 0,77 𝑚𝑚𝑜𝑙. 𝐿−1 . 𝑠 −1
𝑑𝑡 ∆𝑡 60 − 0
b. Pour vérifier que l’évolution de la concentration suit une loi de vitesse d’ordre un, il faut tracer le
[𝑋](𝑡)
nuage de points 𝐿𝑛 [𝑋] = 𝑓(𝑡) et vérifier si l’on obtient une droite passant par l’origine et de pente
0
négative :
t (min) [X] mmol.L-1 Ln([X]/[X]0) Ln([X]/[X]0)=f(t)
0 86 0 0
0 50 100 150
50 48,5 -0,5727835 -0,2
72 40,7 -0,7481192
-0,4
93 35,3 -0,89046433
-0,6
130 28,6 -1,10094058
-0,8
-1 y = -0,0093x
R² = 0,9569
-1,2
-1,4
Le nuage de points obtenu n’est pas une droite, la modélisation et la valeur du coefficient de
corrélation le confirment, cette réaction n’obéit pas à une loi cinétique d’ordre 1.
Vous aimerez peut-être aussi
- T1 S5 Correction ExercicesDocument37 pagesT1 S5 Correction ExerciceskandedianissyPas encore d'évaluation
- Bts - Ol Maths 2009 CorrigeDocument6 pagesBts - Ol Maths 2009 CorrigetaziPas encore d'évaluation
- EXER CORR Modèle Linéaire SimpleDocument15 pagesEXER CORR Modèle Linéaire Simpleantonio aniPas encore d'évaluation
- Solution TDchromato 2021Document4 pagesSolution TDchromato 2021allali hanaaPas encore d'évaluation
- Travaux PratiqueDocument12 pagesTravaux PratiqueIkram KhedimPas encore d'évaluation
- EDETD5 BDocument15 pagesEDETD5 BThibaut FrisonPas encore d'évaluation
- Corrige A 2eme EMD 1415Document2 pagesCorrige A 2eme EMD 1415sylvie jacklinePas encore d'évaluation
- Phys 1 Serie 210 SolDocument17 pagesPhys 1 Serie 210 Soladlane MohamedPas encore d'évaluation
- Corrige STL Bio Antilles-Guyane Juin2016 FHDocument8 pagesCorrige STL Bio Antilles-Guyane Juin2016 FHToumany FofanaPas encore d'évaluation
- Rapport TP1 Robotique BECHIM AmelDocument19 pagesRapport TP1 Robotique BECHIM AmelAmel BECHIMPas encore d'évaluation
- CO1 TS1 2024 IapgDocument4 pagesCO1 TS1 2024 Iapgpapa samba sarrPas encore d'évaluation
- Act08 Corrigé Cinematiq 02Document3 pagesAct08 Corrigé Cinematiq 02Axelle DelportePas encore d'évaluation
- Exercice Corrigé Suivi Temporel D'une Transformation Chimique PDFDocument2 pagesExercice Corrigé Suivi Temporel D'une Transformation Chimique PDFMohammed Elhlou75% (8)
- DS Analyse NumeriqueDocument5 pagesDS Analyse Numeriqueasmae barkPas encore d'évaluation
- Examen MNI Mai 2019 PDFDocument2 pagesExamen MNI Mai 2019 PDFsloPas encore d'évaluation
- AD Cor Meca01Document1 pageAD Cor Meca01t123medPas encore d'évaluation
- Serie TD01Document6 pagesSerie TD01Mostafa DridiPas encore d'évaluation
- Cours 3 Cinétique Khenifi-ConvertiDocument6 pagesCours 3 Cinétique Khenifi-ConvertiÑar ĎjesPas encore d'évaluation
- Corrigé TD2 Statistique AppliquéeDocument9 pagesCorrigé TD2 Statistique Appliquéesalma rakiniPas encore d'évaluation
- La Méthode de MCDocument5 pagesLa Méthode de MCwasimPas encore d'évaluation
- Corrigé Sujet S2 1er Groupe PC Session Normale 2019 1Document7 pagesCorrigé Sujet S2 1er Groupe PC Session Normale 2019 1Mamadou NdiayePas encore d'évaluation
- Examen Automatique1A 2016 Plus CorrectionDocument19 pagesExamen Automatique1A 2016 Plus Correctionhalim otmanePas encore d'évaluation
- Simulation Du Transfert de Chaleur D'un Échnageur de Type ConsnetriqueDocument15 pagesSimulation Du Transfert de Chaleur D'un Échnageur de Type Consnetriquekr saadPas encore d'évaluation
- TP - N03 - DIAGNOSTIC - PDF Version 1Document4 pagesTP - N03 - DIAGNOSTIC - PDF Version 1org 2019Pas encore d'évaluation
- Compte Rendu: TP Opération UnitaireDocument8 pagesCompte Rendu: TP Opération UnitaireCamelia BensmaiaPas encore d'évaluation
- Cours 2 Cinétique Khenifi PDFDocument3 pagesCours 2 Cinétique Khenifi PDFÑar ĎjesPas encore d'évaluation
- Correction TD1Document2 pagesCorrection TD1fbdbhdPas encore d'évaluation
- Abdelhaq HABYBYDocument4 pagesAbdelhaq HABYBYYahya JanatiPas encore d'évaluation
- TP Spectroscopie M1 Chim Des MatDocument7 pagesTP Spectroscopie M1 Chim Des MatIbtissam EnnaouiriPas encore d'évaluation
- Compte Rendu OpuDocument8 pagesCompte Rendu OpuMaria bacPas encore d'évaluation
- Problème D'analyse Vectorielle+corrigéDocument13 pagesProblème D'analyse Vectorielle+corrigéAPas encore d'évaluation
- Bac STI2D - STL Spécialité SPCL 2018 Corrigé MathsDocument2 pagesBac STI2D - STL Spécialité SPCL 2018 Corrigé MathsLETUDIANT100% (1)
- CINFORMELLE Exercice11Document4 pagesCINFORMELLE Exercice11Wissal EddenguirPas encore d'évaluation
- Etude Des Oscillations Rotationnelles Amorties Libres Et Forcées-Pendule de PohlDocument11 pagesEtude Des Oscillations Rotationnelles Amorties Libres Et Forcées-Pendule de PohlSaid Boustta100% (1)
- TP:Ètude D'oscillateur Harmonique: Les ObjectifsDocument4 pagesTP:Ètude D'oscillateur Harmonique: Les ObjectifsAhmed TribakPas encore d'évaluation
- Exercice 1Document3 pagesExercice 1ahmed mouhamedPas encore d'évaluation
- PC D 2014 CorDocument5 pagesPC D 2014 CorChristellePas encore d'évaluation
- Corrige Td1 Uv Visible TsaDocument5 pagesCorrige Td1 Uv Visible TsaELAssaliAziz100% (4)
- Compte RenduDocument23 pagesCompte RenduMouhcine Ben MoussaPas encore d'évaluation
- Bouakaz 02Document14 pagesBouakaz 02Saad TaibiPas encore d'évaluation
- Solution Examen Final L3 22 - 23Document4 pagesSolution Examen Final L3 22 - 23lala loPas encore d'évaluation
- TP 2Document3 pagesTP 2TIHAL Wassim AmdjedPas encore d'évaluation
- Séance 7 - TH - Corrigé TD3 - QuaramDocument11 pagesSéance 7 - TH - Corrigé TD3 - QuaramHajarPas encore d'évaluation
- Ondes Exercices CorrigésDocument22 pagesOndes Exercices CorrigésHaroun HarrarPas encore d'évaluation
- MathsDocument4 pagesMathsalexPas encore d'évaluation
- Compte Rendu TP CR: Associations Des ReacteursDocument15 pagesCompte Rendu TP CR: Associations Des ReacteursIkram Khedim100% (2)
- Séance 1Document35 pagesSéance 1Abdelilah ChoghalPas encore d'évaluation
- Devoir Metrolog 1Document5 pagesDevoir Metrolog 1AnasPas encore d'évaluation
- Zaki 5Document6 pagesZaki 5Zouaghi ZakariaPas encore d'évaluation
- Exo 7Document6 pagesExo 7alalPas encore d'évaluation
- Bac Blanc 2 ts2 1Document5 pagesBac Blanc 2 ts2 1Amadou Makhtar SeckPas encore d'évaluation
- S 3 Ds 12021Document5 pagesS 3 Ds 12021Antoine PacoPas encore d'évaluation
- DEVOIR N°1 2nd SEM TS1 M. BARRY-1Document3 pagesDEVOIR N°1 2nd SEM TS1 M. BARRY-1klawdy594Pas encore d'évaluation
- Correction Epreuve Devoir Departemental Sciences Physiques TS2Document6 pagesCorrection Epreuve Devoir Departemental Sciences Physiques TS2Mame cheikh DiopPas encore d'évaluation
- 2015 Ecricome-CorrigeDocument9 pages2015 Ecricome-CorrigeChaimae BouzaganePas encore d'évaluation
- TP 1 ZighmiDocument8 pagesTP 1 ZighmiAmira KrimaPas encore d'évaluation
- Révision N°3 (KH Bessem) (Maknassy)Document4 pagesRévision N°3 (KH Bessem) (Maknassy)Ghassen BenjannetPas encore d'évaluation
- TP2 TDC19Document6 pagesTP2 TDC19Rock LeePas encore d'évaluation
- Équations différentielles: Les Grands Articles d'UniversalisD'EverandÉquations différentielles: Les Grands Articles d'UniversalisPas encore d'évaluation
- Aquap SNCTDocument22 pagesAquap SNCTRobertBostanPas encore d'évaluation
- Compax EquipementDocument3 pagesCompax EquipementSteve Alain Onana DangPas encore d'évaluation
- HUG - Tableau Médicaments Qui Peuvent Être Coupés Et/ou Écrasés HUGDocument45 pagesHUG - Tableau Médicaments Qui Peuvent Être Coupés Et/ou Écrasés HUGAurum100% (1)
- AmidonDocument9 pagesAmidonchristophePas encore d'évaluation
- 6 Chapitre 5Document25 pages6 Chapitre 5Mohamed LeoPas encore d'évaluation
- Cours 17-ProteinesEnzymes Etudiants2Document10 pagesCours 17-ProteinesEnzymes Etudiants2Cita CitaPas encore d'évaluation
- Exo 54 - Dosage Acide Benzoique EDocument2 pagesExo 54 - Dosage Acide Benzoique EislameilhamiPas encore d'évaluation
- Chromatographie Et Spectroscopie de MasseDocument18 pagesChromatographie Et Spectroscopie de MasseWalid AbouloifaPas encore d'évaluation
- Cours 4 - Le NoyauDocument9 pagesCours 4 - Le Noyaumanuelakouadio405Pas encore d'évaluation
- 01 - Les Cinq Synthese de DMCDocument227 pages01 - Les Cinq Synthese de DMCChërchěf DjămiīlåPas encore d'évaluation
- Piles Electrochimiques PDFDocument12 pagesPiles Electrochimiques PDFAzizElheni100% (1)
- Cour ÉconomieDocument16 pagesCour Économieyoung Osi237Pas encore d'évaluation
- Sables de Moulage - TsaucrayDocument4 pagesSables de Moulage - TsaucrayTriki BilelPas encore d'évaluation
- Directives Environnementales, Sanitaires Et Sécuritaires Pour L'exploitation Du Pétrole Et Du Gaz en Mer (Offshore)Document30 pagesDirectives Environnementales, Sanitaires Et Sécuritaires Pour L'exploitation Du Pétrole Et Du Gaz en Mer (Offshore)julienfolquetPas encore d'évaluation
- TP Chimie S1Document58 pagesTP Chimie S1François Adolphe50% (2)
- Chihab+belkacem TP RABEHIDocument7 pagesChihab+belkacem TP RABEHIbouhebl chihabPas encore d'évaluation
- Chapitre III Champ CristallinDocument9 pagesChapitre III Champ Cristallinعبد الصمد بوالعيشPas encore d'évaluation
- Carburants Document de LectureDocument56 pagesCarburants Document de LecturebeyPas encore d'évaluation
- THESE Nouh AARABDocument183 pagesTHESE Nouh AARABaissa ambarkiPas encore d'évaluation
- Evaluation Du Premier SemestreDocument4 pagesEvaluation Du Premier SemestrekathyPas encore d'évaluation
- FT Mopur3 FRDocument9 pagesFT Mopur3 FRMiangaly ChriiPas encore d'évaluation
- Rapport D'exposé La Gestion Des Déchets Liquides.: Réalisé ParDocument15 pagesRapport D'exposé La Gestion Des Déchets Liquides.: Réalisé ParAbderrahim AzarkanPas encore d'évaluation
- Sika Carbodur SDocument5 pagesSika Carbodur SFokou Nimpa Martial RaoulPas encore d'évaluation
- 4 - Propriétés Physiques Du Sol2Document15 pages4 - Propriétés Physiques Du Sol2isaouahPas encore d'évaluation