Académique Documents
Professionnel Documents
Culture Documents
7SP06TE0422 Devoir4
Transféré par
Saladin Heart of lionTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
7SP06TE0422 Devoir4
Transféré par
Saladin Heart of lionDroits d'auteur :
Formats disponibles
DEVOIR 4
Ce devoir est à réaliser sous forme numérique :
connectez-vous à votre site de formation www.cned.fr > espace inscrit
et suivez nos conseils pratiques pour déposer votre devoir et le faire corriger par internet.
IMPORTANT Veuillez réaliser ce devoir après avoir étudié la séquence 4.
« La réalisation de vos devoirs est un travail personnel permettant d’évaluer vos acquisitions et de construire
votre projet d’orientation. Sauf consignes contraires, il est obligatoire de les réaliser dans les conditions de
l’examen, c’est-à-dire en temps limité, sans recopier des contenus issus de supports extérieurs au sujet
(internet, cours du CNED, manuels scolaires…). Le cas échéant, si vous avez besoin de vous référer à un
passage issu d’un support extérieur, mettez-le entre guillemets et citez votre source. Tout travail non personnel
sera sanctionné. »
Temps de travail estimé : 2 heures
Exercice 1 : La pile plomb-cuivre (10 pts)
Donnée : Constante de Faraday 1 F = 96 500 C.mol-1
On réalise une pile plomb-cuivre mettant en jeu les couples Pb2+ / Pb et Cu2+ / Cu dans deux
compartiments séparés :
Compartiment A : une lame de cuivre de masse 200 g plongeant dans 100 mL d’une solution de nitrate de
cuivre II (Cu2+ + 2 NO3-), de concentration 1,0 mol.L-1.
Compartiment B : une lame de plomb de masse 200 g plongeant dans 100 mL d’une solution de nitrate de
plomb II (Pb2+ + 2 NO3-), de concentration 1,0 mol.L-1
1. Écrire l’équation de la réaction à l’électrode où se
déroule la réduction des ions cuivre II Cu2+.
2. Écrire l’équation de la réaction à l’électrode où se
déroule l’oxydation du plomb Pb.
3. En déduire l’équation de la réaction globale de
fonctionnement de cette pile plomb-cuivre.
4. Recopier et compléter la légende du schéma de cette pile
en fonctionnement ci-contre, puis préciser dessus :
la polarité de la pile
le sens conventionnel du courant
5. Préciser le sens de déplacement des porteurs de charges dans le pont salin constitué de nitrate de
potassium (K+ + NO3-). Justifier.
CNED TERMINALE PHYSIQUE CHIMIE SPÉ 1
6. Lorsque la pile débite comment évolue la masse de chaque lame métallique ? Justifier.
7. Donner l’expression littérale puis calculer le quotient de réaction initial Qr de cette pile plomb-
cuivre.
La constante d’équilibre K de cette pile plomb-cuivre est de l’ordre de 1016.
8. En détaillant votre raisonnement, estimer la quantité de matière d’électrons échangés lors du
fonctionnement de cette pile plomb-cuivre (les solides constituant les électrodes sont en excès).
9. En déduire la valeur de la capacité électrique Q de cette pile plomb-cuivre.
Exercice 2 : La vitamine C (10 pts)
La vitamine C ou acide ascorbique dont les sources principales sont les légumes et les fruits frais
intervient dans l’assimilation des glucides, la synthèse du glycogène musculaire et à un rôle
antihémorragique et anti-infectieux. Une carence en vitamine C entraîne le fameux scorbut qui décimait
les marins jusqu’à la fin du 18ème siècle et reste de nos jours une des causes majeures de malnutrition.
Document 1 : Quelques formules chimiques
acide ascorbique (vitamine C) acide déshydroascorbique
Document 2 : La vitamine C, un excellent antioxydant !
L’utilisation d’antioxydants est une pratique très ancienne pour la conservation des aliments :
viandes et poissons découpés en tranches étaient « boucanés » et imprégnés par des composants
phénoliques de la fumée. Par la suite, les chimistes se sont aperçus que l’addition de petites
quantités de certains composés était susceptible de ralentir la détérioration par le dioxygène de
l’air de certains composés et le rancissement des matières grasses. Les antioxydants sont donc
des composés capables de retarder l’effet du dioxygène de l’air sur nos aliments. Parmi ceux-ci,
l’acide ascorbique a la propriété d’être fortement réducteur. Cette molécule agit sur le dioxygène
par oxydoréduction et se transforme en acide déshydroascorbique.
1. Donner la formule brute de l’ion ascorbate, base conjuguée de l’acide ascorbique obtenue après
perte d’un seul proton H+.
Dorénavant, par souci de simplification, vous noterez dans votre copie :
- HA pour l’acide ascorbique - A- pour l’ion ascorbate
2 CNED TERMINALE PHYSIQUE CHIMIE SPÉ
On désire dissoudre 500 mg d’acide ascorbique, de masse molaire moléculaire 176,0 g.mol-1,
dans 200 mL d’eau. À la fin de la transformation chimique, le pH-mètre indique comme valeur 2,9.
2. Calculer la quantité de matière initiale en acide ascorbique.
3. Compléter le tableau d’avancement, en annexe à recopier sur la copie, en répondant aux quatre
questions ci-dessous.
a) Écrire la réaction chimique de l’acide ascorbique (HA) avec l’eau.
b) Compléter le tableau d’avancement aux états initial et intermédiaire.
c) Que valent les quantités de matière pour chaque produit formé en considérant
la transformation totale ?
d) Que valent réellement toutes les quantités de matière à la fin de la transformation ?
Justifier sur votre copie.
4. La transformation chimique entre l’acide ascorbique est-elle totale ou limitée ?
Justifier.
5. En déduire si l’acide ascorbique est un acide fort ou faible.
6. Donner l’expression littérale de la constante d’acidité Ka du couple
acide ascorbique / ion ascorbate.
7. Calculer la valeur de cette constante d’acidité Ka et montrer que celle du pKa vaut 3,9.
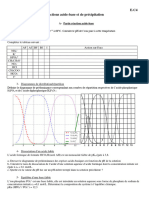
8. Tracer le diagramme de prédominance du couple acide ascorbique / ion ascorbate.
9. Quelle est la forme majoritaire de la vitamine C dans le milieu gastrique de pH égal à 2,0 ? Et dans
le milieu intestinal de pH égal à 8,0 ?
La vitamine C fait partie des antioxydants, c’est-à-dire qu’elle s’oxyde avant toute autre entité chimique
en présence de dioxygène et bien entendu le produit de cette oxydation, l’acide déshydroascorbique, ne
présente aucun risque pour la santé. L’équation-bilan non équilibrée de cette oxydation est :
a C6H8O6 (aq) + b O2 (aq) → c C6H6O6 (aq) + d H2O (l)
10. Que valent les nombres stœchiométriques a, b, c et d ? Aucune justification n’est demandée.
ANNEXE
QUESTION
3. a) Équation chimique
État Avancement Quantités de matière (mol)
3. b) Initial x=0
3. b) Intermédiaire 0 < x < xmax
3. c) Final si totale xmax =
3. d) Final xf =
CNED TERMINALE PHYSIQUE CHIMIE SPÉ 3
Vous aimerez peut-être aussi
- T Science DevoirdDocument2 pagesT Science DevoirdOumar TraoréPas encore d'évaluation
- Examen5 Réactivité Chimique FST-MeknèsDocument19 pagesExamen5 Réactivité Chimique FST-Meknèsyakubuojonugwa32Pas encore d'évaluation
- Spe Physique Chimie 2021 Zero 1 Sujet OfficielDocument11 pagesSpe Physique Chimie 2021 Zero 1 Sujet OfficielChahid OUAAZIZIPas encore d'évaluation
- T Science DevoirdDocument2 pagesT Science DevoirdOumar TraoréPas encore d'évaluation
- TD Séries 1 À 4 Lst-Tacq Octobre 2021Document8 pagesTD Séries 1 À 4 Lst-Tacq Octobre 2021imad sahliPas encore d'évaluation
- Simili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023Document10 pagesSimili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023SABOUR MOHAMMEDPas encore d'évaluation
- 4-1 - Suivi D'une Transformation Chimique - 1BAC - Int (WWW - Pc1.ma)Document6 pages4-1 - Suivi D'une Transformation Chimique - 1BAC - Int (WWW - Pc1.ma)Majed GharibPas encore d'évaluation
- Chimie ProbatC&D 2002Document2 pagesChimie ProbatC&D 2002murielle matanePas encore d'évaluation
- Exercices Révision GénéraleDocument3 pagesExercices Révision Généraleklunx0% (1)
- MP CHIMIE CCP 1 2013.enonceDocument7 pagesMP CHIMIE CCP 1 2013.enonceMohssine ElaissaouiPas encore d'évaluation
- MPT Chimie MP 1998Document3 pagesMPT Chimie MP 1998hakkayPas encore d'évaluation
- TD5 Chimie3 Corrigé (2014 2015)Document2 pagesTD5 Chimie3 Corrigé (2014 2015)moustafa soudaniPas encore d'évaluation
- Baccalaureat 2001 PDFDocument5 pagesBaccalaureat 2001 PDFbdh20045450Pas encore d'évaluation
- Jurys - CESS Général - Chimie - Examen 2015-2Document9 pagesJurys - CESS Général - Chimie - Examen 2015-2Rdth RdthPas encore d'évaluation
- Bac Ad-2024 Chimie Theo TCDDocument4 pagesBac Ad-2024 Chimie Theo TCDfastdinho1011Pas encore d'évaluation
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pages2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiPas encore d'évaluation
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pages2° Contrôle SMPC S2 2012 2013 PDFAbdelah El Arabi100% (2)
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pages2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiPas encore d'évaluation
- 2° Contrôle SMPC S2 2012 2013Document2 pages2° Contrôle SMPC S2 2012 2013lahssane hmidat100% (1)
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pages2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiPas encore d'évaluation
- Exercices de Révision - Examen 1Document3 pagesExercices de Révision - Examen 1gmx4x78dxtPas encore d'évaluation
- Sem 1 S10405Document4 pagesSem 1 S10405jamjamalPas encore d'évaluation
- 2-Série Acide Base + CorrigéDocument14 pages2-Série Acide Base + Corrigémimi mimiPas encore d'évaluation
- TD 4 La ThermochimieDocument12 pagesTD 4 La ThermochimiekoumaPas encore d'évaluation
- Exercice ÉlectrochimieDocument2 pagesExercice ÉlectrochimieAnonymous 5UWeMuf100% (2)
- Fiche Travaux Diriges de Chimie P C&D: Année: 2022Document2 pagesFiche Travaux Diriges de Chimie P C&D: Année: 2022ANDRE ELOCKPas encore d'évaluation
- Sujet Chimie FMSB 2004Document10 pagesSujet Chimie FMSB 2004Bile DjetouanPas encore d'évaluation
- TD Chimie Analytique - L2CDocument2 pagesTD Chimie Analytique - L2Cmeyemarion99Pas encore d'évaluation
- Chimie 1ère CD Compo Trim2 Mars 2023Document2 pagesChimie 1ère CD Compo Trim2 Mars 2023Aubin TcheunouPas encore d'évaluation
- 2ème DEVOIR Tle CDocument5 pages2ème DEVOIR Tle CjustsdedePas encore d'évaluation
- Chimie ProbatC&D 2008Document3 pagesChimie ProbatC&D 2008rayannongniPas encore d'évaluation
- Epreuve Chimie 1 Preparation Au CNC 2021Document7 pagesEpreuve Chimie 1 Preparation Au CNC 2021Meriem El AbzazePas encore d'évaluation
- TP Nylon 2018 CorrectionDocument8 pagesTP Nylon 2018 CorrectionHassanPas encore d'évaluation
- Pcsi - DL 04Document3 pagesPcsi - DL 04jawahermohamed.maPas encore d'évaluation
- Chimyaeaa 3 AedadzDocument66 pagesChimyaeaa 3 Aedadzsoufyane el ouahabiPas encore d'évaluation
- Exercices - CHIM-S-101 - 2023-2024 - 02Document3 pagesExercices - CHIM-S-101 - 2023-2024 - 02cotam58578Pas encore d'évaluation
- Cinétique Chimique Exercices 04.TextMarkDocument16 pagesCinétique Chimique Exercices 04.TextMarkAbedPas encore d'évaluation
- Bac Blanc N4 BiofDocument9 pagesBac Blanc N4 BiofAnas TalhiPas encore d'évaluation
- Travaux Dirigés - Procédé Oxydatif - UKDocument6 pagesTravaux Dirigés - Procédé Oxydatif - UKTaki EddinePas encore d'évaluation
- Poly OxydoDocument9 pagesPoly OxydoOsman TasPas encore d'évaluation
- Fiche de Travaux Diriges Leçon1 1 CD: Fiche Proposée Par Mbita Simon 696 29 12 28Document4 pagesFiche de Travaux Diriges Leçon1 1 CD: Fiche Proposée Par Mbita Simon 696 29 12 28Youri NoghoPas encore d'évaluation
- Coo NcorDocument4 pagesCoo NcorPFEPas encore d'évaluation
- 3e PCTDocument11 pages3e PCTeucludePas encore d'évaluation
- E chmp2016Document5 pagesE chmp2016christina.tchissamboPas encore d'évaluation
- DS2 LMA 09 11 2019 Avancement - RedoxDocument2 pagesDS2 LMA 09 11 2019 Avancement - Redoxcloe.garrotPas encore d'évaluation
- PC GENE SUJET 042 Exo1 Chi VertMalachiteBeerDocument4 pagesPC GENE SUJET 042 Exo1 Chi VertMalachiteBeerElias AthanassiadisPas encore d'évaluation
- Devoir Surveillé N°2Document2 pagesDevoir Surveillé N°2Hãmżä HåmžâPas encore d'évaluation
- Série Chimie Session AccéléréeDocument4 pagesSérie Chimie Session AccéléréeMehdi MbPas encore d'évaluation
- Klubprepa Extrait 4002Document3 pagesKlubprepa Extrait 4002Ouma ImaPas encore d'évaluation
- 2D-PC-CHAP 02 ExercicesDocument143 pages2D-PC-CHAP 02 ExercicesHSEE PUVPas encore d'évaluation
- ExercicesEtDS Etude Quantitative Chimie BEPDocument2 pagesExercicesEtDS Etude Quantitative Chimie BEPMenasria HakimPas encore d'évaluation
- PHCH 3e ch02 p031 Exercices Supp EleveDocument6 pagesPHCH 3e ch02 p031 Exercices Supp ElevejanaPas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2019 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةDocument14 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2019 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةjouaitiPas encore d'évaluation
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 pagesE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Pas encore d'évaluation
- 1 EXAMEN BLANC PCT Tle C CEPG LA PROSPERITEDocument7 pages1 EXAMEN BLANC PCT Tle C CEPG LA PROSPERITEVadius COCOUPas encore d'évaluation
- OxydoreductionDocument6 pagesOxydoreductionAchraf AlaouiPas encore d'évaluation
- Chimie (2) - 1Document2 pagesChimie (2) - 1lolizepazePas encore d'évaluation
- 4 5855082138700876273Document2 pages4 5855082138700876273publicité en flopOfficielPas encore d'évaluation
- Révision Chimie (0) 1Document5 pagesRévision Chimie (0) 1ramziathzakari79Pas encore d'évaluation
- Enjeux Et Opportunités Des Composés Phénoliques: December 2013Document5 pagesEnjeux Et Opportunités Des Composés Phénoliques: December 2013Khadija El aroussiPas encore d'évaluation
- Carte Amoud MawlidDocument12 pagesCarte Amoud MawlidmossaabPas encore d'évaluation
- Corrigé Niv 2Document6 pagesCorrigé Niv 2denisePas encore d'évaluation
- Micro Organismes Et AlimentsDocument8 pagesMicro Organismes Et AlimentsMįSs BęãüTÿPas encore d'évaluation
- L'économie Circulaire Dans L'univers Agricole Et AlimentaireDocument4 pagesL'économie Circulaire Dans L'univers Agricole Et AlimentaireSaÏd BaaouiPas encore d'évaluation
- Les Limaces Au Potager 1 - Le GuideDocument37 pagesLes Limaces Au Potager 1 - Le GuideZaordoz ZedPas encore d'évaluation
- II & III Pâton & PainDocument110 pagesII & III Pâton & PainEkouna-Kanga JustePas encore d'évaluation
- Un Avion Sans Elle-By Bussi Michel-391 PagesDocument391 pagesUn Avion Sans Elle-By Bussi Michel-391 PagesMarcel KPas encore d'évaluation
- MemoireDocument104 pagesMemoireSaloua ElboustatiPas encore d'évaluation
- Delf Junior ModeloDocument10 pagesDelf Junior ModeloThalia VillarroelPas encore d'évaluation
- Pixibox OthDocument1 pagePixibox OthYann HajjiPas encore d'évaluation
- Etiquetage Des Denrees Alimentaires 2019Document30 pagesEtiquetage Des Denrees Alimentaires 2019MILOHINPas encore d'évaluation
- Le Brevetage de L'invention D'un Engrais OrganiqueDocument43 pagesLe Brevetage de L'invention D'un Engrais Organiqueadonistchuemeni95Pas encore d'évaluation
- Sakafo 8 SemDocument2 pagesSakafo 8 SemGuillaume RatovoarisoaPas encore d'évaluation
- 2eme Cours Sucrerie ADocument16 pages2eme Cours Sucrerie Aamina imenePas encore d'évaluation
- LAETICIADocument19 pagesLAETICIAjustedjenontin9Pas encore d'évaluation
- Oiseaux Blesses JBi ENiDocument4 pagesOiseaux Blesses JBi ENimicalotPas encore d'évaluation
- 07 AcideferDocument6 pages07 AcideferAbde TamPas encore d'évaluation
- Nicole Fox La Mafia Belluci Tome 1 Ange CorrompuDocument365 pagesNicole Fox La Mafia Belluci Tome 1 Ange CorrompuCamille delrue100% (1)
- Audit HACCP Des Processus de Fabrication Du Fromage Frais Danino - Laiterie DANONE DJURDJURADocument66 pagesAudit HACCP Des Processus de Fabrication Du Fromage Frais Danino - Laiterie DANONE DJURDJURABushra100% (2)
- 111 - Aliments Fonctionnels Theme de SoutenanceDocument7 pages111 - Aliments Fonctionnels Theme de SoutenanceJoëlPas encore d'évaluation
- La Cuisine Paléolithique - Joseph DelteilDocument3 pagesLa Cuisine Paléolithique - Joseph DelteilMainmanFRPas encore d'évaluation
- Pronoms Relatifs. Angelica VilchisDocument4 pagesPronoms Relatifs. Angelica VilchisrioPas encore d'évaluation
- Rapport ADEOTI AfzalDocument62 pagesRapport ADEOTI Afzalfacinet bangouraPas encore d'évaluation
- RadhortDocument8 pagesRadhortGaucho Ondoua100% (1)
- La VodkaDocument1 pageLa VodkaSebastien MorangePas encore d'évaluation
- Alimentation Seignalet 2013Document13 pagesAlimentation Seignalet 2013Laure LagrandcourtPas encore d'évaluation
- Que Choisir - Mai 2024Document68 pagesQue Choisir - Mai 2024pat VgpPas encore d'évaluation
- Projet de Fin D Annee CbgsDocument49 pagesProjet de Fin D Annee CbgsAdam KharbouchePas encore d'évaluation
- Kitchen Machine Compacte Avec Blender Compact Kitchen Machine With Blender Robot de Cocina Compacto Con Batidora Compacte Keukenrobot Met BlenderDocument47 pagesKitchen Machine Compacte Avec Blender Compact Kitchen Machine With Blender Robot de Cocina Compacto Con Batidora Compacte Keukenrobot Met BlenderremikhaledPas encore d'évaluation