Académique Documents
Professionnel Documents
Culture Documents
2006 Antilles Exo2 Sujet Lait 6 5pts
Transféré par
Med BriniCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2006 Antilles Exo2 Sujet Lait 6 5pts
Transféré par
Med BriniDroits d'auteur :
Formats disponibles
Antilles 2006
Exercice n2 : ANALYSE DUN LAIT (6,5 points)
Les parties 1. et 2. de cet exercice sont indpendantes et peuvent tre traites sparment.
On se propose de dterminer les masses en ions chlorure et en acide lactique prsents dans un lait.
1. DOSAGE PAR CONDUCTIMTRIE.
1.1.
On prlve un volume V0 = 20,0 mL de lait (solution S0) et on les introduit dans une fiole jauge
de volume VS = 100,0 mL.
On complte avec de leau distille et on homognise pour obtenir une solution S, de
concentration CS. Quel rapport existe entre la concentration C0 de la solution S0 et la
concentration CS de la solution S ?
1.2.
On verse un volume V1 = 10,0 mL de la solution S dans un bcher et on y ajoute environ 250 mL
deau distille. Indiquer prcisment le protocole suivre pour prlever 10,0 mL de solution
S (matriel utilis, manipulations effectuer).
1.3.
On plonge ensuite dans le bcher une cellule conductimtrique.
Initialement et aprs chaque ajout, mL par mL, dune solution aqueuse de nitrate dargent
(Ag+(aq) + NO3(aq)) de concentration C2 = 5,0010-3 mol.L-1 on dtermine la conductivit du
milieu ractionnel.
Indiquer, sur un schma annot, le dispositif exprimental mettre en place.
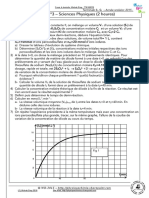
Le suivi conductimtrique du dosage permet dobtenir la courbe dvolution de la conductivit du
milieu ractionnel en fonction du volume V2 de la solution de nitrate dargent vers (document N1
donn en ANNEXE N2, rendre avec la copie). La transformation chimique, rapide, met
uniquement en jeu les ions chlorure et les ions argent selon lquation de raction :
Ag+(aq) +
Cl(aq) = AgCl(s)
Rappel : Le chlorure dargent AgCl est un solide blanc, pratiquement insoluble dans leau, qui noircit
la lumire.
1.4.
Quelle est lorigine de la conductivit initiale de la solution ?
1.5.
En utilisant les valeurs des conductivits molaires ioniques donnes ci-dessous, interprter la
variation de la valeur de la conductivit du milieu ractionnel au cours du dosage.
25C :
(Cl(aq)) = 76,310-4 m.S.mol-1
(NO3(aq)) = 71,410-4 m.S.mol-1
(Ag+(aq)) = 61,910-4 m.S.mol-1
1.6.
Quel vnement correspond au point particulier apparaissant sur la courbe = f(V2) ?
1.7.
Dterminer, en utilisant cette courbe, le volume V2E de solution de nitrate dargent vers
lquivalence.
1.8.
Quelle est lquivalence la relation entre la quantit de matire en ions argent introduits et la
quantit de matire en ions chlorure initialement prsents ?
1.9.
En dduire la concentration molaire CS en ions chlorure initialement prsents dans la solution S,
puis celle C0 dans le lait.
1.10. La masse dions chlorure prsents dans un litre de lait doit tre comprise entre 1,0 g et 2,0 g.
Calculer la masse dions chlorure prsents dans le lait tudi et conclure.
Donne : masse molaire des ions chlorure : M(Cl) = 35,5 g.mol-1.
2. DOSAGE DE LACIDE LACTIQUE
Un lait frais ne contient pas dacide lactique. En vieillissant, le lactose prsent dans le lait se
transforme en acide lactique, not par la suite HA.
On dose lacide lactique, considr comme le seul acide prsent dans le lait tudi, par une solution
dhydroxyde de sodium : Na+(aq) + HO(aq) (soude) de concentration CB = 5,0010-2 mol.L-1.
On prlve un volume VA = 20,0 mL de lait que lon place dans un bcher et on suit lvolution du pH
en fonction du volume VB de soude vers.
2.1.
crire lquation de la raction qui se produit lors du mlange. Quelles caractristiques doit
prsenter cette raction pour tre adapte un dosage ?
2.2.
Exprimer puis calculer la constante de raction K correspondante. Conclure.
H2O/HO(aq) : pKA1 = 14,0
H3O+/H2O
: pKA2 = 0,0
HA(aq)/A(aq) : pKA3 = 3,9
Donnes : couples acide/base :
On obtient les valeurs donnes dans le tableau suivant :
VB
(mL)
2,0
4,0
6,0
8,0
10
11
11,5
12
12,5
13
14
16
pH
2,9
3,2
3,6
3,9
4,2
4,6
4,9
6,3
8,0
10,7
11,0
11,3
11,5
2.3.
En utilisant un diagramme de prdominance, dterminer quelle est, entre HA(aq) et A(aq) lespce
chimique prdominante au dbut du dosage.
2.4.
Pour quel volume de soude vers, HA(aq) et A(aq) sont-elles prsentes en quantits gales ?
2.5.
Le trac du graphe reprsentant lvolution du pH en fonction du volume de soude vers montre
que lquivalence acide base est atteinte pour un volume de soude VB = 12,0 mL.
En dduire la quantit de matire dacide lactique prsente dans le volume VA de lait.
2.6.
On considre quun lait frais a une concentration en acide lactique infrieure 1,8 g.L-1.
Quelle est la masse dacide lactique prsente dans un litre de lait ? Conclure ?
Donne :masse molaire molculaire de lacide lactique : M(HA) = 90 g.mol-1.
ANNEXE (A RENDRE AVEC LA COPIE)
DOCUMENT N1
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- 2006 Antilles Exo2 Sujet Lait 6 5ptsDocument3 pages2006 Antilles Exo2 Sujet Lait 6 5ptssherynn6Pas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Analyse DDocument6 pagesAnalyse DFatima BarikPas encore d'évaluation
- Dosage ExDocument2 pagesDosage ExHou ChanPas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 pagesCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyPas encore d'évaluation
- Exercices PDFDocument4 pagesExercices PDFالغزيزال الحسن EL GHZIZAL Hassane100% (3)
- 2022 CentresEtrangers2 J2 ExoA Correction VanilleConducti 5pts 1Document2 pages2022 CentresEtrangers2 J2 ExoA Correction VanilleConducti 5pts 1wakil.paris2Pas encore d'évaluation
- Serie 5 Et 6 Solution Aqueuse Acide Fort Base ForteDocument7 pagesSerie 5 Et 6 Solution Aqueuse Acide Fort Base ForteCheujeu chaldouPas encore d'évaluation
- 2011 Metropole Exo1 Sujet Detartrant 6 5ptsDocument5 pages2011 Metropole Exo1 Sujet Detartrant 6 5pts667 ByronPas encore d'évaluation
- TD Dosages Directs 1Document1 pageTD Dosages Directs 1Youssef Arba100% (1)
- AEC8 Titrages ConductimétrieDocument5 pagesAEC8 Titrages ConductimétrieHoda AMENZOUPas encore d'évaluation
- Dosage Sulfate de Cuivre Spect Cu Cond SO4Document4 pagesDosage Sulfate de Cuivre Spect Cu Cond SO4Mohamed El gharbiPas encore d'évaluation
- Devoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)Document2 pagesDevoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)la physique selon le programme FrançaisPas encore d'évaluation
- TP Chimie 1 Rappels)Document2 pagesTP Chimie 1 Rappels)youma009Pas encore d'évaluation
- Exercices 3transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuse - CopieDocument1 pageExercices 3transformations Liées À Des Réactions Acido - Basiques Dans Une Solution Aqueuse - Copielabiadsihame73Pas encore d'évaluation
- DS2 Tspé 2020-2021-5Document5 pagesDS2 Tspé 2020-2021-5hanaemaaroufPas encore d'évaluation
- Réactions Acido-Basiques PDFDocument9 pagesRéactions Acido-Basiques PDFAzizElheniPas encore d'évaluation
- Acides Et Bases SMDocument23 pagesAcides Et Bases SMSalma ZaPas encore d'évaluation
- Série 1 SMDocument1 pageSérie 1 SMayoubPas encore d'évaluation
- Tle CD PCTDocument57 pagesTle CD PCTdupontvania822Pas encore d'évaluation
- Exercice 1 (7 Points) Propriétés D'un AlcoolDocument7 pagesExercice 1 (7 Points) Propriétés D'un AlcoolKeys of H.A.Pas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- Solutions AqueuesDocument3 pagesSolutions AqueuesnorelPas encore d'évaluation
- Examen National Physique Chimie SPC 2014 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2014 Normale SujetaarabkholoudPas encore d'évaluation
- Exam - 2014-SN - PC - BIOF (WWW - Pc1.ma) PDFDocument7 pagesExam - 2014-SN - PC - BIOF (WWW - Pc1.ma) PDFRabiaa BabiPas encore d'évaluation
- Correction TP3 Dosage Ions ChlorureDocument4 pagesCorrection TP3 Dosage Ions ChlorureYancouba BadjiPas encore d'évaluation
- Renforcement PH - Acide Fort Et Tampon 2022Document5 pagesRenforcement PH - Acide Fort Et Tampon 2022GueyePas encore d'évaluation
- Serie1 ChimeDocument3 pagesSerie1 ChimeJabri ImenePas encore d'évaluation
- ch02 61 Exos SupDocument6 pagesch02 61 Exos SupskanderPas encore d'évaluation
- 2008 Pondichery Exo1 Sujet Ammoniac 7ptsDocument3 pages2008 Pondichery Exo1 Sujet Ammoniac 7ptsla physique selon le programme Français100% (1)
- Activité DosageDocument2 pagesActivité DosageMouna LaàtarPas encore d'évaluation
- Exo Chimie 2009 SRDocument1 pageExo Chimie 2009 SRlina elouadihPas encore d'évaluation
- Exercice 1: (6 Points) La Soude Caustique NaohDocument7 pagesExercice 1: (6 Points) La Soude Caustique NaohAli RammalPas encore d'évaluation
- TD-Acide Base - PH - WahabdiopDocument3 pagesTD-Acide Base - PH - WahabdiopNDEYE FATOU CISSE NIASSEPas encore d'évaluation
- TD Acide Fort Base Forte Dosage TS2Document10 pagesTD Acide Fort Base Forte Dosage TS2pathediakhate4Pas encore d'évaluation
- EXERCICES Concentration Solutions ÉlectrolytiquesDocument3 pagesEXERCICES Concentration Solutions ÉlectrolytiquesAngel of perditionPas encore d'évaluation
- Exercices Corriges Chimie en SolutionDocument157 pagesExercices Corriges Chimie en SolutionKhalid Zeg83% (23)
- Titrage ConductimétriqueDocument3 pagesTitrage Conductimétriquekarimzid100% (1)
- Séri N°12Document5 pagesSéri N°12Jihad ELPas encore d'évaluation
- Généralités Sur Les Solutions Aqueuses 2022Document2 pagesGénéralités Sur Les Solutions Aqueuses 2022Abdou FallPas encore d'évaluation
- Contrôle Tle Du 01.10.2022.Document2 pagesContrôle Tle Du 01.10.2022.Kevin nougwaPas encore d'évaluation
- 2011-Polynesie-Exo1-Sujet-Detartrant-7pts 2Document2 pages2011-Polynesie-Exo1-Sujet-Detartrant-7pts 2Tibo SansonPas encore d'évaluation
- F1 Sdevoir Transf Chimiques CorrigeDocument2 pagesF1 Sdevoir Transf Chimiques Corrigejad mamouPas encore d'évaluation
- TD en Amphi Des 22Document4 pagesTD en Amphi Des 22JULIENPas encore d'évaluation
- DosageDocument3 pagesDosageNourhene AbidPas encore d'évaluation
- Acide Base +dosage1Document2 pagesAcide Base +dosage1hamzacrypto080Pas encore d'évaluation
- Sujet TD N°2Document2 pagesSujet TD N°2Abiel Asaël LadeyoPas encore d'évaluation
- Serie Acide Fort Base Forte DosageDocument6 pagesSerie Acide Fort Base Forte DosageAmadou Oury DialloPas encore d'évaluation
- 201701271158125 (3)Document9 pages201701271158125 (3)Ali RammalPas encore d'évaluation
- AFBF2021Document2 pagesAFBF2021Abdourahmane BaPas encore d'évaluation
- Dusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 PtsDocument3 pagesDusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 Ptsla physique selon le programme FrançaisPas encore d'évaluation
- Exercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 5transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseIman QPas encore d'évaluation
- Serie 7 ChimieDocument6 pagesSerie 7 ChimieJabri ImenePas encore d'évaluation
- Dosage Acide BaseDocument4 pagesDosage Acide BaseSaifeddine Makni0% (1)
- Cours de VirologieDocument5 pagesCours de VirologieFrancisca AgboviPas encore d'évaluation
- Exam 3 SMDocument4 pagesExam 3 SMKhaouda Driss100% (1)
- Chimie Exemple 3Document9 pagesChimie Exemple 3Serge DemirdjianPas encore d'évaluation
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniPas encore d'évaluation
- C01 Cinetique CorrectionDocument5 pagesC01 Cinetique CorrectionMed BriniPas encore d'évaluation
- 2008 09 Antilles Exo3 Sujet Titrage DemiEq PKa 4ptsDocument2 pages2008 09 Antilles Exo3 Sujet Titrage DemiEq PKa 4ptsMed BriniPas encore d'évaluation
- Cours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Document4 pagesCours Physique Nature Ondulatoire de La Lumiere Sciences2016 Eleve1Med BriniPas encore d'évaluation
- Devoir de Synthese N - 1-2Document5 pagesDevoir de Synthese N - 1-2Med BriniPas encore d'évaluation
- On Réalise Le Montage Schématisé CiDocument11 pagesOn Réalise Le Montage Schématisé CiMed BriniPas encore d'évaluation
- Particule Dans Champ ElectDocument1 pageParticule Dans Champ ElectMed BriniPas encore d'évaluation
- D5 TS1 2016 LSLL Wahabdiop PDFDocument3 pagesD5 TS1 2016 LSLL Wahabdiop PDFMed BriniPas encore d'évaluation
- CO1 TS2 2016 LSLL WahabdiopDocument4 pagesCO1 TS2 2016 LSLL WahabdiopMed BriniPas encore d'évaluation
- Physique Terminale PDFDocument175 pagesPhysique Terminale PDFMed Brini100% (2)
- Sal-Dev 2 15-16 TS2Document2 pagesSal-Dev 2 15-16 TS2Med BriniPas encore d'évaluation
- D3 TS2 2017 Copel WahabdiopDocument2 pagesD3 TS2 2017 Copel WahabdiopMed BriniPas encore d'évaluation
- 2009 Afrique Exo3 Sujet Quantique Brahic 4ptsDocument3 pages2009 Afrique Exo3 Sujet Quantique Brahic 4ptsla physique selon le programme FrançaisPas encore d'évaluation
- Ac - Base 1Document2 pagesAc - Base 1Med BriniPas encore d'évaluation
- CO1 TS2 2016 LSLL WahabdiopDocument4 pagesCO1 TS2 2016 LSLL WahabdiopMed BriniPas encore d'évaluation
- Project NavireDocument3 pagesProject NavireMed BriniPas encore d'évaluation
- CO2 TS2 2016 LSLL Interrompu WahabdiopDocument4 pagesCO2 TS2 2016 LSLL Interrompu WahabdiopMed BriniPas encore d'évaluation
- CO1 TS1 2016 Lolb Wahabdiop-1Document4 pagesCO1 TS1 2016 Lolb Wahabdiop-1Med Brini0% (1)
- D3 TS2 2017 Copel WahabdiopDocument2 pagesD3 TS2 2017 Copel WahabdiopMed BriniPas encore d'évaluation
- Sal-Dev 2 15-16 TS2Document2 pagesSal-Dev 2 15-16 TS2Med BriniPas encore d'évaluation
- D3 TS1 2016 LSLL Full WahabdiopDocument3 pagesD3 TS1 2016 LSLL Full WahabdiopMed BriniPas encore d'évaluation
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 pagesD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniPas encore d'évaluation
- D0 TS2 2006 LSLL Ramplacement WahabdiopDocument2 pagesD0 TS2 2006 LSLL Ramplacement WahabdiopMed BriniPas encore d'évaluation
- Le Livre de PHYSIQUE - CHIMIE 1er S PDFDocument88 pagesLe Livre de PHYSIQUE - CHIMIE 1er S PDFالغزيزال الحسن EL GHZIZAL Hassane89% (44)
- Exercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFDocument3 pagesExercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFMed BriniPas encore d'évaluation
- Sal-Dev 1 15-16 TS3Document3 pagesSal-Dev 1 15-16 TS3Med BriniPas encore d'évaluation
- Sal-Dev 2 15-16-TS3Document3 pagesSal-Dev 2 15-16-TS3Med BriniPas encore d'évaluation
- D2 TS1 2016 Lolb WahabdiopDocument4 pagesD2 TS1 2016 Lolb WahabdiopMed BriniPas encore d'évaluation
- Le Livre de PHYSIQUE - CHIMIE 1er S PDFDocument88 pagesLe Livre de PHYSIQUE - CHIMIE 1er S PDFالغزيزال الحسن EL GHZIZAL Hassane89% (44)
- Exercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFDocument3 pagesExercices Champs Electrique Et Energie Potntielle Electrique SM 12 PDFMed BriniPas encore d'évaluation
- Alexandre Soljenitsyne - Une Journée D'ivan DenissovitchDocument71 pagesAlexandre Soljenitsyne - Une Journée D'ivan Denissovitchtudorash100% (5)
- Présentation Lwa3ra FinalDocument22 pagesPrésentation Lwa3ra FinalAmine ChaTtPas encore d'évaluation
- Types de Tourisme 2Document9 pagesTypes de Tourisme 2Hassan SanwalPas encore d'évaluation
- Exercices Organique Corrige Web PDFDocument11 pagesExercices Organique Corrige Web PDFYASSINPas encore d'évaluation
- Lesadaptationsth 00 ParrDocument228 pagesLesadaptationsth 00 Parr9abbousePas encore d'évaluation
- La Gestion Strategique Des Achats InternationauxDocument15 pagesLa Gestion Strategique Des Achats InternationauxChristophe RouxPas encore d'évaluation
- Liste Documents - Crédit D'exploitationDocument2 pagesListe Documents - Crédit D'exploitationSARL NUTRINORPas encore d'évaluation
- Cours TD4Document16 pagesCours TD4el kadiriPas encore d'évaluation
- Appel D'offre TypeDocument69 pagesAppel D'offre TypeHassan BaddiPas encore d'évaluation
- Mesure EntrepreneuriatDocument90 pagesMesure EntrepreneuriatTifyur BudasPas encore d'évaluation
- Cuisine IndienneDocument21 pagesCuisine Indiennedukynut100% (4)
- CONTROLES DES COMPTES (Comptes de Tiers) (Généralités)Document34 pagesCONTROLES DES COMPTES (Comptes de Tiers) (Généralités)Zineb Ajraoui100% (8)
- Votre Reçu de Billet ElectroniqueDocument2 pagesVotre Reçu de Billet Electroniquebienvenu100% (1)
- Vocabulaire Du Voyage en AnglaisDocument2 pagesVocabulaire Du Voyage en AnglaisquereurPas encore d'évaluation
- Dossier Appel D'offre PDC Dabaga NigerDocument18 pagesDossier Appel D'offre PDC Dabaga NigerHyacinthe KossiPas encore d'évaluation
- Estivage Fhii 2018Document12 pagesEstivage Fhii 2018etige aminePas encore d'évaluation
- Responsable Dagnece de VoyagesDocument2 pagesResponsable Dagnece de VoyagesKANOUN ABDELLAHPas encore d'évaluation
- CHAPITRE 3-Les Produits Semi-Finis PDFDocument4 pagesCHAPITRE 3-Les Produits Semi-Finis PDFAli Janati Idrissi100% (2)
- Budget: Projet de Loi de Finances 2012-2013Document198 pagesBudget: Projet de Loi de Finances 2012-2013jean_juniorj100% (1)
- StatutsDocument4 pagesStatutsfidelPas encore d'évaluation
- Qualité Du Service CommercialeDocument2 pagesQualité Du Service CommercialeAnonymous eUYlJnsWW1Pas encore d'évaluation
- Audit InterneDocument69 pagesAudit InterneDhahri TarekPas encore d'évaluation
- Cours ISGP Impôts Différés 25 MarsDocument35 pagesCours ISGP Impôts Différés 25 Marsbelgodjo100% (1)
- Holcim 1Document266 pagesHolcim 1Mohammed Hani100% (1)
- Perfectionnement Audit Qualité InterneDocument36 pagesPerfectionnement Audit Qualité Internesidoummou1985100% (6)
- Annexe 1Document1 pageAnnexe 1Soukaina MaazouzPas encore d'évaluation
- 3 PDFDocument2 pages3 PDFAnonymous SVOjPTDIJGPas encore d'évaluation
- Exercices 2A TSGEDocument10 pagesExercices 2A TSGENoor JannaPas encore d'évaluation
- Résumé CN 1 PDFDocument1 pageRésumé CN 1 PDFOussama Oubad OxPas encore d'évaluation
- Aulet, Bill - La Discipline Entrepreneuriale - 24 Étapes Pour Développer Une Entreprise Avec Succès-Eyrolles (2019) PDFDocument309 pagesAulet, Bill - La Discipline Entrepreneuriale - 24 Étapes Pour Développer Une Entreprise Avec Succès-Eyrolles (2019) PDFclem1983100% (1)