Académique Documents
Professionnel Documents
Culture Documents
Chapitre 3 - La Qualité Dans Lindustrie Pharmaceutique
Transféré par
Farah AggTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 3 - La Qualité Dans Lindustrie Pharmaceutique
Transféré par
Farah AggDroits d'auteur :
Formats disponibles
Chapitre 3 : La qualité dans l’industrie pharmaceutique
Chapitre 3 : La qualité dans l’industrie pharmaceutique
I. Introduction
La qualité d’un médicament est celle du prototype décrit dans le dossier de demande
d’Autorisation de Mise sur le Marché (AMM). La qualité se conçoit puis se fabrique, en
appliquant les référentiels correspondant à :
La conception qui aboutit à la réalisation d’un lot rigoureusement défini dans le
dossier d’enregistrement. C’est le « prototype » définie au cours de la phase
développement, qui fera l’objet d’une demande d’autorisation de mise sur le marché,
La production dont l’objectif est de reproduire industriellement le prototype.
Dans ce chapitre, on s’intéresse par la partie production.
II. Présentation
Une usine de fabrication des médicaments peut être considérée schématiquement comme
une enceinte dans laquelle il entre des matières premières et d’où il sort des produits de
qualité définie et des déchets.
Les produits de qualité définie sont, plus précisément des lots de médicaments :
Rigoureusement conformes aux exigences du dossier d’AMM,
Identiques entre eux;
Homogènes
D’où la nécessité de mettre en place tout un système d’assurance de la qualité.
III. La qualité dans les réglementations
L’activité pharmaceutique industrielle obéit aux réglementations. La réglementation
algérienne régit l’ensemble des activités liées à l’industrie pharmaceutique. Elle exige la
conformité aux Bonnes Pratiques de Fabrication (BPF), qui sont un ensemble de
recommandations qui s’assurent que le produit est fabriqué et contrôlé conformément
aux standards de qualité appropriés contenus dans sa décision d’enregistrement (ou
autorisation de mise sur le marché). De plus, la qualité apparait dans toutes les parties du
guide BPF et constitue même des chapitres entiers : le système qualité pharmaceutique,
le contrôle de la qualité ainsi que la gestion du risque qualité.
L’Algérie étant membre de l’organisation mondiale de la santé, ceci consolide sa trame
réglementaire en matière d’industrie du médicament en obligeant les opérateurs
Industrialisation des procédés (L3 GPP)_ Dr BOUKHELKHAL Asmaa 1
Chapitre 3 : La qualité dans l’industrie pharmaceutique
algériens et étrangers exerçant en Algérie à se conformer aux exigences des bonnes
pratiques de fabrication et des guides émis par l’OMS dans le but de faciliter l’application
des BPF.
IV. Objectifs
La gestion qualité pharmaceutique permet de concrétiser trois principaux objectifs qui
complètent et renforcent les exigences des référentiels :
1. Assurer la réalisation du produit
Il s’agit d’établir, d’installer puis de maintenir un système capable d’assurer la mise à
disposition de produits de qualité appropriée pour satisfaire aux besoins des patients, des
professionnels de santé et des autorités réglementaires.
2. Etablir et maintenir une phase de maitrise
L’objectif est de développer et d’utiliser des systèmes efficaces de surveillance et de
contrôle de la performance du procédé et de la qualité des produits, offrant ainsi
l’assurance du maintien de la pertinence et des capacités des processus.
3. Faciliter l’amélioration continue
Il convient d’identifier et de mettre en œuvre les améliorations appropriées sur le procédé
et la qualité du produit, de réduire les variabilités, de renforcer les innovations et le
système qualité pharmaceutique. Et ce, afin d’augmenter la capacité à satisfaire
constamment les besoins en qualité.
V. L’assurance qualité
Dans une entreprise pharmaceutique, l’Assurance Qualité est un outil de gestion qui
couvre tout ce qui peut, individuellement ou collectivement, influencer la qualité du
produit. C’est l’ensemble des mesures prises pour s’assurer que les médicaments
fabriqués sont de la qualité requise pour l’usage auquel ils sont destinés.
Les bonnes pratiques de fabrication (BPF) des médicaments constituent un des
éléments de l'assurance de la qualité qui garantit que les produits sont fabriqués et
contrôlés de façon cohérente et selon les normes de qualité adaptées à leur emploi. En
considérons les volets suivants :
Industrialisation des procédés (L3 GPP)_ Dr BOUKHELKHAL Asmaa 2
Chapitre 3 : La qualité dans l’industrie pharmaceutique
1. Système qualité pharmaceutique
Le responsable de l'établissement de fabrication doit fabriquer des médicaments :
Adaptés à l'emploi,
Répondant aux exigences du dossier d'autorisation de mise sur le marché
N'exposant les patients à aucun risque lié à des carences en matière de sécurité, de
qualité ou d'efficacité.
La réalisation de cet objectif de qualité engage la responsabilité de la direction de
l'entreprise et requiert la participation et l'engagement du personnel dans les différents
départements et à tous les niveaux de l'entreprise qui doit posséder un système qualité
pharmaceutique bien conçu, correctement mis en œuvre et effectivement Contrôlé.
2. Personnel
Tout, repose sur la compétence et la disponibilité du personnel. La répartition des
responsabilités, la formation et la motivation sont des clés de la bonne gestion.
La délégation des responsabilités à des personnes compétentes doit se faire par écrit. Ceci
permettra de savoir à tout moment, Qui dépend de qui, Qui a autorité sur qui, et Qui fait
(ou qui a fait) quoi.
3. Locaux et matériel
Les locaux et le matériel doivent être situés, conçus, construits, adaptés et entretenus de
façon à convenir aux mieux aux opérations à effectuer.
Leur plan, leur agencement, leur conception et leur utilisation doivent tendre Pour :
Minimiser les risques d’erreurs,
Permettre un nettoyage et un entretien faciles,
Eliminer les sources de contamination de toutes sortes, contaminations croisées
comprises.
4. Documents
On distingue deux types de documents écrits :
Les instructions écrites ou procédures dont le rôle est de donner des instructions
précises pour produire et pour contrôler,
Industrialisation des procédés (L3 GPP)_ Dr BOUKHELKHAL Asmaa 3
Chapitre 3 : La qualité dans l’industrie pharmaceutique
Les recueils de données (relevés, compte-rendu, documents dits de suivi,
enregistrement, etc.) dont le but est de recueillir toutes les informations sur les
opérations en cours de production et de contrôle.
L’ensemble des données concernant un lot de médicament constitue son « dossier de lot»
5. Production
Une unité de production pharmaceutique est constituée par un ensemble de locaux
délimités, traversés par un flux de matière dont la qualité doit être parfaitement maitrisée.
Les matières premières en provenances des fournisseurs subissent à l’intérieur des
transformations qui d’étapes en étapes, conduisent à des lots de produits finis.
Les deux étapes clés sont le passage des fournitures (principe actifs, excipients et articles
de conditionnement) de la quarantaine aux magasins centraux ce qui correspond à la
«prise en stock pharmaceutique » et passage des produits finis du magasin à l’expédition
qui correspond à « libération des lots »
6. Contrôle
Le contrôle, c’est la phase mal aimée à qui l’on reproche bien souvent de couter trop cher,
oubliant quelque fois que le contrôle est le prix de la sécurité. En effet le contrôle coute. Il
ne produit pas, il consomme de la matière et pour les produits chers, le prix de
l’échantillonnage est loin d’être négligeable. Il immobilise les produits (Matières
premières et Produits terminés) pendant un certain temps, donc augmente la durée des
stocks. Ce qui entraine un accroissement de l’immobilisation de trésorerie. Il exige des
installations et appareils de laboratoire de plus en plus sophistiqués et couteux faisant
appel à des techniques très élaborés susceptible d’exiger un personnel spécialisé ou au
maximum une formation particulière du personnel existant.
Le contrôle est fondé sur les principes suivants :
Les matières premières, articles de conditionnement et médicaments sont
fabriqués par lots,
Un lot est une quantité définie fabriqué en une opération ou une série d’opérations
telle que cette quantité puisse être considérée comme homogène,
Chaque lot est caractérisé par un numéro de lot,
Le contrôle doit être effectué sur un échantillon représentatif d’un lot.
Industrialisation des procédés (L3 GPP)_ Dr BOUKHELKHAL Asmaa 4
Chapitre 3 : La qualité dans l’industrie pharmaceutique
Le contrôle s’exerce à tous les stades :
Sur les matières premières et articles de conditionnement (contrôle à réception
qui doit tenir compte du système d’assurance de la qualité du fournisseur),
Sur le produit en cours de fabrication à différents stades de la fabrication,
Sur le produit fini par rapport aux spécifications déclarées dans le dossier d’AMM.
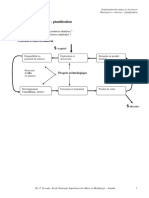
Figure : Organisation du contrôle de qualité dans une usine pharmaceutique
7. Réclamation et rappels des médicaments
Tout fabricant doit mettre en œuvre un système de traitement des réclamations ainsi
qu'un système de rappel rapide des médicaments présents dans le circuit de distribution.
Toute réclamation doit être enregistrée et étudiée par le fabricant.
8. Auto-inspection
L’auto-inspection fait partie du système d’assurance qualité. Les objectifs sont :
De s’assurer du respect des BPF,
De vérifier le bon fonctionnement et l’efficacité du système qualité,
De proposer des mesures correctives si nécessaires, d’en assurer le suivi et
d’évaluer leur efficacité.
Industrialisation des procédés (L3 GPP)_ Dr BOUKHELKHAL Asmaa 5
Vous aimerez peut-être aussi
- 2 - Assurance Qualité Et BPFDocument7 pages2 - Assurance Qualité Et BPFmaria mariPas encore d'évaluation
- Généralités Industrie 2015Document6 pagesGénéralités Industrie 2015salimPas encore d'évaluation
- Stage en Industrie PharmaceutiqueDocument4 pagesStage en Industrie PharmaceutiqueInes SahraouiPas encore d'évaluation
- 1 - Contrôle Qualité Dans Les BPFDocument6 pages1 - Contrôle Qualité Dans Les BPFSou RirePas encore d'évaluation
- Assurance Qualité en PharmaceutiqueDocument27 pagesAssurance Qualité en PharmaceutiqueHabib TabetiPas encore d'évaluation
- Généralités - Industrie PharmaceutiqueDocument5 pagesGénéralités - Industrie Pharmaceutiquemouma mimiPas encore d'évaluation
- Autorisation de Mise Sur Le Marché: 1. Au Niveau Mondial: Le Format CTDDocument8 pagesAutorisation de Mise Sur Le Marché: 1. Au Niveau Mondial: Le Format CTDSoumia Abide100% (1)
- 1 Conception Et Processus de Développement Des Medicaments FINALDocument14 pages1 Conception Et Processus de Développement Des Medicaments FINALtebbakh tebbakhPas encore d'évaluation
- BPFDocument55 pagesBPFaminePas encore d'évaluation
- 05-Validation Des ProcédésDocument8 pages05-Validation Des ProcédésAbdellatif Aidoud100% (1)
- Les Bonnes Pratiques de Fabrication RésuméDocument16 pagesLes Bonnes Pratiques de Fabrication RésuménourPas encore d'évaluation
- Management Qualité en Industrie PharmaceutiqueDocument49 pagesManagement Qualité en Industrie PharmaceutiqueWalid Masmoudi100% (1)
- Outil d'évaluation des systèmes de contrôle des aliments: Introduction et glossaireD'EverandOutil d'évaluation des systèmes de contrôle des aliments: Introduction et glossairePas encore d'évaluation
- Pharmacien ResponsableDocument12 pagesPharmacien ResponsableislemPas encore d'évaluation
- RapportDocument28 pagesRapportJouini ZakariaPas encore d'évaluation
- Pharmacie 2020 GuiraudDocument76 pagesPharmacie 2020 GuiraudRamzi FathallahPas encore d'évaluation
- Fabrication Des MédicamentsDocument19 pagesFabrication Des MédicamentsJouini ZakariaPas encore d'évaluation
- Cours 5ème Année Contrôle Qualité de La Substance Active.Document34 pagesCours 5ème Année Contrôle Qualité de La Substance Active.Paul Fathead100% (1)
- 7 Dispositif MedicauxDocument17 pages7 Dispositif MedicauxMoutarou Boiro100% (1)
- Controles de SterilisationDocument36 pagesControles de Sterilisationsaid3232Pas encore d'évaluation
- El MoussaouiDocument62 pagesEl MoussaouiOthman MaaiPas encore d'évaluation
- Formulation Transposition DechelleDocument15 pagesFormulation Transposition DechelleAbdel HebirPas encore d'évaluation
- Cours AMM Variations IF 05032018Document64 pagesCours AMM Variations IF 05032018MED100% (1)
- Le Systeme Qualite PharmaceutiqueDocument60 pagesLe Systeme Qualite PharmaceutiqueOum Mohssine100% (1)
- Dispositifs Médicaux CoursDocument49 pagesDispositifs Médicaux Coursflown notePas encore d'évaluation
- Aspects Organisationnel D'un Laboratoire de Contrôle QualitéDocument34 pagesAspects Organisationnel D'un Laboratoire de Contrôle QualitésalimPas encore d'évaluation
- Eau À Usage PharmaceutiqueDocument18 pagesEau À Usage PharmaceutiqueMarwen AlouiPas encore d'évaluation
- Examen Propriétés Sensorielles Des AlimentsDocument5 pagesExamen Propriétés Sensorielles Des AlimentsIkramPas encore d'évaluation
- Les Essais Cliniques 19 207092265608892463575 PDFDocument29 pagesLes Essais Cliniques 19 207092265608892463575 PDFPedro KalvinPas encore d'évaluation
- Rapport de Stage Rym FinalDocument16 pagesRapport de Stage Rym FinalNou SsaPas encore d'évaluation
- Les Articles de ConditionnementDocument52 pagesLes Articles de ConditionnementOussama SaffihPas encore d'évaluation
- Arbre de Choix Des Tests Et Fonctions R - V3 PDFDocument1 pageArbre de Choix Des Tests Et Fonctions R - V3 PDFSophie ScottoPas encore d'évaluation
- Les Essais CliniquesDocument42 pagesLes Essais CliniquesWiam WiamPas encore d'évaluation
- Les Comités Pharmaceutiques Et Thérapeutiques PDFDocument160 pagesLes Comités Pharmaceutiques Et Thérapeutiques PDFguymbula100% (1)
- CONTROLE DE QUALITE ExposéDocument27 pagesCONTROLE DE QUALITE ExposéKamal BelhadjPas encore d'évaluation
- Controle Qualite MP-PF - 2019-2020 5e Année PharmacieDocument7 pagesControle Qualite MP-PF - 2019-2020 5e Année Pharmaciezineb fellaPas encore d'évaluation
- 5 Contrôle Du Processus - Gestion de L'échantillon. 14Document36 pages5 Contrôle Du Processus - Gestion de L'échantillon. 14Loyane LoïcPas encore d'évaluation
- Analyses Biologiques Master-1Document119 pagesAnalyses Biologiques Master-1Salma BabourPas encore d'évaluation
- Étiquetage InformatifDocument6 pagesÉtiquetage InformatifAyoub OUBAHAPas encore d'évaluation
- Labarere Jose p01Document16 pagesLabarere Jose p01youness.khalfaouiPas encore d'évaluation
- Assurance QualitéDocument208 pagesAssurance QualitéAristoman Fidel Andela WayPas encore d'évaluation
- La Déblisterisation en Industrie PharmaceutiqueDocument82 pagesLa Déblisterisation en Industrie Pharmaceutiquemetrologue haPas encore d'évaluation
- La Qualité Dans Les Laboratoires de Biologie MédicaleDocument112 pagesLa Qualité Dans Les Laboratoires de Biologie MédicaleMartial Art FaridPas encore d'évaluation
- Manuel Qualite PharmaDocument37 pagesManuel Qualite PharmaIsam Kisam50% (2)
- Qualité MedicamentDocument42 pagesQualité Medicamentمصطفى أبو عبد الرحمانPas encore d'évaluation
- EMDs de Pharmacie HospitalièreDocument43 pagesEMDs de Pharmacie HospitalièreYas Miine100% (1)
- Formulation PharmaceutiqueDocument17 pagesFormulation PharmaceutiqueLamiae Kaneb100% (2)
- Telecharger Le Plan Qualite Du Mali Globe Network - 5a35fc281723dd159ad44d8dDocument27 pagesTelecharger Le Plan Qualite Du Mali Globe Network - 5a35fc281723dd159ad44d8dToure ahmedPas encore d'évaluation
- 2-Circuit Du Médicament À L'hopital (Resume)Document6 pages2-Circuit Du Médicament À L'hopital (Resume)maya mhdPas encore d'évaluation
- Processus Préanalytique en Bactériologie PDFDocument6 pagesProcessus Préanalytique en Bactériologie PDFGhaniaPas encore d'évaluation
- La Politique Pharmaceutique en AlgérieDocument24 pagesLa Politique Pharmaceutique en Algériegirl_on_netPas encore d'évaluation
- Rapport Stage SIDHOMDocument53 pagesRapport Stage SIDHOMsihsPas encore d'évaluation
- Guide Bonnes Pratiques Biomedicales QuebDocument101 pagesGuide Bonnes Pratiques Biomedicales QuebDelondon AlasckoPas encore d'évaluation
- El MoussaouiDocument62 pagesEl MoussaouiToure ahmed100% (1)
- Affaire ReglementaireDocument2 pagesAffaire ReglementairesalimPas encore d'évaluation
- Validation Analytique Et Calcu - HAIDARA Hasnaa - 182Document53 pagesValidation Analytique Et Calcu - HAIDARA Hasnaa - 182yassinePas encore d'évaluation
- Guide-Bonnes-Pratiques-De Stérilisation 07-2021-VDDocument229 pagesGuide-Bonnes-Pratiques-De Stérilisation 07-2021-VDAbPas encore d'évaluation
- Processus de Production Selon BPFDocument37 pagesProcessus de Production Selon BPFwassim hamdikenePas encore d'évaluation
- La Qualite Microbiologique Des Medicaments PDFDocument121 pagesLa Qualite Microbiologique Des Medicaments PDFdodoPas encore d'évaluation
- Microbiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitaireD'EverandMicrobiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitairePas encore d'évaluation
- Cevap AnahtarıDocument1 pageCevap AnahtarıVeliPas encore d'évaluation
- 2M120 TD 2016 ch1 Codes CorrecteursDocument2 pages2M120 TD 2016 ch1 Codes CorrecteurskokiPas encore d'évaluation
- World of Warcraft - Wrath of The Lich King - Arthas, My SonDocument4 pagesWorld of Warcraft - Wrath of The Lich King - Arthas, My SonAdrian Angel LagrecaPas encore d'évaluation
- Biochimie 08 - Réplication Et Réparation Des Erreurs AssociéesDocument14 pagesBiochimie 08 - Réplication Et Réparation Des Erreurs AssociéesNathan CohenPas encore d'évaluation
- CH1 (Introduction Au SI) PDFDocument17 pagesCH1 (Introduction Au SI) PDFEL OUAZZANI PRINTPas encore d'évaluation
- ProjetDocument4 pagesProjetEya AwadiPas encore d'évaluation
- QP1C General 1 PDFDocument5 pagesQP1C General 1 PDFSamson KlouganPas encore d'évaluation
- Transformateurs MonophasésDocument51 pagesTransformateurs MonophasésDo OuPas encore d'évaluation
- Catalogue OKOFEN 2018 2019Document68 pagesCatalogue OKOFEN 2018 2019joseph38Pas encore d'évaluation
- MicrobiologieDocument5 pagesMicrobiologieInes FirasPas encore d'évaluation
- TP Controle Optimal PDFDocument29 pagesTP Controle Optimal PDFHamza El-houariPas encore d'évaluation
- Laddition Des Nombres Entiers CM2Document8 pagesLaddition Des Nombres Entiers CM2chantal.aboujaoudehPas encore d'évaluation
- RapportDocument125 pagesRapportKawtar L AzaarPas encore d'évaluation
- Corrige Serie5Document4 pagesCorrige Serie5Chef FatimaPas encore d'évaluation
- Laboratoire Biolab Bamako - Recherche GoogleDocument1 pageLaboratoire Biolab Bamako - Recherche GoogleAlou CoulibalyPas encore d'évaluation
- Método de Violino - CajatiDocument41 pagesMétodo de Violino - CajatiWalmir PaiãoPas encore d'évaluation
- Manuel C2Document140 pagesManuel C2Daniel AndriamananaPas encore d'évaluation
- Les Approches Managériales Basées Sur Les Parties PrenantesDocument4 pagesLes Approches Managériales Basées Sur Les Parties PrenantesNohaila BencherquiPas encore d'évaluation
- RIB CopieDocument1 pageRIB CopieAbdoulaye CisséPas encore d'évaluation
- Programme Maths cm2Document1 pageProgramme Maths cm2gorguy100% (1)
- Exercice 3Document1 pageExercice 3test lili100% (1)
- Secours en Cours de RouteDocument32 pagesSecours en Cours de Routeantonio59100Pas encore d'évaluation
- Chapitre 3 Ressources Réserves PlanificationDocument10 pagesChapitre 3 Ressources Réserves PlanificationAdlanePas encore d'évaluation
- Brochure Nissan Urvan N350 15 PlacesDocument14 pagesBrochure Nissan Urvan N350 15 PlaceskonePas encore d'évaluation
- EKIP360 PrestationsTarifications LFRDocument30 pagesEKIP360 PrestationsTarifications LFRtouzanimahdiPas encore d'évaluation
- 5-Focales-Episode-2-Planification Et RégulationDocument42 pages5-Focales-Episode-2-Planification Et RégulationTaffyd MaertinsPas encore d'évaluation
- Examen Blanc Physique Chimie Bac DDocument4 pagesExamen Blanc Physique Chimie Bac Dkouassi hermann ulrich koffi100% (1)
- 1 - Cours2 Hydraulique Et Pneumatique (2éme Année Électromécanique)Document16 pages1 - Cours2 Hydraulique Et Pneumatique (2éme Année Électromécanique)Mohamed Hechmi JERIDIPas encore d'évaluation
- Serveur D'impression Sous Windows 2003Document6 pagesServeur D'impression Sous Windows 2003Issam BammouPas encore d'évaluation
- Examen Corrigé Marketing - Questionnaire À Choix Multiple (QCM)Document7 pagesExamen Corrigé Marketing - Questionnaire À Choix Multiple (QCM)Mar IemPas encore d'évaluation