Académique Documents
Professionnel Documents
Culture Documents
C Ex05 Cin Ca
Transféré par
ZedexterTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
C Ex05 Cin Ca
Transféré par
ZedexterDroits d'auteur :
Formats disponibles
Chimie
Détermination de l’ordre à partir des vitesses initiales
Exercice I-5
Exercice I-5 : Détermination de l’ordre à partir des vitesses initiales
Enoncé
On oxyde à température constante une solution d'iodure de potassium par une solution de nitrate
ferrique. Le pH du mélange est ajusté par de l'acide nitrique pour éviter toute réaction parasite. Pour
suivre l'évolution de la réaction, on prélève à la pipette à l'instant t après le début de l'oxydation un
volume connu de liquide et on le dilue dans l'eau. Le dosage est effectué sur la solution diluée ainsi
préparée. Son résultat est exprimé par le nombre x de moles d'ion I- qui ont été oxydées par litre de
mélange en réaction.
1- Ecrire l'équation de la réaction d'oxydation de l'iodure par les ions ferriques.
2- Pourquoi faut-il diluer la prise d'essai avant d'effectuer le dosage? Quelle méthode de dosage
peut-on utiliser pour suivre la réaction?
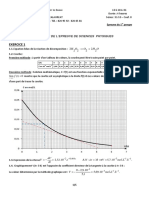
3- Le tableau rassemble les résultats d'un certain nombre de dosages successifs effectués au cours
d'une oxydation :
t (s) 99 217 321 471 587
x (µmol.L-1) 22 46 65 91 109
Montrer que ces résultats sont utilisables pour la détermination de la vitesse initiale.
4- On réalise deux séries d'expériences à température et pH constants :
• Concentration en ions iodure : [I-] = 4. 10-3 mol.L-1
[Fe3+]0 (mol.L- 1,67.10-3 8,21.10-3 18,18.10-3 25,15.10-3
1)
v0 (mol.L-1.s-1) 0,24.10-6 1,16.10-6 2,56.10-6 3,55.10-6
• Concentration en ions Fe(III) : [Fe3+] = 41,7. 10-3 mol.L-1
Page 1 Claude ANIES EduKlub S.A.
Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres autre que la
consultation individuelle et privée sont interdites.
Chimie
Détermination de l’ordre à partir des vitesses initiales
Exercice I-5
[I-]0 (mol.L-1) 4.10-3 9,59.10-3 12,96.10-3 13,31.10-3
v0 (mol.L-1.s-1) 0,24.10-6 1,35.10-6 2,47.10-6 2,62.10-6
a- Sachant que la vitesse globale initiale de la réaction peut s'écrire sous la forme :
v = k[I-]m[Fe3+]n
déterminer les ordres partiels m et n supposés entiers.
b- Déterminer la valeur moyenne de la constante de vitesse.
Page 2 Claude ANIES EduKlub S.A.
Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres autre que la
consultation individuelle et privée sont interdites.
Chimie
Détermination de l’ordre à partir des vitesses initiales
Exercice I-5
Correction :
1- L'équation de la réaction d'oxydation de l'iodure par les ions ferriques est :
Fe 3+ + I− →
← Fe2+ + 1 / 2 I2
2- Il faut diluer la prise d'essai avant d'effectuer le dosage pour bloquer la cinétique de cette réaction
(les concentrations en réactifs tendent vers 0 et la vitesse tend donc vers 0). Il existe d'autres
méthodes de blocage cinétique :
• diminution de la température ;
• utilisation d'un inhibiteur chimique qui réagit avec l'un des réactifs ou le catalyseur si la
réaction est catalysée !
• ici, les ions Fe3+ peuvent être éliminés par précipitation avec des ions hydroxydes par
exemple. On peut alors doser le diiode par des ions thiosulfates selon l'équation-bilan :
→
I2 + 2 S 2O 2−
3 ← 2 I− + S 4 O 2−
6
3- L'expression de la vitesse est :
v (t ) = −
[ ].
d I−
dt
Lorsqu'on trace x(t), l'opposé de la pente de la tangente à cette courbe en t = 0, permet de
déterminer la vitesse initiale.
4a- On réalise deux séries d'expériences à température et pH constants : pour la première expérience,
[I-] est fixée, pour la seconde c'est [Fe3+] qui est constante.
De la première expérience, on a :
[]
d I−
[ ]0 [I − ]0 = k app ⋅ [Fe3+ ]0
α β α
v (t = 0 ) = − = k ⋅ Fe3+
dt
t= 0
[]
β
avec kapp = k ⋅ I − 0 .
[ ]0
On trace donc : ln v (t = 0 ) en fonction de ln Fe3+ . il doit s'agir d'une droite de pente α = 1.
Page 3 Claude ANIES EduKlub S.A.
Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres autre que la
consultation individuelle et privée sont interdites.
Chimie
Détermination de l’ordre à partir des vitesses initiales
Exercice I-5
De même, grâce à la seconde expérience, on a :
[ ]0 [I − ]0 = k 'app ⋅[I − ]0
α β β
v (t = 0 ) = k ⋅ Fe3+
[ ]0 .
α
avec k'app = k ⋅ Fe3+
[ ]0
On trace donc : ln v (t = 0 ) en fonction de ln I − . il doit s'agir d'une droite de pente β = 2.
b- De ces deux expériences, on en déduit la valeur numérique de k :
k = 8,87 L2.mol-2.s-1
Page 4 Claude ANIES EduKlub S.A.
Tous droits de l’auteur des œuvres réservés. Sauf autorisation, la reproduction ainsi que toute utilisation des œuvres autre que la
consultation individuelle et privée sont interdites.
Vous aimerez peut-être aussi
- C PB08 Cin CaDocument10 pagesC PB08 Cin CaZedexterPas encore d'évaluation
- td10 Cinetique Chimique Corr PDFDocument1 pagetd10 Cinetique Chimique Corr PDFعادل الحمدي100% (1)
- 4 5949436273771940485Document2 pages4 5949436273771940485olivieralexandre954Pas encore d'évaluation
- Td6 Cinetique Chimique CorrDocument1 pageTd6 Cinetique Chimique CorrAdri LebPas encore d'évaluation
- Gsa 2bac 1819 S2 C1 PCF PCDocument4 pagesGsa 2bac 1819 S2 C1 PCF PCAmine AlaoUii AlaouiPas encore d'évaluation
- C Ex02 Cin CaDocument3 pagesC Ex02 Cin CaZedexterPas encore d'évaluation
- C Ex09 Cin CaDocument3 pagesC Ex09 Cin CaKhadija BiallachPas encore d'évaluation
- C Ex07 Cin CaDocument3 pagesC Ex07 Cin CaHasan RajawiPas encore d'évaluation
- Cinétique TDDocument5 pagesCinétique TDBadr MouslimPas encore d'évaluation
- Examens Cinétique ChimiqueDocument10 pagesExamens Cinétique Chimiquemohamed jibou100% (1)
- M28 Cinétique TD1Document2 pagesM28 Cinétique TD1Hassan DriouachPas encore d'évaluation
- Cours 4-ConvertiDocument4 pagesCours 4-ConvertiÑar Ďjes100% (1)
- Klubprepa 3997Document6 pagesKlubprepa 3997Simo BounaPas encore d'évaluation
- C PB06 Cin CaDocument6 pagesC PB06 Cin CaZedexterPas encore d'évaluation
- Corr PC SVT 22 NormalDocument5 pagesCorr PC SVT 22 Normalel haddadePas encore d'évaluation
- Serie10 Corrections PDFDocument2 pagesSerie10 Corrections PDFrahmani100% (1)
- Examen National Physique Chimie SPC 2016 Normale Corrige 1Document9 pagesExamen National Physique Chimie SPC 2016 Normale Corrige 1othmane GbPas encore d'évaluation
- SVT 22 NormalDocument5 pagesSVT 22 Normalpeedro.ca01Pas encore d'évaluation
- Ue4 Ed1 2015 2016Document4 pagesUe4 Ed1 2015 2016bilelsta97Pas encore d'évaluation
- TD-cinetique ChimiqueDocument2 pagesTD-cinetique ChimiqueHaytem bossPas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2013 2014Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2013 2014Abdelhakim BailalPas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2013 2014Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2013 2014Chimiste Chimiste100% (1)
- IE12006 CorrigeDocument3 pagesIE12006 CorrigeredaPas encore d'évaluation
- TD (1) Cinétique ChimieDocument3 pagesTD (1) Cinétique ChimieAnass ZaouiPas encore d'évaluation
- C Ex17 Cin CaDocument3 pagesC Ex17 Cin CaHasan RajawiPas encore d'évaluation
- Physique C PDFDocument4 pagesPhysique C PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 6 TDPCSIcinetique 2015Document8 pages6 TDPCSIcinetique 2015Nguissaly SonkoPas encore d'évaluation
- Manual de Solues Cap 4Document43 pagesManual de Solues Cap 4Larissa KelmerPas encore d'évaluation
- Révision N°3 (KH Bessem) (Maknassy)Document4 pagesRévision N°3 (KH Bessem) (Maknassy)Ghassen BenjannetPas encore d'évaluation
- Une Extension La Loi de L'arc Sinus: MultidimensionnelleDocument29 pagesUne Extension La Loi de L'arc Sinus: Multidimensionnellefarid OLPas encore d'évaluation
- ExerciceDocument19 pagesExercicechouaki nassimaPas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFأبوأحمد الجزيري0% (1)
- ds11s2015 Corrige PDFDocument3 pagesds11s2015 Corrige PDFHananeFakhriPas encore d'évaluation
- Cours 3 Cinétique Khenifi-ConvertiDocument6 pagesCours 3 Cinétique Khenifi-ConvertiÑar ĎjesPas encore d'évaluation
- TD Chapitre3 Corrige1Document34 pagesTD Chapitre3 Corrige1Niwir NikabouPas encore d'évaluation
- Sapo EtetDocument7 pagesSapo EtetNôùr Hòü DãPas encore d'évaluation
- Physique 2011 Principale Correction PDFDocument9 pagesPhysique 2011 Principale Correction PDFRoua ManiPas encore d'évaluation
- Correction Série n4C 5C Equilibre Chimique 2023Document10 pagesCorrection Série n4C 5C Equilibre Chimique 2023safouen mejbriPas encore d'évaluation
- Bac Blanc Novembre CorrigeDocument7 pagesBac Blanc Novembre CorrigeGiovanni FokouPas encore d'évaluation
- Exercice Corrigé Suivi Temporel D'une Transformation Chimique PDFDocument2 pagesExercice Corrigé Suivi Temporel D'une Transformation Chimique PDFMohammed Elhlou75% (8)
- Corrigé de Chimie 2022Document6 pagesCorrigé de Chimie 2022chakir mohammed0% (1)
- Correction Compo1 20152016Document5 pagesCorrection Compo1 20152016ousmane diengPas encore d'évaluation
- Corrige Bac PC Serie s1 2013 PDFDocument6 pagesCorrige Bac PC Serie s1 2013 PDFngariPas encore d'évaluation
- TD 4 Regime TransitoireDocument34 pagesTD 4 Regime Transitoirezied houanebPas encore d'évaluation
- M28 - Cinétique - TD1 - CorrectionDocument7 pagesM28 - Cinétique - TD1 - CorrectionHassan DriouachPas encore d'évaluation
- TP4 La Reaction Persulfate IodureDocument4 pagesTP4 La Reaction Persulfate IodureSellam Anis100% (1)
- Chapitre 6 CINETIQUE CHIMIE PART 2Document9 pagesChapitre 6 CINETIQUE CHIMIE PART 2Faklish LoufiPas encore d'évaluation
- Corrige GEIPI Physique-Chimie 2003Document13 pagesCorrige GEIPI Physique-Chimie 2003ogmios_94Pas encore d'évaluation
- Centrale-Sup SARAHDocument22 pagesCentrale-Sup SARAHSARAH ASSIMPas encore d'évaluation
- Physique Bac MathDocument4 pagesPhysique Bac MathSofia BahriniPas encore d'évaluation
- Spe Physique Chimie 2021 Zero 1 CorrigeDocument8 pagesSpe Physique Chimie 2021 Zero 1 CorrigeChahid OUAAZIZIPas encore d'évaluation
- Devoir Corrigé de Baccalauréat - Sciences Physiques - Principale 2017 - Bac Sciences Exp (2016-2017) MR Guitouni AnisDocument5 pagesDevoir Corrigé de Baccalauréat - Sciences Physiques - Principale 2017 - Bac Sciences Exp (2016-2017) MR Guitouni Anisolfa essefiPas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2016 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةDocument13 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2016 علوم فيزيائية ترجمة فرنسية الدورة الاستدراكيةjouaitiPas encore d'évaluation
- Corrige td1 ElectrochimieDocument7 pagesCorrige td1 Electrochimieayoub dahbi100% (1)
- TP 2Document5 pagesTP 2Zz BbPas encore d'évaluation
- CinetiqueDocument5 pagesCinetiqueAbdelmoudjibĐŗeămÇhăcerPas encore d'évaluation
- TDCH5 CinetiqueDocument3 pagesTDCH5 CinetiqueahmadPas encore d'évaluation
- Annales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésD'EverandAnnales de Mathématiques, Baccalauréat C et E, Cameroun, 2008 - 2018: Sujets et CorrigésÉvaluation : 4.5 sur 5 étoiles4.5/5 (4)
- Espace VectDocument11 pagesEspace VectZedexterPas encore d'évaluation
- Identification TPDocument9 pagesIdentification TPZedexterPas encore d'évaluation
- Contacte PonctuelleDocument2 pagesContacte PonctuelleZedexterPas encore d'évaluation
- C PB04 Cin CaDocument7 pagesC PB04 Cin CaZedexterPas encore d'évaluation
- C PB09 Cin CaDocument11 pagesC PB09 Cin CaZedexterPas encore d'évaluation
- C PB06 Cin CaDocument6 pagesC PB06 Cin CaZedexterPas encore d'évaluation
- C Ex02 Cin CaDocument3 pagesC Ex02 Cin CaZedexterPas encore d'évaluation
- C Ex03 Cin CaDocument3 pagesC Ex03 Cin CaZedexterPas encore d'évaluation
- Les 12 Règles de SécuritéDocument13 pagesLes 12 Règles de Sécuritésamar soussiPas encore d'évaluation
- DM Signaux ElectriquesDocument3 pagesDM Signaux ElectriquesJejbreakerPas encore d'évaluation
- Chaleur D'hydratationDocument6 pagesChaleur D'hydratationAla AbidiPas encore d'évaluation
- Visual PDF Schema Conception For PHP My AdminDocument5 pagesVisual PDF Schema Conception For PHP My AdminHanan Ed-daoudyPas encore d'évaluation
- Aqvalis Caleo BojlerDocument39 pagesAqvalis Caleo Bojleraleks canjugaPas encore d'évaluation
- Reseaux de Neurones: PerceptronDocument20 pagesReseaux de Neurones: PerceptronAnovar_ebooks100% (1)
- Traitementdimage 18 19 Rattr+Sol Tf.Document2 pagesTraitementdimage 18 19 Rattr+Sol Tf.Sawat SiwarPas encore d'évaluation
- DINEPA 4.1.1 DIT1 Realization of Masonry Civil Engineering WorksDocument32 pagesDINEPA 4.1.1 DIT1 Realization of Masonry Civil Engineering WorksToBertPas encore d'évaluation
- Catalogue Oerlikon ConsommablesDocument90 pagesCatalogue Oerlikon ConsommablesNAIFARBILELPas encore d'évaluation
- Receta RhassoulDocument15 pagesReceta RhassoulmyriamafPas encore d'évaluation
- DSP ExerciceDocument15 pagesDSP ExerciceMerit Khaled100% (1)
- Cuitelinho Partitura CoralDocument2 pagesCuitelinho Partitura CoralGiovana GoulartPas encore d'évaluation
- Wa0014 PDFDocument3 pagesWa0014 PDFIbrahim OuchanPas encore d'évaluation
- Examen Final 1 Méca RaDocument2 pagesExamen Final 1 Méca RaHellal AzzedinePas encore d'évaluation
- Rapport de Stage MFVDocument47 pagesRapport de Stage MFVKarim SaberPas encore d'évaluation
- Chapitre II Les Régimes de NeutreDocument11 pagesChapitre II Les Régimes de Neutredjebien100% (1)
- En7 8Document3 pagesEn7 8qazplm 1029Pas encore d'évaluation
- Chapitre 1 2 Algebre de Boole Et Fonctions LogiquesDocument20 pagesChapitre 1 2 Algebre de Boole Et Fonctions LogiquesIddir YuderPas encore d'évaluation
- Cours Management Qual It É A 4Document78 pagesCours Management Qual It É A 4Gaëlle No'osi TchendjePas encore d'évaluation
- Compressor APS 01Document30 pagesCompressor APS 01Med DhaouiPas encore d'évaluation
- L3 Electronique - Des - Impulsions TD2 SolutionDocument7 pagesL3 Electronique - Des - Impulsions TD2 SolutionCHEBLI ABDELGHAFOURPas encore d'évaluation
- Deutsch 951 Series 2008Document32 pagesDeutsch 951 Series 2008lijojose1Pas encore d'évaluation
- DJI - Quelles Différences Entre Les Drones Et Lequel Choisir - Les NumériquesDocument2 pagesDJI - Quelles Différences Entre Les Drones Et Lequel Choisir - Les Numériquesbonding6925Pas encore d'évaluation
- Serie N2 PDFDocument3 pagesSerie N2 PDFomar el ghamriPas encore d'évaluation
- Rapport Mission Terga 1Document4 pagesRapport Mission Terga 1chahi0% (1)
- Rapport Sur Les Granulats1Document62 pagesRapport Sur Les Granulats1Abdarahmane BaPas encore d'évaluation
- Comment Ouvrir Les Documents PDFDocument2 pagesComment Ouvrir Les Documents PDFCurtisPas encore d'évaluation
- Cours Instr Capteurs 2018Document19 pagesCours Instr Capteurs 2018anon_509931202Pas encore d'évaluation
- Hilti HSTDocument6 pagesHilti HSTkopnangPas encore d'évaluation
- Commande Par Mode Glissant Des CourantsDocument77 pagesCommande Par Mode Glissant Des CourantsAdelHamzioPas encore d'évaluation