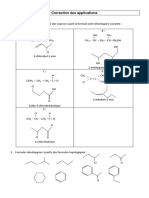
Académique Documents
Professionnel Documents
Culture Documents
Corrigé PC TleD
Transféré par
Samuel OLOJEDETitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Corrigé PC TleD
Transféré par
Samuel OLOJEDEDroits d'auteur :
Formats disponibles
Corrigé type de l’épreuve de sciences physiques
Classe de Terminale D
m 2m𝐻2𝑂 2m ×M
❖ = ⟹ 𝑦 = 𝐻2𝑂 =7
M 𝑦M𝐻2𝑂 m×M𝐻2𝑂
Exercice 1 m 2m𝑁2 2m𝑁2 ×M
❖ M
= 𝑧M𝑁2
⟹ 𝑧 = m×M = 1
𝑦 𝑁2
1.a) 12𝑥 = 0,167 ⇒ y = 12 × 0,167x = 2x ; D’où la FB : C2H7N
MA = 12x + y + 16 = 14x + 16 4. FSD et noms possibles du composé
𝑀𝐴 16 14,004x+16 16 CH3 NH CH3
=18,6 ; =18,6 ; x = 5 et A : C5H10O. CH3 CH2 NH2
100 100
Autre méthode : posons A = C5H10O. Vérification les éthanamine N-méthylmethanamine
données : ou diméthylamine
𝑚𝐻 𝑦 10
= 12𝑥 = 60 = 0,167 5. Équation bilan
𝑚𝐶 O O O
16 1600
%𝑂 = 12×5+10+16 × 100 = 86
= 18,6 CH3 C O C CH3 + CH3 CH2 NH2 CH3 C NH CH2 CH3 + CH3 COOH
b) Les FSD possibles : Noms des produits
CH3 O
CH3 CH CH2 CHO CH3 CH2 CH CHO CH3 C CHO CH3 C NH CH2 CH3 CH3 COOH
CH3 CH3 CH3 N-éthyléthanamide acide éthanoïque
CH3 CH CO CH3 ou N-éthylacétamide ou acide acétique
CH3
Exercice 3
2.a) CH3 Partie 1
A CH3 C CHO 2,2-diméthylpropanal 1. Expression et valeur numérique de f :
1
CH3
2
m(VD2 − VA2 ) = WP + WRN + Wf
CH3 1
m(02 -02) = mgrsin + mgr(1 - cos) – f(2r +r) = 0
B : CH3 C COOH acide 2,2-diméthylpropanoïque 2
f = mg(1 + sin - cos)/(2 +) = 2,24 N
CH3
b) Cr2 O2− + −
7 + 14H3 O + 6𝑒 ⟶ 2 Cr
3+
+ 21H2 O 2. Accélération a1 :
C5 H10 O + 4H2 O ⟶ C5 H10 O2 + 2H3 O+ + 2𝑒 −
Bilan :
𝟑𝐂𝟓 𝐇𝟏𝟎 𝐎 + 𝐂𝐫𝟐 𝐎𝟐− +
𝟕 + 𝟖𝐇𝟑 𝐎 ⟶ 𝟑𝐂𝟓 𝐇𝟏𝟎 𝐎𝟐 + 𝟐 𝐂𝐫
𝟑+ + 𝟏𝟐𝐇 𝐎
𝟐
3.a)
CH3 CH3
CH3 C COOH + CH3 CH2 OH CH3 C CHO CH2 CH3
CH3
+H O
2
CH3
b) Nom du compose organique formé : f + RN + P = ma1 u : − f + mg sin = ma1
CH3
f
CH3 C COO CH2 CH3 a1 = g sin − = 4,18m.s − 2
m
CH3 2,2-diméthylpropanoate d'éthyle
- Accélération a3 :
c) Lente, limitée et athermique
4.a) L’acide sulfurique joue le rôle de catalyseur. Il permet
d’accélérer la réaction.
𝑚 4
b) n(éthanol) = 𝑀 = 46 = 8,7.10-2 mol : nB > n(éthanol) :
f + RN + P = ma3 i : − f = ma3
B est en excès.
c) on chauffe le mélange pour accélérer la réaction. f
𝑚 4
d) n(ester) = n(éthanol) = 𝑀 = 46 = 8,7.10-2 mol a3 = − = −4,48m.s − 2
m
𝑛 (𝑒𝑠𝑡𝑒𝑟)𝑟é𝑒𝑙 0,052 1
e) r = 𝑛(𝑒𝑠𝑡𝑒𝑟)𝑡ℎé𝑜𝑟𝑖𝑞𝑢𝑒 = 0,087
= 0,5977 soit r = 59,8 %. 3.a/ x = a3t2 + Vct
2
Exercice 2 b/ V = a3t + Vc or en D ; VD = 0 a3t + Vc = 0
− Vc
1. Équation bilan de la combustion t = = 2,23 s et
𝑦 𝑦 z a3
C𝑥 H𝑦 N𝑧 + (𝑥 + 4 ) O2 ⟶ 𝑥CO2 + 4 H2 O + 2 N2
1
2. Calcul de M r = 2 a3t2 + Vct = 11,16 m
m V m×V
M
=V ⟹ M = V 𝑚 = 44,8 g/mol
𝑚
3. Formule brute du compose Partie II
D’après le bilan molaire, on a : 1. Expression de VM = f(g, r, et )
1
m m
❖ M = 𝑥M𝐶𝑂2 ⟹ 𝑥 = m×M
m𝐶𝑂2 ×M
=2 2
m(VM2 − VA2) = Wp + WR
𝐶𝑂2 𝐶𝑂2
1 ⃗ + 𝑃⃗ + 𝑅⃗ = 𝑀𝑎
2
m(VM2 − 02) = mgrsinα + mgr[cos(α – β) – cosα] 𝑇 𝑠𝑢𝑖𝑣𝑎𝑛𝑡 (𝑜𝑖) ∶ −𝐾𝑥 = 𝑀𝑎
𝑲
VM = 2 grsin + cos( − ) − cos 𝒙̈ + 𝒙=𝟎
𝑴
2. Expression des coordonnées de a2 - Expression de la période
2𝜋 𝟐𝝅 𝑴
𝑻𝑶 = = = 𝟐𝝅√
𝜔𝑜 𝑲
√𝑲
𝑴
3. Calcul de T0 : T0 est la durée d’une oscillation
10,6
𝑇𝑜 = = 1,06 𝑠
10
n : R − mg cos( − ) = man 4. Expression de la nouvelle période
P + R = ma2
u : 0 + mg sin( − ) = mat 𝑻 = 𝟐𝝅√
𝑴 + 𝒎𝟏
𝑲
V2
an = M 5. Expression de K en fonction To ; T et m1
Coordonnées de a2 r (𝑀 + 𝑚1) (𝑀)
a = g sin( − ) 𝑇 2 − 𝑇𝑜2 = 4𝜋 2 − 4𝜋 2 ⟹
t 𝐾 𝐾
𝟐
𝟒𝝅 𝒎
Calcul de VM: VM = 21,06 m/s 𝑲 = 𝟐 𝟐𝟏
𝑻 −𝑻𝒐
a2 = at2 + an2 = 25,14m / S 2
6. Calcul de K :
3. Détermination de R :
4𝜋 2 𝑥0,02
𝑉𝑀2 𝑲= = 𝟑𝟕, 𝟎𝟕 𝑵. 𝒎−𝟏
R = m[a𝑛 + gcos( − )] = m[ + gcos( − ) 1,072 − 1,062
𝑟
R = 16,65 N
4. En C, on a =
D’après TEC entre C et D
1
2
m(VD2 − VC2 ) = WP + WR = 0 ⟹
Vc = VD = 2 gr (1 + sin − cos ) = 45,95m / s
5 .a/ Équation de la trajectoire
⃗P = ma⃗ ⇔ mg ⃗ = ma⃗ ⟹ a⃗ = ⃗g
VDx = VD a x = 0
VD a
VDy = 0 a y = g
V x = VD x = VD t g 2
V DM y= x
V y = gt y = 2 gt 2VD2
1 2
g 2 2H
b/ H = 2
d d = VD = 45,95m
2VD g
Exercice 4
1. Inventaire des forces
𝑃⃗ ∶ 𝑝𝑜𝑖𝑑𝑠 𝑑𝑢 𝑠𝑜𝑙𝑖𝑑𝑒
⃗ ∶ 𝑡𝑒𝑛𝑠𝑖𝑜𝑛 𝑑𝑢 𝑟𝑒𝑠𝑠𝑜𝑟𝑡
𝑇
𝑅⃗ ∶ 𝑟é𝑎𝑐𝑡𝑖𝑜𝑛 𝑑𝑢 𝑠𝑢𝑝𝑝𝑜𝑟𝑡 𝑠𝑢𝑟 𝑙𝑒 𝑠𝑜𝑙𝑖𝑑𝑒
Représentation des forces à un instant t
2. Équation différentielle du mouvement
Vous aimerez peut-être aussi
- Solution Des Exercices - Les Acides Carboxyliques - Ts - SunudaaraDocument7 pagesSolution Des Exercices - Les Acides Carboxyliques - Ts - SunudaaraJule BaPas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- Corrigé PC 1DDocument2 pagesCorrigé PC 1DAdeline Kwadzo100% (2)
- 01 Chimie OrganiqueDocument9 pages01 Chimie OrganiqueHocine MichelPas encore d'évaluation
- Epreuve Du 1: Corrige de L'Epreuve de Sciences PhysiquesDocument8 pagesEpreuve Du 1: Corrige de L'Epreuve de Sciences PhysiqueslionelPas encore d'évaluation
- 1cm41mch1 245884Document5 pages1cm41mch1 245884Absa NdiayePas encore d'évaluation
- TD Chimie OrganiqueDocument9 pagesTD Chimie Organiqueass mohPas encore d'évaluation
- Rabat Ratt 2017 PDFDocument4 pagesRabat Ratt 2017 PDFAya El kotbiPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2020 Rattrapage CorrigeDocument9 pagesExamen National Physique Chimie 2 Bac SVT 2020 Rattrapage CorrigeMohamed SaidiPas encore d'évaluation
- Corrigé de L'épreuve de Sciences Physiques: Universite C A D DDocument5 pagesCorrigé de L'épreuve de Sciences Physiques: Universite C A D DLindeltaylor DioufPas encore d'évaluation
- Corrigés Leçon 4 - Le BenzèneDocument4 pagesCorrigés Leçon 4 - Le Benzèneholyeric50Pas encore d'évaluation
- Solutions Des Exercices Série Sur Les Amines - Ts - SunudaaraDocument8 pagesSolutions Des Exercices Série Sur Les Amines - Ts - SunudaaraSamry dyijPas encore d'évaluation
- Solutions Des Exercices Série Sur Les Amines - Ts - SunudaaraDocument8 pagesSolutions Des Exercices Série Sur Les Amines - Ts - SunudaaraSamry dyijPas encore d'évaluation
- Baccor17sp2-Fr (WWW - Pc1.ma) - 2Document6 pagesBaccor17sp2-Fr (WWW - Pc1.ma) - 2medPas encore d'évaluation
- Serie4 3 20Document1 pageSerie4 3 20Math PilotePas encore d'évaluation
- 1cm432qpm 757086Document4 pages1cm432qpm 757086Nana DiakitéPas encore d'évaluation
- QCM - Medecine ChimieMr SABOUR 2023Document9 pagesQCM - Medecine ChimieMr SABOUR 2023SABOUR MOHAMMEDPas encore d'évaluation
- 2009 Afrique Exo1 Correction Pomme 6 5ptsDocument2 pages2009 Afrique Exo1 Correction Pomme 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Corrigés Leçon 6 - Composés Oreganiques OxygénésDocument5 pagesCorrigés Leçon 6 - Composés Oreganiques Oxygénésholyeric50Pas encore d'évaluation
- Corrigé PC TDDocument3 pagesCorrigé PC TDmarioagbozoPas encore d'évaluation
- Exercice SMP3 2020-2021Document6 pagesExercice SMP3 2020-2021sbaaiPas encore d'évaluation
- 4-Corrige Bac Blanc SP s2Document6 pages4-Corrige Bac Blanc SP s2el hadji thierno dioumPas encore d'évaluation
- Devoir Maison RP: Exercice 1Document6 pagesDevoir Maison RP: Exercice 1Ayoub DjouabiPas encore d'évaluation
- DS 7 558 2019-2020 34-27Document5 pagesDS 7 558 2019-2020 34-27Armel Marc KouchoewanouPas encore d'évaluation
- Devoir Physico ChimiqueDocument4 pagesDevoir Physico Chimiqueداودي عبد الرحمانPas encore d'évaluation
- Corrigé Serie D 2021Document7 pagesCorrigé Serie D 2021ChristellePas encore d'évaluation
- Corrigé Sujet S2 1er Groupe PC Session Normale 2019 1Document7 pagesCorrigé Sujet S2 1er Groupe PC Session Normale 2019 1Mamadou NdiayePas encore d'évaluation
- Correction de La Fiche 1Document5 pagesCorrection de La Fiche 1LARIBIPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2020 Normale CorrigeDocument8 pagesExamen National Physique Chimie 2 Bac SVT 2020 Normale CorrigeMohamed Saidi100% (1)
- DS2 Correction LMA 09 11 2019 Avancement - OxydoreductionDocument4 pagesDS2 Correction LMA 09 11 2019 Avancement - Oxydoreductiondiomande Aminata Sarah FatimPas encore d'évaluation
- AnatomieDocument2 pagesAnatomiesant juste Pierre GersonPas encore d'évaluation
- PC C 1999 CorDocument8 pagesPC C 1999 Corrktm.avotraPas encore d'évaluation
- SVT 22 NormalDocument5 pagesSVT 22 Normalpeedro.ca01Pas encore d'évaluation
- CB-MP Chimie CorrectionDocument4 pagesCB-MP Chimie CorrectionHamza MesrarPas encore d'évaluation
- SPE Term - Devoir Commun 2 - Sujet 2 - CORRECTIONDocument4 pagesSPE Term - Devoir Commun 2 - Sujet 2 - CORRECTIONMariam LahlouPas encore d'évaluation
- Correction Examen NationaleDocument10 pagesCorrection Examen NationaleYanrique RPas encore d'évaluation
- Cords2tcp 18 19Document4 pagesCords2tcp 18 19Salim SalimPas encore d'évaluation
- DS N3 CorrectionDocument4 pagesDS N3 Correctionالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Corrige CF 2015-2016 PDFDocument6 pagesCorrige CF 2015-2016 PDFAsmahane FaslaPas encore d'évaluation
- Corre Xo Com PoxyDocument3 pagesCorre Xo Com Poxygnamienray98Pas encore d'évaluation
- Corr PC SVT 22 NormalDocument5 pagesCorr PC SVT 22 Normalel haddadePas encore d'évaluation
- Hydrocarbures Exercices Corr 01Document7 pagesHydrocarbures Exercices Corr 01zeineb fadhel100% (1)
- Solution TDchromato 2021Document4 pagesSolution TDchromato 2021allali hanaaPas encore d'évaluation
- U C A D D: Exercice 1Document5 pagesU C A D D: Exercice 1Lindeltaylor DioufPas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFSaifeddine MakniPas encore d'évaluation
- TD 1Document4 pagesTD 1Abdou HajjajiPas encore d'évaluation
- PC Exos 2concours PDFDocument12 pagesPC Exos 2concours PDFLahami NdiayePas encore d'évaluation
- 1ère Chimie Tomasino CorrectionDocument30 pages1ère Chimie Tomasino Correctiondidier adjaoute83% (40)
- Mines CH MP - Psi 2018Document6 pagesMines CH MP - Psi 2018Zaineb AbbadPas encore d'évaluation
- STi2D - DS - CORRECTION - 1Document1 pageSTi2D - DS - CORRECTION - 1QuibelleandmeplvPas encore d'évaluation
- Corrige DS2 2014 SiteDocument5 pagesCorrige DS2 2014 SiteRiadh MarouaniPas encore d'évaluation
- Corrige DS2 2014 SiteDocument5 pagesCorrige DS2 2014 SiteRiadh MarouaniPas encore d'évaluation
- CHM317 - 202020 - Examen Final - SPCDocument7 pagesCHM317 - 202020 - Examen Final - SPCChris YPas encore d'évaluation
- Correction TD Spectro de MasseDocument6 pagesCorrection TD Spectro de MasseMariam Ben AbdelouahabPas encore d'évaluation
- ExaaaaaaaaaDocument3 pagesExaaaaaaaaamyriam zemniPas encore d'évaluation
- Serie 3 PDFDocument2 pagesSerie 3 PDFElbahi Djaalab0% (2)
- Correction Benzene 3-4-5Document6 pagesCorrection Benzene 3-4-5serignesidisowPas encore d'évaluation
- 2009 Bac PC Ter s2 CorrigeDocument6 pages2009 Bac PC Ter s2 CorrigeLindoucha DadouchaPas encore d'évaluation
- PC D2010 CorDocument7 pagesPC D2010 CorhajhaniegangPas encore d'évaluation
- Composes Organiques OxygenesDocument5 pagesComposes Organiques OxygenesSoule OuederPas encore d'évaluation
- Exercices (Chimie Organique) DR ZAABAT.N PDFDocument5 pagesExercices (Chimie Organique) DR ZAABAT.N PDFlibrairie- papeterie des allees seddikPas encore d'évaluation
- Composition Du PétroleDocument15 pagesComposition Du PétroleZEMMOURIPas encore d'évaluation
- TD Nomenclature Corrige 3 PDFDocument3 pagesTD Nomenclature Corrige 3 PDFKarimBenAPas encore d'évaluation
- Serie Les Acide CarboxyliqueDocument3 pagesSerie Les Acide CarboxyliquesamiPas encore d'évaluation
- Cycle de KrebsDocument1 pageCycle de KrebsHadrien De GreefPas encore d'évaluation
- BC 0 OrganiqueDocument7 pagesBC 0 OrganiqueosefresistancePas encore d'évaluation
- 12-Proprietes Physicochimiques Des Acides AminesDocument100 pages12-Proprietes Physicochimiques Des Acides AminesBook Hunter100% (3)
- J Chapitre 11 - Les Acides Carboxyliques Et Les Fonctions Dérivées - SGDocument14 pagesJ Chapitre 11 - Les Acides Carboxyliques Et Les Fonctions Dérivées - SGMagida Tohme HelouPas encore d'évaluation
- Composes FonctionnelsDocument17 pagesComposes FonctionnelsPhytomenadione La Vitamine KPas encore d'évaluation
- Quinoléine Et Isoquinoléine PDFDocument46 pagesQuinoléine Et Isoquinoléine PDFSahouin Claude Medard100% (1)
- Resume de Chimie OrganiqueDocument20 pagesResume de Chimie OrganiqueissoufPas encore d'évaluation
- Exercices Transformations Acide BaseDocument4 pagesExercices Transformations Acide BaseNaouma ChahdPas encore d'évaluation
- 1ère CD - APC - Quelques Composés OxygénésDocument5 pages1ère CD - APC - Quelques Composés OxygénésLAWSON NICOLASPas encore d'évaluation
- Cours - Ait Ahmed Nadia - Cours Et Exercices de Chimie Organique 1Document97 pagesCours - Ait Ahmed Nadia - Cours Et Exercices de Chimie Organique 1Emilienne Monkon100% (1)
- Chapitre 4 Les Réactions Doxydo ReductionDocument57 pagesChapitre 4 Les Réactions Doxydo ReductionabdelouahedPas encore d'évaluation
- Nomenclature Exercices PDFDocument3 pagesNomenclature Exercices PDFmagnumPas encore d'évaluation
- Corrigé PC TDDocument3 pagesCorrigé PC TDmarioagbozoPas encore d'évaluation
- Nomenclature IUPACDocument6 pagesNomenclature IUPACMohamed LaliouiPas encore d'évaluation
- Synthese Chimie OrganiqueDocument13 pagesSynthese Chimie Organiqueelpis100% (2)
- Amines - Acides CarboxyliquesDocument2 pagesAmines - Acides Carboxyliquesdiengsalla diengPas encore d'évaluation
- Chapitre I.2 - Alcènes-Alcynes - B. MESSAOUDI - 14-02-2022Document50 pagesChapitre I.2 - Alcènes-Alcynes - B. MESSAOUDI - 14-02-2022Abderrahmane AEPas encore d'évaluation
- TDSAVON2010Document4 pagesTDSAVON2010arsenepana8Pas encore d'évaluation
- Alcane Chimie OrganiqueDocument16 pagesAlcane Chimie OrganiqueFaculté De Médecine BécharPas encore d'évaluation
- Presentation Des AlcoolsDocument7 pagesPresentation Des Alcoolssamir halfaouiPas encore d'évaluation
- 3-Catabolisme Des A.G (Beta-Oxydation)Document34 pages3-Catabolisme Des A.G (Beta-Oxydation)130660LYC OMAR BENABDELAZIZ NEDROMA100% (1)
- ACIDE CARBOXYLIQUE ET DERIVES AU BAC TSE-STI-TSExpDocument4 pagesACIDE CARBOXYLIQUE ET DERIVES AU BAC TSE-STI-TSExpToumany FofanaPas encore d'évaluation
- HOC S6 Chapitre 1Document4 pagesHOC S6 Chapitre 1Essemlali Abde SamadPas encore d'évaluation
- Fns Orga FamillesDocument2 pagesFns Orga FamillesDaniela DinicaPas encore d'évaluation
- MAX SAT: Test ConseilléDocument2 pagesMAX SAT: Test ConseilléMAPas encore d'évaluation