Académique Documents
Professionnel Documents
Culture Documents
Exam-Corrige Chimie PDF
Transféré par
NassimaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exam-Corrige Chimie PDF
Transféré par
NassimaDroits d'auteur :
Formats disponibles
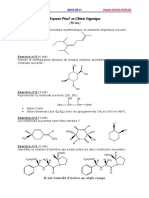
Université M.
Bouguerra - TCT 2002 - EMD-2 Juin 2004
Faculté des sciences Module de Chimie Durée : 1H 30
Sujet
Partie A : CHIMIE ORGANIQUE ( 07 points)
Exercice n°1 ( 03 points )
1 2 3 4 5
Soit la molécule CH3 – CH (OH) – CH ( CH2CH3) – CH2 – CH3
a) Représenter cette molécule en conformation décalée par rapport aux carbones 2 et 3 , dans le sens 2—3
d’après la convention de Newmann.
b) Représenter cette molécule en configuration R (Rectus) en projection de Fisher, par rapport au seul
carbone asymétrique existant dans cette molécule. Expliquer votre réponse.
c) Expliquer comment passer ,en deux ou plusieurs étapes ,de ce composé chimique au 3-éthyl 1,2-
pentane diol.
Exercice n°2 ( 02 points )
Indiquer comment préparer le 2-pentanone (c’est à dire donner les réactions chimiques adéquates) à partir
d’éléments simples comme le carbone, l’azote, le magnésium, l’acide chlorhydrique, l’oxyde de calcium
ou autres ( Equilibrer vos réactions chimiques).
Exercice n°3 ( 02 points )
Un alcène est oxydé par une solution de permanganate de potassium concentrée et à chaud. Cette
oxydation n’a donné qu’un seul produit : le 2-butanone. D’autre part, un (01) g de cet alcène peut fixer
1,43 g de brome.
Donner la structure et le nom de cet alcène.
Masses atomiques usuelles (en grammes) :C = 12 ; H = 1 ; Br = 80 ; Fe = 56 ; O = 16 ; Na = 23 ; S = 32
Partie B : CHIMIE ANALYTIQUE ( 13 points )
Exercice n°1 ( 03 points )
Soit une solution d’acide acétique CH3COOH, la concentration de l’espèce CH3COO- dans cette solution
est de [CH3COO-] = 10-3 M.
a- (01 pt) Calculer le pH de cette solution.
b- (01 pt) Déduire la concentration initiale en CH 3COOH.
c- (01 pt) Calculer le coefficient de dissociation α.
Donnée : pka = 4.8
Exercice 02 ( 04 points )
Soit une solution d’acide sulfurique H2SO4 à 10-2 M. Sachant que l'acide sulfurique n'est fort que pour sa
première acidité et qu'il est faible pour la seconde, le Ka 2 est égal à 1.2 10-2
a- (01 pt) Calculer la concentration en H3O+ qui provient de la première dissociation.
b- (03 pt) Calculer le pH de la solution.
Exercice 03 ( 06 points )
On mélange 150 ml d’une solution de Mg(NO 3)2 10-2 M à 250 ml d’une solution de NaF 10-1 M.
a- (02 pt) Est-ce qu’au moment du mélange le MgF2 précipite ?
b- (03 pt) S’il y a précipitation du MgF2 calculer les concentrations de Mg ++ et de F- en équilibre
avec MgF 2 solide. (Tenir compte des approximations éventuelles)
c- (01 pt) Déduire la quantité du précipité de MgF2 qui se forme.
Donnée : Ks = 6.4 10-9 (Produit de solubilité du sel MgF2)
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Université M.Bouguerra - TCT 2002 - EMD-2 Juin 2004
Faculté des sciences Module de Chimie Durée : 1H 30
================================================================================
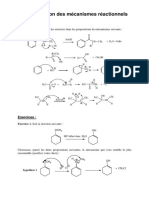
Corrigé
Partie A : Chimie organique
Exercice n°1 : (03 pts)
a) (1 pt) La représentation de cette molécule est la suivante ( plusieurs solutions sont possibles) :
b) (1 pt) La représentation de cette molécule est la suivante ( plusieurs solutions sont possibles) :
c) (1 pt). La démarche pour passer de ce composé au 3-éthyl 1,2-pentane diol est la suivante :
CH3-CHOH–CHC2H5–CH2–CH3 CH 2 = CH – CHC2H5 – CH2 – CH3 + H2O
CH2 = CH – CHC2H5 – CH2 – CH3 + [ O] ( puis + H2O)
( KmnO4 dilué, à froid)
CHOH - CH OH– CHC2H5 – CH2 – CH3
3-éthyl 1,2-pentane diol
Exercice n°2 : (2pts)
La méthode à suivre pour préparer le 2-pentanone à partir d’éléments simples est la suivante :
3C + CaO CaC 2 + CO
CaC2 + 2 H2O HC ≡ CH + Ca(OH) 2
HC ≡ CH + Na HC ≡ CNa + ½ H 2
HC ≡ CNa + CH 3CH2CH2Br HC ≡ C CH2CH2CH3 + NaBr
HC ≡ C CH2CH2CH3 + H2O H 2C = C OH CH2CH2CH3 (énol instable)
H2C = C OH CH2CH2CH3 H 3C - C O CH2CH2CH3
2 -pentanone
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Université M.Bouguerra - TCT 2002 - EMD-2 Juin 2004
Faculté des sciences Module de Chimie Durée : 1H 30
Exercice n°3 : (2 pts)
La réaction générale est la suivante :
R R ’’ R R ’’
C =C + [O] C=O + O=C
’ ’’’ ’’
R R R R ’’’
( KmnO4 concentré, à chaud)
Ce qui nous donne comme alcène pour cette exercice :
CH 3 CH2 CH2 CH3
C = C 3,4-diméthyl 3-héxène
CH 3 CH 3 ( formule brute : C8H16 )
On remarque bien que 1g de cette alcène fixe 1,43 g de brome :
C 8H16 + Br 2 C8H16 Br2
112 g 160 g
Partie B : CHIMIE ANALYTIQUE
Exercice 01
a- CH3COOH + H2O CH3COO- + H3O+
t=0 C 0 0
teq C- Cα Cα Cα
[CH3COO-] = 10-3 M = Cα = [H3O+] pH = -Log Cα =3
b- C = ?
1
On a pH= ( pKa − LogC ) ⇒ C = 10 pKa-2pH = 104,8 – 6 = 0.063M
2
c- α = ?
on a Cα = 10-3 M ⇒ α = 0.016 ⇒ α = 1.6 %
C = 0.063 M
Exercice 02
a- H2SO4 +H2O HSO4- + H3O+
0 C C
HSO4- + H2O SO4- + H3O+ Ka2 = 1.2 10-2
C- x x x
La première acidité étant forte ⇒ dissociation totale ⇒ [H3O+] = C = 10-2 M
b- le pH de la solution ? ? ?
pH = -Log [H3O+]T avec [H 3O+]T = C+ x
C provient de la première acidité et x provient de la deuxième acidité
On sait que C= 10-2 M mais x= ? ? donc calculons x, pour cela on à :
[ SO42 − ][ H 3O + ]T x(10 −2 + x)
Ka 2 = −
= −2
⇒ x 2 + ( Ka 2 + 10 −2 ) x − Ka 2 *10 −2 = 0 ⇒ x= 4.5 10-3 M
[ HSO4 ] 10 − x
donc [H3O ] = 10 + 4.5 10-3 ⇒
+ -2
pH = -Log (10-2 + 4.5 10-3) = 1.84
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Université M.Bouguerra - TCT 2002 - EMD-2 Juin 2004
Faculté des sciences Module de Chimie Durée : 1H 30
Exercice 03
a- MgF2 precipite ? ?
Mg 2+ + F- MgF2
on peut distinguer 02 cas :
Si [Mg2+]*[F-]2 < Ks ⇒ le précipité n’apparaît pas.
Si [Mg+]*[F-]2 > Ks ⇒ le précipité se forme jusqu’à ce que l’équilibre soit atteint.
On à le mélange de deux solutions ⇒ effet de dilution.
[Mg2+]o*400 = 10-2 *150 ⇒ [Mg2+]o = 3.75 10-3 M
[F-]o * 400 = 10-1 *250 ⇒ [F-]o = 6.25 10-2 M
[Mg2+]o*[F-]2o = 3.75 10-3 * (6.25 10-2)2 = 1.46 10-5 > Ks = 10-7.8 = 1.6 10-8 ⇒ l’équilibre
de précipitation se réalise ⇒ il y a précipitation jusqu’à l’équilibre
b- à l’équilibre [Mg2+]= ? ? et [F-]= ? ?
le nombre de moles de Mg2+ et F- restant en solution est respectivement n (Mg2+) et n ( F-)
no (Mg2+) = [Mg2+]o* 0.4 =3.75*10-3 * 0.4 =1.5 10-3 mol
no ( F-) = [F-]o * 0.4 = 6.25 *10-2* 0.4 = 2.5 10-2 mol
Mg 2+ +
2F- MgF 2
-3 -2
t=0 1.5 10 mol 2.5 10 mol 0
teq 0 6.25 10 -2 –2 (1.5 10-3) =2.2 10-3 1.5 10-3
On constate que , une fois la réaction de précipitation terminée, il reste un excès d’ions F-
même lorsqu’on suppose que la totalité de Mg2+ a précipité, on sait que , à l’équilibre, [Mg2+] n’est pas
nulle. On peut alors calculer [Mg2+] à l’équilibre en supposant que MgF2 soit de nouveau dissout jusqu’à
ce que les concentrations satisfassent à l’expression de Ks. Quelle quantité de MgF2 sera dissoute dans
une solution ou la concentration en F- est de :
[F-] =2.2 10-3 / 0.4 = 5.5 10-2 M
on procède de la façon habituelle
MgF2 Mg2+ +
2F-
-x +x 5.5 10-2-2x
x étant la concentration de précipité MgF 2 qui s’est dissout en mol/l
Ks = [Mg2+]*[F-]2
Ks = (x)( 5.5 10-2 +2x)2 ≈ (x)( 5.5 10-2 )2 , car la quantité x est très faible
[Mg2+] = x =2.1 10-6 M
[F-] = 5.5 10-2 M
b- la quantité de précipité qui s’est formé à la précipitation en nombre de mol
n (MgF2) = ( [Mg2+]o - [Mg2+] ) * V
n (MgF2) = [Mg2+]o * V - [Mg2+] * V
n (MgF2) = 1.5 10-3 - 2.1 10-6 * 0.4 ≈ 1.5 10-3 mol
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Vous aimerez peut-être aussi
- Al CoolsDocument13 pagesAl Coolsbmm2Pas encore d'évaluation
- Orga - 23 SN1 ET SN2Document7 pagesOrga - 23 SN1 ET SN2زيد بخليفةPas encore d'évaluation
- 2011 Examen Mai Solve PDFDocument7 pages2011 Examen Mai Solve PDFkarimovPas encore d'évaluation
- 6 Reactions D Elimination 1Document9 pages6 Reactions D Elimination 1Blondet RomaricPas encore d'évaluation
- Substitution Nucleophile 1Document2 pagesSubstitution Nucleophile 1niniPas encore d'évaluation
- Série 3 SMC4Document5 pagesSérie 3 SMC4anwar jakriPas encore d'évaluation
- Serie 3 PDFDocument2 pagesSerie 3 PDFElbahi Djaalab0% (2)
- Exercices de Chimie OrganiqueDocument7 pagesExercices de Chimie OrganiqueAy ManPas encore d'évaluation
- Réactivité en Chimie Organique PDFDocument9 pagesRéactivité en Chimie Organique PDFAchwak BelfadelPas encore d'évaluation
- HEI Chimie-Organique 2002 CHIMIEDocument3 pagesHEI Chimie-Organique 2002 CHIMIESalma SellamiPas encore d'évaluation
- Substitutions EliminationsDocument65 pagesSubstitutions EliminationsYounes MAZOUARPas encore d'évaluation
- Td11chim2019 2020Document3 pagesTd11chim2019 2020Med Stu DentPas encore d'évaluation
- SMC4 Examen Juillet 2013Document4 pagesSMC4 Examen Juillet 2013Yc YacinePas encore d'évaluation
- Série-3-Corrigée Chimie4Document15 pagesSérie-3-Corrigée Chimie4poly educationPas encore d'évaluation
- Examen Corrigé Hydro Smc4 by - Chimist ChimistDocument5 pagesExamen Corrigé Hydro Smc4 by - Chimist ChimistYc YacinePas encore d'évaluation
- EXAMEN 1 CORRIGéDocument3 pagesEXAMEN 1 CORRIGéSOUFYANE MUSTAPA100% (1)
- Série 2 Isomérie 2020-2021Document3 pagesSérie 2 Isomérie 2020-2021Ayoub HmPas encore d'évaluation
- Examen Chimie Organique 2016-2017Document5 pagesExamen Chimie Organique 2016-2017RedOne DerrouazinPas encore d'évaluation
- Potentiel Chimique ExercicesDocument4 pagesPotentiel Chimique ExercicesYassine RakchoPas encore d'évaluation
- Chimie-Organique Exo1Document1 pageChimie-Organique Exo1Bouhamey TraorePas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- TD N°8-2 PDFDocument4 pagesTD N°8-2 PDFWalid GLPas encore d'évaluation
- Nomenclature Des Composés OrganiquesDocument16 pagesNomenclature Des Composés OrganiquesRuroniPas encore d'évaluation
- Chimie Des SolutionsDocument48 pagesChimie Des Solutionsabdelaziz malkiPas encore d'évaluation
- Cours de Chimie Organique Licence 1 Semestre 1Document32 pagesCours de Chimie Organique Licence 1 Semestre 1Balla SangarePas encore d'évaluation
- A 1 3 Mecanisme sn2Document5 pagesA 1 3 Mecanisme sn2Yc YacinePas encore d'évaluation
- 2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFDocument19 pages2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFAbdessamed GherbaouiPas encore d'évaluation
- TD RedoxDocument3 pagesTD RedoxBamonPas encore d'évaluation
- TD Nomenclature Corrige 3Document3 pagesTD Nomenclature Corrige 3Stachis MadiambaPas encore d'évaluation
- Série 1 Chimie Generale AU 2020Document1 pageSérie 1 Chimie Generale AU 2020rekik hibaPas encore d'évaluation
- 2° Contrôle SMPC S2 2012 2013Document2 pages2° Contrôle SMPC S2 2012 2013lahssane hmidat100% (1)
- Examen Correction L1 Chimie Organique 2006 2Document7 pagesExamen Correction L1 Chimie Organique 2006 2med madPas encore d'évaluation
- Chapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESDocument5 pagesChapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESanwar jakriPas encore d'évaluation
- Corrigé Des Contrôles de Thermodynamique Chimique S4 2012-2019Document120 pagesCorrigé Des Contrôles de Thermodynamique Chimique S4 2012-2019Mohamed Ait allaPas encore d'évaluation
- Examen de TP de Chimie GeneraleDocument2 pagesExamen de TP de Chimie GeneraleKHALIFA EL HARFIPas encore d'évaluation
- TD CHORG SVTU S2 2018-2019 AmechrouqDocument34 pagesTD CHORG SVTU S2 2018-2019 Amechrouqbelhagemohamad61Pas encore d'évaluation
- 2eme Cours de Chimie OrganiqueDocument44 pages2eme Cours de Chimie OrganiqueAnfel BouchairPas encore d'évaluation
- Mecanismes Reactionnels Cours LeconteDocument16 pagesMecanismes Reactionnels Cours LeconteNajimou Alade Tidjani100% (1)
- Série Dexercices 2 - Spectrométrie Infra RougeDocument3 pagesSérie Dexercices 2 - Spectrométrie Infra RougeSamar ZedamPas encore d'évaluation
- S6 HOC CH Chapitre 4Document21 pagesS6 HOC CH Chapitre 4Eddouks Fatimazahrae100% (2)
- Aldéhydes Et CétonesDocument34 pagesAldéhydes Et Cétonesatika benslimanePas encore d'évaluation
- Tests D'identificationDocument2 pagesTests D'identificationAgnaou MohamedPas encore d'évaluation
- Thermodynamique Chimique: Cours Du ModuleDocument115 pagesThermodynamique Chimique: Cours Du ModuleG95 PfePas encore d'évaluation
- Corrige TD1Document7 pagesCorrige TD1Mariam Ben AbdelouahabPas encore d'évaluation
- A 3 CompetitionDocument3 pagesA 3 CompetitionEmilie BoubinetPas encore d'évaluation
- Exercices 41 CorrigeDocument11 pagesExercices 41 Corrige130660LYC OMAR BENABDELAZIZ NEDROMAPas encore d'évaluation
- LPro Spectro Picquet PDFDocument173 pagesLPro Spectro Picquet PDFJunior MbatepPas encore d'évaluation
- Potentiel ChimiqueDocument1 pagePotentiel ChimiqueJob ElsonPas encore d'évaluation
- Exam I 2Document1 pageExam I 2Anonymous sdeGjzXETG100% (2)
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie Nimpagaritse100% (1)
- TD SMC S5 Cinétique Chimique 2020-2021 - TD4Document1 pageTD SMC S5 Cinétique Chimique 2020-2021 - TD4Simo BoumahrachiPas encore d'évaluation
- Chap2 Aldéhydes Et CétonesDocument34 pagesChap2 Aldéhydes Et CétonesEssemlali Abde SamadPas encore d'évaluation
- 5 1a Correction ConformationDocument4 pages5 1a Correction ConformationKenson DEROSANPas encore d'évaluation
- Ato ExercicesDocument11 pagesAto ExerciceshhedfiPas encore d'évaluation
- TD Atomistique2Document3 pagesTD Atomistique2pitter PitkethlyPas encore d'évaluation
- Chimie Organique Fonctionnelle TD Corr 01Document2 pagesChimie Organique Fonctionnelle TD Corr 01123456789Pas encore d'évaluation
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie NimpagaritsePas encore d'évaluation
- 2° Contrôle SMPC S2 2012 2013 PDFDocument2 pages2° Contrôle SMPC S2 2012 2013 PDFAbdelah El ArabiPas encore d'évaluation
- 1cm432qpm 757086Document4 pages1cm432qpm 757086Nana DiakitéPas encore d'évaluation
- Rabat Ratt 2017 PDFDocument4 pagesRabat Ratt 2017 PDFAya El kotbiPas encore d'évaluation
- TP Genieenz ImmobDocument4 pagesTP Genieenz ImmobNassimaPas encore d'évaluation
- 2016 CHM 1Document18 pages2016 CHM 1NassimaPas encore d'évaluation
- 4 Formule BruteDocument2 pages4 Formule BruteNassimaPas encore d'évaluation
- Bouillon NitrateDocument2 pagesBouillon NitrateNassimaPas encore d'évaluation
- TP Solénoïde (Correction)Document1 pageTP Solénoïde (Correction)NassimaPas encore d'évaluation
- TP Formulation Et Dosage de L AspirineDocument2 pagesTP Formulation Et Dosage de L AspirineNassima100% (2)
- TP AciditetotalevinDocument2 pagesTP AciditetotalevinNassimaPas encore d'évaluation
- Introduction ArticleDocument2 pagesIntroduction ArticleNassimaPas encore d'évaluation
- TPN°3dosagedel'acide LactiqueDocument2 pagesTPN°3dosagedel'acide LactiqueNassimaPas encore d'évaluation
- Culture Cellulaire COUR 1Document10 pagesCulture Cellulaire COUR 1Hadjer AdaidaPas encore d'évaluation
- Referentiels Non Galileens ExercicesDocument6 pagesReferentiels Non Galileens ExercicesRobio GaminGPas encore d'évaluation
- W2941-22 MigDocument260 pagesW2941-22 MigMohammed DIABPas encore d'évaluation
- Série D'exercices ElectrostatDocument2 pagesSérie D'exercices ElectrostatKheria Zitouni100% (3)
- Les Mesures en ChimieDocument6 pagesLes Mesures en ChimieamalPas encore d'évaluation
- CCP 2003Document13 pagesCCP 2003Hamza Filali BabaPas encore d'évaluation
- Chapitre1 Notions de Base de L'électricité - TirageDocument7 pagesChapitre1 Notions de Base de L'électricité - TiragenoussanasnoussaPas encore d'évaluation
- Actions Sur ParoiDocument9 pagesActions Sur ParoiMed ElouartiPas encore d'évaluation
- Fiche Transport Addition de Poids ExerciceDocument11 pagesFiche Transport Addition de Poids ExercicezfodhilPas encore d'évaluation
- THT-63-2T-12.5-14º-F-400 IE3: Courbe Caractéristique Et Acoustique Pour 1,2Kg/MDocument3 pagesTHT-63-2T-12.5-14º-F-400 IE3: Courbe Caractéristique Et Acoustique Pour 1,2Kg/MMohamed MouslimPas encore d'évaluation
- TD Magnétostatique-Série 4-2021Document5 pagesTD Magnétostatique-Série 4-2021Zakaria MJPas encore d'évaluation
- Crushing FinalDocument57 pagesCrushing Finalsheritier80Pas encore d'évaluation
- Mécanique Analytique Cours en Français 2020-2021Document105 pagesMécanique Analytique Cours en Français 2020-2021Marius BrunetPas encore d'évaluation
- Amines AliphatiquesDocument7 pagesAmines AliphatiquesOussam OuadidiPas encore d'évaluation
- SEQ 5 - Stabilité Des Entités ChimiquesDocument4 pagesSEQ 5 - Stabilité Des Entités ChimiquesSpectre UnPas encore d'évaluation
- CTP Absorbeur Alcoll EthyliqueDocument17 pagesCTP Absorbeur Alcoll EthyliqueRemy Blondel100% (1)
- Révisions Physique 3D - Exercices 31-05-20Document30 pagesRévisions Physique 3D - Exercices 31-05-20Mentalité ArchaïquePas encore d'évaluation
- Cahier de Texte F. Jehin 2008/2009 Ts2 Photonique: TP AMOS - ProjetsDocument6 pagesCahier de Texte F. Jehin 2008/2009 Ts2 Photonique: TP AMOS - ProjetsSalim KarimPas encore d'évaluation
- Togo 2016 Phyiques Series CEDocument4 pagesTogo 2016 Phyiques Series CEHAMADA1972100% (1)
- Chapitre 9 Transferts ThermiquesDocument7 pagesChapitre 9 Transferts ThermiquesDina DekhilPas encore d'évaluation
- Hydraulique - Dut de Génie CivilDocument96 pagesHydraulique - Dut de Génie CivilJulienne valerie AgodigoPas encore d'évaluation
- Chapitre 11. Nombre D'étages Théoriques Dans Les Systèmes ImmisciblesDocument10 pagesChapitre 11. Nombre D'étages Théoriques Dans Les Systèmes ImmisciblesZizou LeePas encore d'évaluation
- Série Théorèmes GénérauxDocument3 pagesSérie Théorèmes Générauxsalem nourPas encore d'évaluation
- Chapitre 3 - Régime Transitoire (Série 2)Document3 pagesChapitre 3 - Régime Transitoire (Série 2)fahd10lassalPas encore d'évaluation
- ThermodynamiqueDocument65 pagesThermodynamiqueulrich victor kuatePas encore d'évaluation
- Exercice 1Document4 pagesExercice 1Débonnaire Bandeya100% (1)
- Équipements de Chauffage Et Locaux TechniqueDocument13 pagesÉquipements de Chauffage Et Locaux Techniquebaho btwPas encore d'évaluation
- Partie I ElectromagnétiqueDocument31 pagesPartie I Electromagnétiquealeatoire buzzPas encore d'évaluation
- Devoir 2 TS 2015 2016Document4 pagesDevoir 2 TS 2015 2016rranjalalaoPas encore d'évaluation
- DS1 Chap1Document1 pageDS1 Chap1valdxPas encore d'évaluation