Académique Documents
Professionnel Documents
Culture Documents
Potentiel Chimique Exercices
Transféré par
Yassine RakchoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Potentiel Chimique Exercices
Transféré par
Yassine RakchoDroits d'auteur :
Formats disponibles
Thermodynamique 1 :
Potentiel chimique
Testez-vous !
1. Etat standard (*)
L’état standard correspond à T = 298 K et P = P° = 1 bar.
a) Vrai
b) Faux
2. Condition d’évolution spontanée (*)
La condition d’évolution d’un système chimique pour une transformation à température et pression
constantes est dG ≥ 0.
c) Vrai
d) Faux
3. Différentielle de G (*)
Donner l’expression de la différentielle de G pour un système comportant N constituants Bi. Que devient cette
expression lorsque le système est fermé et siège d’une unique transformation chimique modélisée par
l’équation de réaction 0 = ∑ υ B .
4. Etats standard (*)
Ecrire les différents états standard du dibrome à 25 °C. Dire pour chacun s’il est réel ou hypothétique.
Exercices d’entraînement
5. Equilibre du corps pur sous deux phases (*)
1. Montrer que, dans un système fermé constitué d’un corps pur présent sous deux phases notées α et β, la
situation d’équilibre entre les deux phases est associée à l’égalité des potentiels chimiques.
2. On considère l’équilibre entre un liquide pur contenant exclusivement l’espèce A(ℓ) et une phase gazeuse
parfaite contenant, entre autres, A(g). Etablir la relation entre la pression de vapeur saturante P*A et les
potentiels chimiques standard µ°A,ℓ et µ°A,g.
3. On considère désormais que la phase liquide n’est pas pure, mais qu’elle constitue un mélange liquide
idéal. Etablir la relation entre la pression partielle PA de A dans la phase gazeuse à l’équilibre, la pression
ℓ
de vapeur saturante P*A et la fraction molaire x A de A dans la phase liquide.
6. Calcul d’une variation d’enthalpie libre
On considère un réacteur maintenu à 100 °C et sous une pression constante P = 2 bar. Le réacteur contient
initialement 2 moles d’un mélange équimolaire de deux liquides A et B. Les deux liquides sont non miscibles et
ils réagissent totalement pour former un gaz C, considéré comme parfait, selon l’équation de réaction
A + B = C. Tous les constituants sont idéaux.
Calculer la variation d’enthalpie libre du système (= contenu du réacteur) au cours de cette transformation.
-1 -1
Données : à 100 °C, µ°A,ℓ = µ°B,ℓ = 10,0 kJ.mol et µ°C,g = 1,90 kJ.mol .
7. Mélange de deux gaz (*)
Un récipient calorifugé est séparé en deux compartiments identiques (volume d’un compartiment noté V) :
• Le premier contient n1 = 5,0 mol de diazote sous P1 = 2,5 bar à 25 °C,
• Le second, n2 = 6,0 mol d'argon sous P2 = 3,0 bar à 25 °C.
Ces deux gaz seront considérés parfaits.
On enlève la paroi : les deux gaz se mélangent sans réagir en formant un mélange idéal. La température reste
constante au cours du mélange.
1. Exprimer, pour chaque gaz, le potentiel chimique avant et après mélange.
2. Pour une fonction d'état X, on appelle grandeur de mélange la différence ΔmélX = Xaprès mélange - Xavant mélange.
Déterminer les grandeurs de mélange suivantes :
a. ΔmélG
b. ΔmélH
c. ΔmélS.
3. En déduire l’entropie créée lors de ce mélange. Conclure.
4. Montrer que la température reste bien constante au cours du mélange.
-1 -1
Donnée : Constante des gaz parfaits R = 8,31 J.K .mol
Réflexion pratique / Vie quotidienne
8. Transformer du graphite en diamant ?
-1
On considère, à 25 °C, deux formes solides du carbone (MC = 12 g.mol ) : le graphite (densité : dgraph = 2,2 ;
-1 -1
potentiel chimique standard : µ°graph = 0,0 kJ.mol ) et le diamant (ddiam = 3,5 ; µ°diam = 2,9 kJ.mol ).
1. On considère l’équilibre Cgraph = Cdiam. Grâce aux potentiels chimiques, prévoir dans quel sens devrait avoir
lieu la transformation ? Quelle est donc la forme solide du carbone la plus stable à 25 °C, sous 1 bar ?
2. Pourquoi alors peut-on observer les deux formes du carbone à 25 °C sous 1 bar ?
3. A quelle pression faut-il se placer pour que ces deux variétés soient à l’équilibre ? Dans cette question, on
ne considèrera pas que l’influence de la pression sur les phases condensées est négligeable.
9. Transformation de l’alcool de grain en vodka
On veut transformer, par addition d’eau, 1,00 L d’alcool de grain, mélange eau-éthanol à 96 % en masse
d’éthanol, en vodka, mélange eau-éthanol à 56 % en masse d’éthanol. Quel volume VA d’eau faut-il ajouter ?
Quel est le volume VV de vodka obtenu ?
3 -1
Le tableau suivant donne les volumes molaires partiels en cm .mol .
Alcool de grain Vodka
Ethanol 56,01 56,58
Eau 14,61 17,11
-3
Masse volumique de l’eau liquide : ρeau = 1,00 g.cm .
-1 -1
Masses molaires : Ethanol : 46 g.mol ; Eau : 18 g.mol .
Exercices d’approfondissement
10. Pression osmotique
L’osmose est un phénomène très important au niveau cellulaire, qui résulte de l’influence de la pression sur le
potentiel chimique des phases condensées. La technique d’osmométrie est utilisée pour la détermination de
masses molaires des macromolécules. Le principe d’un osmomètre est le suivant :
A B
(solvant pur) (solution aqueuse
d’un soluté)
membrane
semi-perméable
Le compartiment A contient un solvant (composé 1), le compartiment B contient ce même solvant et un soluté
non ionique (composé 2). Les deux compartiments sont séparés par une membrane semi-perméable, qui laisse
traverser uniquement les molécules de solvant. Le remplissage initial est effectué de telle façon que les
niveaux de liquide dans A et B soient identiques. La température T du système est maintenue constante.
On constate que le solvant traverse la membrane de A vers B. Quand le transfert de matière cesse, on observe
une dénivellation h entre les niveaux libres des deux compartiments. Ainsi, à une même profondeur, les
pressions PA et PB dans chacun des compartiments sont différentes.
La surpression PB - PA est appelée pression osmotique et notée π. En supposant la masse volumique ρ du fluide
identique dans les deux compartiments, π peut être reliée à h par la relation fondamentale de la statique des
fluides : π = ρgh.
On supposera que la solution aqueuse dans le compartiment B est idéale, et on notera x1 la fraction molaire du
solvant (eau) et x2 la fraction molaire du soluté.
1. En raisonnant sur le potentiel chimique du solvant, expliquer qualitativement le sens d’évolution du
système vers l’état d’équilibre.
2. Donner la condition d’équilibre en termes de potentiel chimique. En déduire une relation entre la
*
pression osmotique π, le volume molaire Vm du solvant, supposé indépendant de la pression, et la
fraction molaire x1 du solvant dans le compartiment B à l’équilibre.
3. En considérant la solution comme très diluée, montrer que π.V = nRT, où n est la quantité de matière du
soluté et V le volume de la solution dans le compartiment B.
4. Application : à T = 293 K, une solution aqueuse d’une protéine extraite de sang de bœuf de concentration
-1
massique c2 = 30 g.L conduit à une dénivellation h = 13,7 cm lors de l’étude osmométrique. En déduire
la masse molaire de la protéine.
Données : ρeau = 1 kg.L et g = 9,81 m.s
-1 -2
11. Ebulliométrie
L’introduction d’une espèce dans un solvant pur entraîne une modification de la température d’ébullition du
-1
solvant. Le benzène, noté A par la suite (MA = 78 g.mol ) bout, sous 1 bar, à 80,1°C lorsqu’il est pur. En
revanche, si on dissout 13,76 g d'un corps B dans 100 g de benzène (solution de B dans le solvant A), l’ébullition
débute à 82,4°C.
L’objet de cet exercice est de montrer que l’augmentation de température d’ébullition (soit 2,3 °C ici) permet
d’estimer la masse molaire de B.
On considère un mélange constitué d'un solvant A et d'un soluté B. Le mélange liquide de A et B est considéré
idéal. La phase gazeuse ne contient que l’espèce A. La pression totale de la phase gaz sera supposée égale à P°.
1. Rappeler l'expression donnant les variations du potentiel chimique d'un corps pur A en fonction de la
température. On supposera que l’entropie molaire du corps pur est constante sur tout intervalle de
température où l’état physique ne change pas.
ℓ
2. En notant xA la fraction molaire de A en phase liquide supposée idéale, quelle est l'expression du
potentiel chimique du constituant A. On l’exprimera, en particulier, en fonction du potentiel chimique du
ℓ
corps pur et de xA .
3. En déduire qu’en présence de l’impureté, la température d'ébullition commençante notée T (proche de
Teb*), est supérieure à Teb*, température d’ébullition du corps pur. On pourra montrer que :
∗
T = Teb* - ln ( ℓ )
°
où ΔvapH° représente l’enthalpie standard de vaporisation telle que ΔvapH° = Teb*.(S°*m,A,g - S°*m,A,ℓ).
ℓ ℓ
4. En déduire que la fraction molaire de l’impureté dans la phase liquide xB (xB << 1) peut être exprimée de
la façon suivante, avec ΔT = T – Teb* :
ℓ
. !" #°
= ∗ )'
$( %&
5. Déduire des données numériques de l’introduction une valeur approchée de la masse molaire de B, MB.
∆vapH°(benzène) = 31 kJ.mol
-1
Donnée :
Vous aimerez peut-être aussi
- TD de Thermodynamique ChimiqueDocument2 pagesTD de Thermodynamique Chimiquekhalifa El harfi100% (1)
- °smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Document23 pages°smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Ayoub OuangliPas encore d'évaluation
- Thermodynamique Chimique: Cours Du ModuleDocument115 pagesThermodynamique Chimique: Cours Du ModuleG95 PfePas encore d'évaluation
- Serie 3 (2019-2020)Document5 pagesSerie 3 (2019-2020)samiraPas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- M28 Thermo TD3 CorrectionDocument3 pagesM28 Thermo TD3 CorrectionHassan Driouach100% (1)
- Corrigé Des Contrôles de Thermodynamique Chimique S4 2012-2019Document120 pagesCorrigé Des Contrôles de Thermodynamique Chimique S4 2012-2019Mohamed Ait allaPas encore d'évaluation
- Corrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Document2 pagesCorrigé Type Chimie Des Surfaces Master 1 CHIMIE M S1 2019 2020Zahra l زهرة50% (2)
- Examen Normale (18-19)Document3 pagesExamen Normale (18-19)Khlid100% (2)
- Melange Ethanol EauDocument8 pagesMelange Ethanol EauImi LouzaPas encore d'évaluation
- 19 Mai 2020 Exercices Supplémentaires Corrigés-Solutions RéellesDocument6 pages19 Mai 2020 Exercices Supplémentaires Corrigés-Solutions Réellesrachida lakaaz50% (2)
- 1 2 B Enonce ExercicesDocument8 pages1 2 B Enonce Exerciceszineb senhajiPas encore d'évaluation
- Exercices Réactions Acido-BasiquesDocument4 pagesExercices Réactions Acido-Basiquesayyoub dhbPas encore d'évaluation
- TD N°2 2020Document2 pagesTD N°2 2020Ñar ĎjesPas encore d'évaluation
- TP N° 2 (Equilibre Chimique)Document5 pagesTP N° 2 (Equilibre Chimique)M'hamed Nezli ToudjiPas encore d'évaluation
- Méthodes Electrochimiques (Partie 2)Document12 pagesMéthodes Electrochimiques (Partie 2)Lina BahazPas encore d'évaluation
- TD 4,5 Et 6 PDFDocument5 pagesTD 4,5 Et 6 PDFessadikine anassPas encore d'évaluation
- Chapitre-Intermédiaires RéactionnelsDocument9 pagesChapitre-Intermédiaires RéactionnelsIsmail ZitouniPas encore d'évaluation
- TD2 Structure - 12 - 13Document7 pagesTD2 Structure - 12 - 13sidi mohamed el amine nekkalPas encore d'évaluation
- Cours Thermo - Chapitre 3 - Diagramme de Phase Du Corps Pur - 2018Document28 pagesCours Thermo - Chapitre 3 - Diagramme de Phase Du Corps Pur - 2018ait hssain100% (1)
- TD ChimieDocument50 pagesTD ChimieHoussam BenkerroumPas encore d'évaluation
- Cours Thermo - Chapitre 7. Solutions Réelles - 2019Document27 pagesCours Thermo - Chapitre 7. Solutions Réelles - 2019ait hssainPas encore d'évaluation
- Serie 3 EquilibreDocument8 pagesSerie 3 EquilibreBadre OuzougarPas encore d'évaluation
- Séance 04 Juin 2020Document29 pagesSéance 04 Juin 2020Hafsa MajentaPas encore d'évaluation
- Chapitre 5. Solutions IdéalesDocument19 pagesChapitre 5. Solutions Idéaleshayat LOUKILIPas encore d'évaluation
- Chapitre I (Potentiel Chimique) 2015Document37 pagesChapitre I (Potentiel Chimique) 2015Chaouki100% (1)
- Cours DR BENAMIRA MESSAOUD Cinétique Chimique Master 2 Chimie Des MatériauxDocument66 pagesCours DR BENAMIRA MESSAOUD Cinétique Chimique Master 2 Chimie Des MatériauxaminePas encore d'évaluation
- Grandeurs Molaires PartiellesDocument53 pagesGrandeurs Molaires Partiellesmradid7930100% (2)
- Tds Chimie Quantique l3Document15 pagesTds Chimie Quantique l3يا سينPas encore d'évaluation
- Polycopié de TP Thermodynamique Chimique SMC s4Document19 pagesPolycopié de TP Thermodynamique Chimique SMC s4Ilham KarmaPas encore d'évaluation
- TD N°2-Chapitre II. Mécanismes RéactionnelsDocument6 pagesTD N°2-Chapitre II. Mécanismes RéactionnelsJojo BoubPas encore d'évaluation
- AminesDocument21 pagesAminesAhmad ElhamriPas encore d'évaluation
- Séries de TDDocument10 pagesSéries de TDAmara Mounia100% (1)
- Travaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreDocument4 pagesTravaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreAbderrahman IGHNIHPas encore d'évaluation
- Preparation Des Carbocycles Non AromatiquesDocument13 pagesPreparation Des Carbocycles Non AromatiquesJean-François AbenaPas encore d'évaluation
- Chapitre IIIDocument11 pagesChapitre IIIHåmēd Bën MåkhtārįPas encore d'évaluation
- Alkylation PDFDocument12 pagesAlkylation PDFNeila HasnaouiPas encore d'évaluation
- Chap 4 DiènesDocument16 pagesChap 4 DiènesWahab HoubadPas encore d'évaluation
- Examen Smc3 - 2016-17 Rattrapage CorrigeDocument4 pagesExamen Smc3 - 2016-17 Rattrapage Corrigeayyoub dhbPas encore d'évaluation
- Exam I 7Document3 pagesExam I 7Dlimi MohamedPas encore d'évaluation
- A 1 3 Mecanisme sn2Document5 pagesA 1 3 Mecanisme sn2Yc YacinePas encore d'évaluation
- Examen Thermo Et Cinétique S4 Juillet 2011Document2 pagesExamen Thermo Et Cinétique S4 Juillet 2011محمد الفاتح50% (6)
- SMC4 Examen Juillet 2013Document4 pagesSMC4 Examen Juillet 2013Yc YacinePas encore d'évaluation
- Sc389rie 2 Les AlcanesDocument2 pagesSc389rie 2 Les AlcanesDavid MbangPas encore d'évaluation
- Chapitre IDocument12 pagesChapitre INak awadPas encore d'évaluation
- CC-Exos1 1011Document11 pagesCC-Exos1 1011Dabo100% (1)
- TD RMN LSTDocument10 pagesTD RMN LSTHajar AMENAOUPas encore d'évaluation
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Examen Chimie Organique 2016-2017Document5 pagesExamen Chimie Organique 2016-2017RedOne DerrouazinPas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- 2013s7corrigee PDFDocument28 pages2013s7corrigee PDFJamel Gasmi100% (1)
- Examen Cin Et Cat Avec Correction de Ratt 2017-2018Document6 pagesExamen Cin Et Cat Avec Correction de Ratt 2017-2018Chai MaePas encore d'évaluation
- Cinetique Ex Cor 1Document5 pagesCinetique Ex Cor 1Habet Sara100% (1)
- Série 2 Liquide Vapeur (Chimie)Document9 pagesSérie 2 Liquide Vapeur (Chimie)Chedly TrimechPas encore d'évaluation
- Fiche de TD 1 Thermo L3 GP 2020-2021Document2 pagesFiche de TD 1 Thermo L3 GP 2020-2021Nardjes Ben100% (1)
- Exercices Chimie Organique Inductif MesomereDocument5 pagesExercices Chimie Organique Inductif MesomereAmal Hamdi33% (3)
- td4 PotentielchimiqueDocument3 pagestd4 PotentielchimiqueAbde TamPas encore d'évaluation
- Fiche de TD 1 Thermo L3 GP 2019-2020Document2 pagesFiche de TD 1 Thermo L3 GP 2019-2020ben binah67% (3)
- Binaires 2Document8 pagesBinaires 2محمد الفاتح100% (1)
- TD-thermo 2015Document3 pagesTD-thermo 2015Mohamed EL FAGHLOUMIPas encore d'évaluation
- Chapitre1 Introduction Rappels PDFDocument12 pagesChapitre1 Introduction Rappels PDFfaiza chihabPas encore d'évaluation
- Chap2 Cinématique2Document33 pagesChap2 Cinématique2Yassine RakchoPas encore d'évaluation
- Cours Traitement de Surface Cherkaoui PDFDocument23 pagesCours Traitement de Surface Cherkaoui PDFYassine RakchoPas encore d'évaluation
- Pages From Principe de Newton PDFDocument4 pagesPages From Principe de Newton PDFYassine RakchoPas encore d'évaluation
- CristalographieDocument3 pagesCristalographieYassine RakchoPas encore d'évaluation
- Cours Traitement de Surface Cherkaoui PDFDocument23 pagesCours Traitement de Surface Cherkaoui PDFYassine RakchoPas encore d'évaluation
- Oral MasterDocument2 pagesOral MasterBERPas encore d'évaluation
- TP Dosage WinklerDocument5 pagesTP Dosage WinklerYassine RakchoPas encore d'évaluation
- Chapitre 01 PDFDocument18 pagesChapitre 01 PDFHanitetPas encore d'évaluation
- Exercices Tensioactifsemulsions MoussesDocument3 pagesExercices Tensioactifsemulsions MoussesYassine RakchoPas encore d'évaluation
- SiliciumDocument7 pagesSiliciumDarel NadjieraPas encore d'évaluation
- Nouveau Document Microsoft WordDocument1 pageNouveau Document Microsoft WordYassine RakchoPas encore d'évaluation
- Annexe Newsletter Technique N°8 Corrosion GalvaniqueDocument7 pagesAnnexe Newsletter Technique N°8 Corrosion GalvaniqueYassine RakchoPas encore d'évaluation
- Chimie Descriptive TransitionsDocument5 pagesChimie Descriptive TransitionsYassine Rakcho0% (1)
- 6 Exc2001Document5 pages6 Exc2001Yassine RakchoPas encore d'évaluation
- Couples GalvaniquesDocument16 pagesCouples GalvaniquesBen RahierPas encore d'évaluation
- Chap6 MecaDocument11 pagesChap6 MecaYassine RakchoPas encore d'évaluation
- Chap Cristallographie PDFDocument28 pagesChap Cristallographie PDFYassine RakchoPas encore d'évaluation
- Cours Proba Stat 2011Document54 pagesCours Proba Stat 2011Dan SasuPas encore d'évaluation
- Correction Rattrapage S3 2016Document9 pagesCorrection Rattrapage S3 2016Yassine RakchoPas encore d'évaluation
- Agregation PDFDocument5 pagesAgregation PDFYassine RakchoPas encore d'évaluation
- Agregation PDFDocument5 pagesAgregation PDFYassine RakchoPas encore d'évaluation
- Travaux Pratique SMC3 Chimie Descriptiv1Document3 pagesTravaux Pratique SMC3 Chimie Descriptiv1Yassine RakchoPas encore d'évaluation
- Les Gaz RéelsDocument29 pagesLes Gaz RéelshoussemPas encore d'évaluation
- 1 Synthese D Une Base de SchiffDocument4 pages1 Synthese D Une Base de SchiffYassine Rakcho50% (2)
- Nouveau Document Microsoft WordDocument1 pageNouveau Document Microsoft WordYassine RakchoPas encore d'évaluation
- Nouveau Document TexteDocument1 pageNouveau Document TexteYassine RakchoPas encore d'évaluation
- Correction Examen PC Juin 2016 2bac SVT FRDocument7 pagesCorrection Examen PC Juin 2016 2bac SVT FRhassan ibnahmadPas encore d'évaluation
- FT Vide InertieDocument5 pagesFT Vide InertielaurynPas encore d'évaluation
- Chap I I Biomedical eDocument26 pagesChap I I Biomedical eZOUHAIR KADDIOUIPas encore d'évaluation
- S2 1011 Mecanique Des Fluides TD CorrectionDocument9 pagesS2 1011 Mecanique Des Fluides TD Correctiontarif ashtarPas encore d'évaluation
- Etude Des Pendules Couplés Par Une Barre de Torsion: I-But Du TravailDocument5 pagesEtude Des Pendules Couplés Par Une Barre de Torsion: I-But Du TravailSamado Tips46Pas encore d'évaluation
- M Ecanique Quantique II - Corrig e S Erie 2: 1 Delta de Dirac IDocument9 pagesM Ecanique Quantique II - Corrig e S Erie 2: 1 Delta de Dirac Iaba armelPas encore d'évaluation
- Programme Instrumentation Et Métrologie LEEA2 - S3 PDFDocument2 pagesProgramme Instrumentation Et Métrologie LEEA2 - S3 PDFParfumerie Actu'EllePas encore d'évaluation
- Modélisation en 2 Dimensions D'une Poutre de Forme Rectangulaire Trouée, Homogène Et Isotrope en Élastoplasticité Sous Sollicitation StatiqueDocument8 pagesModélisation en 2 Dimensions D'une Poutre de Forme Rectangulaire Trouée, Homogène Et Isotrope en Élastoplasticité Sous Sollicitation StatiqueYOUNES KABBAJPas encore d'évaluation
- WWW - Cours Gratuit - Com Id 10654Document87 pagesWWW - Cours Gratuit - Com Id 10654Zakaria HaouariPas encore d'évaluation
- Correction Ex1 - TD2 Cinématique FST-BM 20-21Document3 pagesCorrection Ex1 - TD2 Cinématique FST-BM 20-21Oussama SafiPas encore d'évaluation
- تمارينDocument4 pagesتمارينnouraddine tadmoriPas encore d'évaluation
- Cours DSsDocument227 pagesCours DSslouabdiaPas encore d'évaluation
- Ens ScientDocument1 pageEns ScientfachaferreroPas encore d'évaluation
- TD1Document1 pageTD1DjamalPas encore d'évaluation
- 1.série N°1 de Chimie II - 1er CP - 2018-2019 ModDocument7 pages1.série N°1 de Chimie II - 1er CP - 2018-2019 ModLAICHAOUI NOURELIMANEPas encore d'évaluation
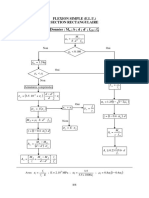
- Organigrame BaelDocument5 pagesOrganigrame BaelKaram HoussamPas encore d'évaluation
- 636116bfcb71b - Magazine1 ÉnoncéDocument5 pages636116bfcb71b - Magazine1 ÉnoncéAmine MohamedPas encore d'évaluation
- Les Transformations PhysiquesDocument6 pagesLes Transformations Physiquesbcmdata bcmdata100% (1)
- Les Defauts TriphasesDocument12 pagesLes Defauts TriphasesBillel Soti100% (1)
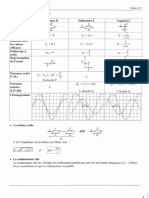
- Formulaire Dipoles ParfaitsDocument1 pageFormulaire Dipoles ParfaitsDavid100% (1)
- RPFE (Récupération de L'énergie Biomécanique) 2023Document38 pagesRPFE (Récupération de L'énergie Biomécanique) 2023Loffy AyouPas encore d'évaluation
- C4 2Document22 pagesC4 2Hoang-Vu BuiPas encore d'évaluation
- Chap M2Document33 pagesChap M2Kader MilanoPas encore d'évaluation
- Couples de Serrage - Couples de Controle (Gedore) PDFDocument12 pagesCouples de Serrage - Couples de Controle (Gedore) PDFAmi RoslanePas encore d'évaluation
- Cours S4 Edp 08Document81 pagesCours S4 Edp 08Guy Gildas DjemPas encore d'évaluation
- Control Non DestructifDocument7 pagesControl Non Destructifhouyam hamdiPas encore d'évaluation
- B00U9J23CUDocument10 pagesB00U9J23CUMohammadPas encore d'évaluation
- QCM Phisique-ChimieDocument2 pagesQCM Phisique-ChimieklowkerPas encore d'évaluation
- Exercice 1Document6 pagesExercice 1Houssam FerrahPas encore d'évaluation