Académique Documents
Professionnel Documents
Culture Documents
D3 1S1 2019 LSLL Wahabdiop
Transféré par
Amadou Makhtar SeckTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
D3 1S1 2019 LSLL Wahabdiop
Transféré par
Amadou Makhtar SeckDroits d'auteur :
Formats disponibles
Cours à domicile -Wahab Diop - 775136349
,;,1•C'11 LYCEE TECHNIQUE Premières Sl&S3
I ;jf l,} . .
Année scolaire 2018- 2019
&:f Vr·,f,SEYDINA UMAMOU LAVE Durée : 03heures
~ ,. Guédiawaye - Dakar ,
DEVOIS SURVEILLE N° 1 DU SSECOND SEMESTRE 1
Exercice n ° 1
Donnée: masse volumique du corps A PA= 0,8g.cm-3 ; densité du corps B par rapport à l'eau dB= 1,05;
masse volumique de l'eau Peau= lg.cm-3 ; Masse molaire en g.moJ- 1 : C =12; H=l; 0=16
1. On dispose un alcool à radical aliphatique A contenant deux fois plus d'atomes de carbone qu'un acide
carboxylique B à chaine carbonée saturée comportant n atomes de carbone.
l.l .Donner la formule générale de l'alcool A et de l'acide carboxylique Ben fonction den.
1.2.Exprimer le pourcentage en masse de carbone dans A Pc (A) en fonction den et celui de carbone dans B
noté Pc (B) en fonction de n toujours.
1.3.Sachant que Pc (A)=:~ Pc (B), montrer que n=2 et déduire les formules brutes de A et de B.
1.4.Donner la formule semi - développée exacte et le nom de A et de B sachant que A est obtenu par
hydratation d'un alcène A' que l'on précisera en même temps qu'un alcool At optiquement actif (ou
molécule chirale).
1.5.L'action du dichromate de potassium en milieu acide sur A conduit à un composé C qui donne avec la
DNPH un précipité jaune et en plus rosit le réactif de Schiff. Donner la formule semi- développée et le nom
de C.
2. On mélange dans un ballon un volume Y1= 28,6ml d'une solution de B et un volume Y2= 46,2ml de l'alcool
A. On introduit 7,5ml du mélange dans chacun des tubes à essais numérotés que l'on place dans un bain
marie à l 00°C. Dans chaque tube on introduit trois gouttes d'acide sulfurique concentré.
A différentes dates t, on dose l'acide restant dans un tube à l'aide d'une solution d'hydroxyde de sodium de
concentration molaire Cb=2mot.L· 1. Soit Yb le volume d'hydroxyde de sodium qu'il faut ajouter au contenu du
tube à essais pour obtenir l'équivalence. Un dosage préalable montre que trois gouttes d'acide sulfurique
concentré sont neutralisés par V= 2ml de la solution d'hydroxyde de sodium. Le tableau des résultats du dosage
est le suivant :
t(min) 0 2 5 8 12 16 20 25 30 40 50
3
Yb(cm ) 22 17,5 15 13,l 12,2 11,6 ll,I 10,9 10,6 10,5
n(B)restant
n(ester formé)
2.1.Ecrire l'équation bilan de la réaction entre A et B. Donner son nom et ses caractéristiques.
2.2.Montrer que le mélange initial entre A et Best équimolaire.
2.3.Quel est le rôle de l'acide sulfurique?
2.4.Montrer que n(B)restant=Cb(Yb- V).
2.5. Déterminer la quantité de matière initiale contenue dans un tube à essais. Calculer Yb à la date t=0 puis
compléter le tableau.
2.6.Tracer la courbe représentant les variations du nombre de moles d'ester formé en fonction du temps.
Echelle: lem ➔ 5. 10· 3mol et lcm ➔4min.
2.7.On définit la vitesse moyenne de formation de l'ester entre les d~tes t1 et t2 par le rapport :
n(t2)-n(t1) ,
V= ou n(t) est le nombre de moles a la date t.
t2- t1
c1uu,1 DE SC.PH ,.s.u. GUEDIAIUAYE • Dl(
1
(C) Wahab Diop 2018/2019 https://physiquechimie.godaddysites.com
Cours à domicile -Wahab Diop - 775136349
2.8.Calculer la vitesse moyenne de formation de l'ester entre les dates t=Smin et t=20min puis entre les dates
t=25min et t=50min. On précisera l'unité de cette vitesse. Comparer ces résultats et conclure.
Exercice n° 2
Dans un récipient parfaitement adiabatique de capacité thermique K= 42 J. °K" 1 à la température ambiante de
25°C d'un laboratoire de TP physiques, on introduit rapidement 500g de glace sortie du compartiment surgelé
d'un congélateur à la température 0o.
A l'équilibre thermique, la température dans le récipient est 01 .
1. Exprimer la température 0o en fonction de 01
2. On dissipe dans le récipient et son contenu à la température 01
de la chaleur au moyen d'une résistance chauffante de /
,,
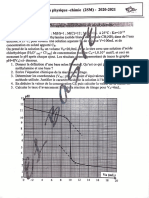
puissance électrique P= 2,25kW. Le relevé de la température 0 '
;
dans le récipient à différentes dates ta permis de tracer le
graphe ci - contre.
Sachant que 19% de l'énergie électrique fournie par la
résistance chauffante se dissipent dans l'air ambiant du labo
supposé hermétique et de dimensions 8mx5mx3,5m; 8
2.1.Détenniner la température 81. En déduire la température 0o.
2.2.Déterminer la date t2.
2.3.Déterminer la température ambiante du labo à la fin de l'expérience.
On donne: chaleur massique de la glace Cg=2100 J.kg· 1.°K· 1 ; chaleur massique de l'air Ca1r=820
J.kg· 1.°K 1 ; masse volumique de l'air pair=l ,30 g ..e· 1 chaleur latente de fusion de la glace Lt=330J/g;
3. L'énergie électrique fournie par la résistance chauffante est obtenue par conversion de l'énergie
rayonnée par le soleil. A cet effet, on dispose de panneaux solaires pour la conversion de l'énergie.
Dans l'espace au voisinage de la terre, le rayonnement solaire est de 1,35kW.m·2.
Le rendement de la conversion d'énergie rayonnée en énergie électrique est de 17%.
3.1. Quelle devrait être la surface active de ces panneaux solaires pour fournir toute l'énergie électrique
requise pour la durée de l'expérience ?
3.2.En 24h, les panneaux solaires sont actifs pendant I lh.
Calculer en kWh l'énergie électrique produite par ces panneaux solaires en un jour.
Exercice n ° 3
1. Deux pendules électrostatiques identiques préalablement électrisés de
1a même façon ont une longueur f= 10cm et une masse m= Jg. lis
---......---...---
o
portent la même charge q et sont accrochés l'un au voisinage de
l'autre dans le vide en deux points O et O' du même plan horizontal.
Ils se repoussent et s'écartent de leur position d'équilibre d'un angle a
comme l'indique la figure ci- contre.
LI.Déterminer la valeur de la charge q si les points O et O' sont distants
de 5cm et les points A et A' correspondants aux positions des masses
à l'équilibre distants de 7cm. On prendra g= ION.kg·'. A'
1.2.Sachant que q est positive, déterminer les caractéristiques du champ
électrostatique créé par les deux masses chargées au point M milieu
deOO'.
2. Les deux pendules, portant la charge positive q, sont accrochés au même point O et s'écartent cette fois-
ci d'un angle p par rapport à la verticale. Montrer que l'angle P peut se mettre sous la forme d'une
équation de la forme : a tan 3 p + b tan 2 J} +b= 0 où a, b et c sont des constantes à préciser.
1
On donne: k = - - = 9. 109 S.l
47lEo
CEHUlE DE SC.PH l.S.l.l. GUIDIAWAYE · DK ! 2
(C) Wahab Diop 2018/2019 https://physiquechimie.godaddysites.com
Vous aimerez peut-être aussi
- 1cm43qbu7 192034Document2 pages1cm43qbu7 192034brinimed06gmail.comPas encore d'évaluation
- CO1 1S1 2023 Iazig WahabdiopDocument3 pagesCO1 1S1 2023 Iazig WahabdiopLanding MassalyPas encore d'évaluation
- Série TD 1Document6 pagesSérie TD 1Manuel ArzolaPas encore d'évaluation
- Devoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDocument8 pagesDevoir Corrigé de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2014-2015) MR Ahmed Kadri PDFDadati Sou80% (5)
- Revision n1 1ere DDocument10 pagesRevision n1 1ere Detraore393Pas encore d'évaluation
- Epreuve de Sciences PhysiquesDocument5 pagesEpreuve de Sciences PhysiquesPetrovich sagloire Owabira ngomaPas encore d'évaluation
- Devoir Corrigé de Synthèse N°1 - Sciences Physiques - Bac Math (2015-2016) MR Benjeddou Rachid PDFDocument10 pagesDevoir Corrigé de Synthèse N°1 - Sciences Physiques - Bac Math (2015-2016) MR Benjeddou Rachid PDFMustapha ElhafiPas encore d'évaluation
- Devoir Controle 1 - Physique - Lycée Pilote SfaxDocument3 pagesDevoir Controle 1 - Physique - Lycée Pilote SfaxMouhieddine Khaili100% (2)
- D4 2S2 2019 LSLL WahabdiopDocument1 pageD4 2S2 2019 LSLL WahabdiopMoussa SAMBPas encore d'évaluation
- 1cm43csiq 629135Document1 page1cm43csiq 629135Amadou Makhtar SeckPas encore d'évaluation
- 4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDFDocument30 pages4 Devoirs Controle N°1 Avec Corrections Physique Lycee Pilote SFAX Bac Scientifiques PDFChaima IchaouiPas encore d'évaluation
- Devoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)Document4 pagesDevoir de Contrôle N°1 2016 2017 (MR Handoura Naceur)HaykelGaouaPas encore d'évaluation
- PhysiqueDocument3 pagesPhysiqueAurelien jahlibere KinkoengPas encore d'évaluation
- Eva 3 Physique PD Lybinynd.oDocument2 pagesEva 3 Physique PD Lybinynd.oNlem NdongoPas encore d'évaluation
- 1cm4262io 569649Document1 page1cm4262io 569649Amadou Makhtar SeckPas encore d'évaluation
- TD de Thermodynamique CPGE1-2023Document5 pagesTD de Thermodynamique CPGE1-2023Ange Michel Romuald DjePas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Mathématiques (2019-2020) MR Tlili Ahmed PDFDocument3 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Mathématiques (2019-2020) MR Tlili Ahmed PDFKhairedine LatamnaPas encore d'évaluation
- Devoir Controle 1 2024Document5 pagesDevoir Controle 1 2024rayentmar0Pas encore d'évaluation
- Pages de Bac Blanc 2Document5 pagesPages de Bac Blanc 2Khaouda Driss100% (1)
- S Physique Chimie Specialite 2015 Liban CorrigeDocument6 pagesS Physique Chimie Specialite 2015 Liban CorrigeLoundou ortegaPas encore d'évaluation
- TD1 OuerglaDocument8 pagesTD1 OuerglaMahfoud OmarPas encore d'évaluation
- Compo TS2 2023Document3 pagesCompo TS2 2023Bachire MbenguePas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibDocument6 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibMustapha ElhafiPas encore d'évaluation
- Annales, Le Retour !Document20 pagesAnnales, Le Retour !realofigor11Pas encore d'évaluation
- Thermodynamique TD, Tests, Exam CorrigeeDocument55 pagesThermodynamique TD, Tests, Exam CorrigeeAwatif BePas encore d'évaluation
- Devoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Kallel Chiheb PDFDocument10 pagesDevoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Kallel Chiheb PDFAzizElheniPas encore d'évaluation
- TD Thermo L1chi 23 24 022637Document6 pagesTD Thermo L1chi 23 24 022637milandcalebPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Informatique (2014-2015) MR Maalej Mohamed HabibDocument4 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Informatique (2014-2015) MR Maalej Mohamed Habiblouayrjili63Pas encore d'évaluation
- 2PY103 2020 CC2 SujetDocument3 pages2PY103 2020 CC2 Sujet666-489022Pas encore d'évaluation
- TD Biophysique IiDocument3 pagesTD Biophysique IiGabin KoumbaPas encore d'évaluation
- DS1 4Sc 2021 2022Document5 pagesDS1 4Sc 2021 2022Amen RouissiPas encore d'évaluation
- Controle 1 Bac SC 2019 MR Nabil AbdmoulehDocument6 pagesControle 1 Bac SC 2019 MR Nabil AbdmoulehMouhamed Ali SahbaniPas encore d'évaluation
- Exercice Pour TD Complet - CopieDocument6 pagesExercice Pour TD Complet - CopieAbbé Marc LESSAMBAPas encore d'évaluation
- 4DS1 2010Document5 pages4DS1 2010Riadh MarouaniPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - 3ème Math SC Exp (2008-2009) MR MhiriDocument2 pagesDevoir de Contrôle N°1 - Physique - 3ème Math SC Exp (2008-2009) MR MhiriHanine HmidaPas encore d'évaluation
- 3 EmeDocument1 page3 EmestefanPas encore d'évaluation
- Annale PC s1Document159 pagesAnnale PC s1King CatPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedDocument5 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Alibi Anouar (1) - DecryptedchihebPas encore d'évaluation
- Examens Thermodynamique FST TangerDocument18 pagesExamens Thermodynamique FST TangerAchraf El AzzouziPas encore d'évaluation
- Devoir de Synthèse N°1 - Physique - Bac SC Exp Math (2009-2010) MR BLaaroussi MR L.Akkari.DDocument5 pagesDevoir de Synthèse N°1 - Physique - Bac SC Exp Math (2009-2010) MR BLaaroussi MR L.Akkari.DhammouazizPas encore d'évaluation
- TD 2 ThermodynamiqueDocument2 pagesTD 2 ThermodynamiqueNouHa EL100% (1)
- TD 2 Thermodynamique PDFDocument2 pagesTD 2 Thermodynamique PDFKhalid Zeg100% (2)
- Devoir de Controle1 PhyziqueDocument6 pagesDevoir de Controle1 Phyziquemc50803260% (1)
- TD2 de ThermodynamiqueDocument2 pagesTD2 de ThermodynamiqueAwatif BePas encore d'évaluation
- PC Bac CDocument4 pagesPC Bac CJean Aristide SoulamaPas encore d'évaluation
- TD 1 ThermoDocument2 pagesTD 1 Thermomoney makerPas encore d'évaluation
- TD-Serie 1-2022-2023Document2 pagesTD-Serie 1-2022-2023Mohamed Es-sarghiniPas encore d'évaluation
- Tutorials Thermodynamics NTSOUKPOEDocument6 pagesTutorials Thermodynamics NTSOUKPOESangaré OumarPas encore d'évaluation
- ThermoDocument3 pagesThermoOumixa BenPas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR RIDHA BEN YAHMEDDocument6 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR RIDHA BEN YAHMEDjbeliee jbeliPas encore d'évaluation
- CHIMIE (9 Points)Document5 pagesCHIMIE (9 Points)ZizouPas encore d'évaluation
- Serie 3 - SMA-SMIDocument14 pagesSerie 3 - SMA-SMIscribd1964boooPas encore d'évaluation
- TD2 Thermo Peip2 2021Document2 pagesTD2 Thermo Peip2 2021Elyas TigrePas encore d'évaluation
- DMDocument3 pagesDMMarwane DevPas encore d'évaluation
- Exercices d'optique et d'électromagnétismeD'EverandExercices d'optique et d'électromagnétismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Bac Blanc 2019 1Document4 pagesBac Blanc 2019 1Amadou Makhtar SeckPas encore d'évaluation
- Programme SVT 2e Cycle 2015Document156 pagesProgramme SVT 2e Cycle 2015Renndo Cheikh Oumar Tall67% (3)
- THESE CHAPUT Mélanie 21042023Document200 pagesTHESE CHAPUT Mélanie 21042023Amadou Makhtar SeckPas encore d'évaluation
- Interro 1 20182019Document2 pagesInterro 1 20182019Amadou Makhtar SeckPas encore d'évaluation
- Compo PC 01 ts2Document6 pagesCompo PC 01 ts2Amadou Makhtar SeckPas encore d'évaluation
- Dev 4 Ts 22019Document4 pagesDev 4 Ts 22019Amadou Makhtar SeckPas encore d'évaluation
- Compo1 20162017Document4 pagesCompo1 20162017GueyePas encore d'évaluation
- Correction Devoir 3 ts2Document4 pagesCorrection Devoir 3 ts2Amadou Makhtar SeckPas encore d'évaluation
- Sabarthez Thomas. Thèse D'exercice de Pharmacie (UPJV)Document84 pagesSabarthez Thomas. Thèse D'exercice de Pharmacie (UPJV)Amadou Makhtar SeckPas encore d'évaluation
- Devoir SVT TS2 2020 2021 Lycee Sergent Malamine CamaraDocument4 pagesDevoir SVT TS2 2020 2021 Lycee Sergent Malamine CamaraAmadou Makhtar Seck100% (1)
- Fascicule SVTDocument146 pagesFascicule SVTAbou Sow100% (6)
- Evaluation Standadissees 1er Semestre SVT 1ere S1 2020-2021 SenegalDocument2 pagesEvaluation Standadissees 1er Semestre SVT 1ere S1 2020-2021 SenegalAmadou Makhtar Seck0% (1)
- Bac Blanc 2 ts2 1Document5 pagesBac Blanc 2 ts2 1Amadou Makhtar SeckPas encore d'évaluation
- 1cm3uif9r 558260Document3 pages1cm3uif9r 558260Amadou Makhtar SeckPas encore d'évaluation
- 1cm3ehhuo 196523Document1 page1cm3ehhuo 196523Amadou Makhtar SeckPas encore d'évaluation
- 1d2bacseo 832457Document3 pages1d2bacseo 832457Amadou Makhtar SeckPas encore d'évaluation
- 1cm42j5r6 687435Document1 page1cm42j5r6 687435Amadou Makhtar SeckPas encore d'évaluation
- 1ctgpevpr 400665Document3 pages1ctgpevpr 400665Amadou Makhtar SeckPas encore d'évaluation
- D3 1S2 2020 Lep Wahab DiopDocument2 pagesD3 1S2 2020 Lep Wahab DiopAmadou Makhtar Seck100% (1)
- Composition Harmonisees Du 1er Semestre SVT 1ere S2 2020-2021 SenegalDocument3 pagesComposition Harmonisees Du 1er Semestre SVT 1ere S2 2020-2021 SenegalAmadou Makhtar Seck100% (2)
- Composition 1ere s2 RufisqueDocument3 pagesComposition 1ere s2 RufisqueAmadou Makhtar Seck100% (1)
- 1cm43csiv 548753Document2 pages1cm43csiv 548753Amadou Makhtar SeckPas encore d'évaluation
- D2 1S1 2021 LSLL WahabDiopDocument2 pagesD2 1S1 2021 LSLL WahabDiopAmadou Makhtar SeckPas encore d'évaluation
- 1cm432qpr 28112Document2 pages1cm432qpr 28112Amadou Makhtar SeckPas encore d'évaluation
- D1 1S2 2019 LSLL Wahab-DiopDocument2 pagesD1 1S2 2019 LSLL Wahab-DiopAmadou Makhtar Seck100% (1)
- Evaluation Standadissees 1er Semestre SVT 1ere S2 2020-2021 SenegalDocument3 pagesEvaluation Standadissees 1er Semestre SVT 1ere S2 2020-2021 SenegalAmadou Makhtar Seck100% (3)
- 1cm4262io 569649Document1 page1cm4262io 569649Amadou Makhtar SeckPas encore d'évaluation
- 1cm4262ir 903092Document2 pages1cm4262ir 903092Ibrahima DioufPas encore d'évaluation
- 2 Devoir 2 Premiere 2016 2017Document2 pages2 Devoir 2 Premiere 2016 2017Amadou Makhtar SeckPas encore d'évaluation
- 07 Nait MerzougDocument6 pages07 Nait MerzougBouchra BkhtmPas encore d'évaluation
- Cours 4 (Pr. DIAM)Document6 pagesCours 4 (Pr. DIAM)bidaouimounirPas encore d'évaluation
- Chimie Analytique Acides BasesDocument19 pagesChimie Analytique Acides Basesawara237Pas encore d'évaluation
- Chapitre 8Document41 pagesChapitre 8Gabriel Lapointe-GuayPas encore d'évaluation
- Physique Des Matériaux - 2014-1 PDFDocument59 pagesPhysique Des Matériaux - 2014-1 PDFالفتى الخجولPas encore d'évaluation
- TD Chimie 2 Mpi 21-22Document5 pagesTD Chimie 2 Mpi 21-22Traoré Inoussa100% (2)
- L'Actualité Pétrolière: Huiles Shell Omala HDDocument2 pagesL'Actualité Pétrolière: Huiles Shell Omala HDLadhari AliPas encore d'évaluation
- Manuel Technique - Rmu7..b Manuel TechniqueDocument312 pagesManuel Technique - Rmu7..b Manuel TechniqueAbdou DEPas encore d'évaluation
- Detail Crude Oil AnalysisDocument15 pagesDetail Crude Oil AnalysisMinhquang NgoPas encore d'évaluation
- Electrochimie de Corrosion (Raffinage)Document62 pagesElectrochimie de Corrosion (Raffinage)Mima TopPas encore d'évaluation
- TD Structure de LewisDocument9 pagesTD Structure de LewisMourad RabahPas encore d'évaluation
- Documento Senza Titolo-2Document7 pagesDocumento Senza Titolo-2sfvsfvPas encore d'évaluation
- Exercice 2Document2 pagesExercice 2Dom domPas encore d'évaluation
- Synthèse D'un Complexe de Chrome (III)Document5 pagesSynthèse D'un Complexe de Chrome (III)Amandine DejeanPas encore d'évaluation
- Cor13 4Document2 pagesCor13 4El Mounchit AyoubPas encore d'évaluation
- TP Chimie N°04Document3 pagesTP Chimie N°04farid nanoPas encore d'évaluation
- La Geometrie de Quelques Molecules Cours 1 1Document4 pagesLa Geometrie de Quelques Molecules Cours 1 1zakariae100% (1)
- Reactivite Chimie 1 TDDocument48 pagesReactivite Chimie 1 TDOlaya ELPas encore d'évaluation
- Résume ThermoDocument9 pagesRésume Thermotaki djPas encore d'évaluation
- M2moire FinDocument98 pagesM2moire FinBelkacem BouzidiPas encore d'évaluation
- EstérificationDocument14 pagesEstérificationFrederic WustPas encore d'évaluation
- SUPP CH I Machines Thermiques ThermodynamiqueDocument4 pagesSUPP CH I Machines Thermiques ThermodynamiqueSavana BellaPas encore d'évaluation
- Isomerization of N-Hexane 2004Document6 pagesIsomerization of N-Hexane 2004Mohammed SahnounePas encore d'évaluation
- Oxy Do ReductionDocument35 pagesOxy Do ReductionMoustapha SallPas encore d'évaluation
- Thermochimie SMPC - TDDocument26 pagesThermochimie SMPC - TDoulaidPas encore d'évaluation
- Oxydo-Reduction: ManganmétrieDocument8 pagesOxydo-Reduction: ManganmétrieBsissaSoltaniPas encore d'évaluation
- TD 42023Document3 pagesTD 42023brvhyymPas encore d'évaluation
- Les États de La Matière (Unité 2)Document36 pagesLes États de La Matière (Unité 2)Dde DjdPas encore d'évaluation
- Plan ProvisoireDocument11 pagesPlan Provisoirecharte nyembaPas encore d'évaluation
- 56af9da0ef699 1Document25 pages56af9da0ef699 1Aristide MfifenPas encore d'évaluation