Académique Documents
Professionnel Documents
Culture Documents
Chimie Cap 9 Et 10
Transféré par
Luisa Macias0 évaluation0% ont trouvé ce document utile (0 vote)
5 vues2 pagesSchema de lewis
Titre original
chimie cap 9 et 10
Copyright
© © All Rights Reserved
Formats disponibles
ODT, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentSchema de lewis
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme ODT, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
5 vues2 pagesChimie Cap 9 Et 10
Transféré par
Luisa MaciasSchema de lewis
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme ODT, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
CHAPITRE 9
: DE LA STRUCTURE À LA POLARITÉ D’UNE ENTITÉ
1- Les règles de stabilité
La position d’un élément dans la tables périodique= valence de ses atomes (1s22s22p63s23p6)
Gazes nobles couche externe saturée donc 8 électrons de valence (2 pour Hélium) = stabilité
Pour faire pareil et être stables, les atomes perdent/gagnent des e- ou s’associent entre eux et
forment liaisons de valence et deviennent des ions ou molécules
2- Le schéma de Lewis
→modèle qui rend compte de la stabilisation des atomes dans une entité par rapport à ses atomes
isolés
2 types de doublets modélisés dans le schéma :
Liants Non Liants
Ils sont situés autour de l’atome et doivent vérifier les
règles de stabilité : ils sont entourés de 8 électrons ( 4
doublets ) ou de 2 électrons (1 doublet)
Attention ! exceptions… « acides de Lewis » c-à-d qu’il
y a une lacune électronique (ne respecte pas les règles de stabilité). Il y a un déficit de deux
électrons par rapport aux gaz nobles. Noté :
3- La géométrie d’une entité
Dans une molécule ou ion polyatomique les doublets exercent des forces électrostatiques
répulsives les uns sur les autres. Ils se disposent dans l’espace autour pour minimiser cette répulsion
4- Le caractère polaire ou apolaire d’une molécule
1. Électronégativité d’un atome
L'électronégativité d'un atome augmente de gauche à droite dans une ligne et de bas en haut dans
une colonne du tableau periodique
2. Liaison polarisée ?
Si X(A) – X(B) ≥ 0,5 ( el que tenga más alors :δ-)
3. Molécule polaire ?
- Au moins une liaison polaire
- Son centre est pas le même que celui des charges – ou +
CHAPITRE 10 : STRUCTURE MICROSCOPIQUE ET PROPRIÉTÉS
MACROSCOPIQUES DE LA MATIÈRE
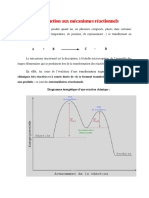
1- La cohésion dans un solide
Vous aimerez peut-être aussi
- Introduction à la physique nucléaire et des particulesD'EverandIntroduction à la physique nucléaire et des particulesPas encore d'évaluation
- BTS CPI 1 CH 2 Edifices Moléculaires Et IoniquesDocument5 pagesBTS CPI 1 CH 2 Edifices Moléculaires Et IoniquesLucas Filipuzzi100% (4)
- 5 Chapitre V Les Liaisons Chimiques CompressedDocument17 pages5 Chapitre V Les Liaisons Chimiques CompressedAnas KhaldiPas encore d'évaluation
- Fermions: Les Grands Articles d'UniversalisD'EverandFermions: Les Grands Articles d'UniversalisPas encore d'évaluation
- Cours de Liaison Chimique NewDocument45 pagesCours de Liaison Chimique NewJean Emmanuel BlehouePas encore d'évaluation
- C5 Structures Et Polarités EleveDocument6 pagesC5 Structures Et Polarités ElevefabiosaturnePas encore d'évaluation
- Chapitre 4 Cortã Ge électronique Dune Entitã© ChimiqueDocument7 pagesChapitre 4 Cortã Ge électronique Dune Entitã© Chimiqueblilyesse444Pas encore d'évaluation
- Chapitre I Différents Types de Liaisons L1BG1Document26 pagesChapitre I Différents Types de Liaisons L1BG1Haroun MohammedPas encore d'évaluation
- Liaisons Chimiques - DR COMBEREDocument53 pagesLiaisons Chimiques - DR COMBEREPatrickPas encore d'évaluation
- 00 C6 COURS - de La Structure À La Polarité D'une Entité ChimiqueDocument4 pages00 C6 COURS - de La Structure À La Polarité D'une Entité Chimiquecalvintalaron9Pas encore d'évaluation
- Base Théorique LewisDocument3 pagesBase Théorique LewisbalemoniPas encore d'évaluation
- TD Schéma de Lewis Et Géométrie Des Molécules Et Des IonsDocument5 pagesTD Schéma de Lewis Et Géométrie Des Molécules Et Des IonsElouan Berthome LavignottePas encore d'évaluation
- Liaisons Chimiques Partie 1 095738Document57 pagesLiaisons Chimiques Partie 1 095738yambazouberoulompoPas encore d'évaluation
- Chap7 Proprietes Cohesion Matiere ProfDocument8 pagesChap7 Proprietes Cohesion Matiere Profisra chorribaPas encore d'évaluation
- Chm161 Chapitre 1 KodomDocument14 pagesChm161 Chapitre 1 KodomstanPas encore d'évaluation
- Cours de Liaison Chimique NewDocument47 pagesCours de Liaison Chimique Newwww.doukoureabdoulaye1Pas encore d'évaluation
- Chapitre 2Document12 pagesChapitre 2hamza AnaPas encore d'évaluation
- Cours Réactions ChimiquesDocument19 pagesCours Réactions ChimiquesSamuel BaneckPas encore d'évaluation
- Chimie 05-09-2020Document9 pagesChimie 05-09-2020Alex WeshPas encore d'évaluation
- Chap.9 SynthèseDocument1 pageChap.9 Synthèselerpods13Pas encore d'évaluation
- Structure Des Materiaux - Cours 2Document30 pagesStructure Des Materiaux - Cours 2Aug Nels Mathieu AnvouliPas encore d'évaluation
- Chapitre VIDocument79 pagesChapitre VIYouCeF MouiSsiPas encore d'évaluation
- Chapitre 2 Structure Des MatériauxDocument34 pagesChapitre 2 Structure Des Matériauxchaimax29100% (1)
- Chapitre 4Document16 pagesChapitre 4Chifae ZdPas encore d'évaluation
- Capture D'écran . 2023-10-20 À 15.05.31Document4 pagesCapture D'écran . 2023-10-20 À 15.05.31VOTIO TSAYO GUIOVANY JORDYPas encore d'évaluation
- Cours de Liaison Chimique EtudiantsDocument50 pagesCours de Liaison Chimique EtudiantsAnge PastoréPas encore d'évaluation
- Atomistique Exercices Corriges 06 - CompressedDocument4 pagesAtomistique Exercices Corriges 06 - CompressedJean SoroPas encore d'évaluation
- Chapitre 3 L - AtomeDocument47 pagesChapitre 3 L - AtomeLAYNA LAYNAPas encore d'évaluation
- CHM101 - Chapitre 5Document7 pagesCHM101 - Chapitre 5abdoul djalil soumanaPas encore d'évaluation
- Chapitre 8 LES LIAISONS CHIMIQUESDocument23 pagesChapitre 8 LES LIAISONS CHIMIQUESZinou BourbiaPas encore d'évaluation
- Support Cours Liaison Chimique S1 PR JENNAN 2023-2024Document37 pagesSupport Cours Liaison Chimique S1 PR JENNAN 2023-2024idmarwaa2Pas encore d'évaluation
- Partie 3Document27 pagesPartie 3ngm4tg2hgcPas encore d'évaluation
- 02.schema de LewisDocument4 pages02.schema de LewisadokflorentPas encore d'évaluation
- Chapitre 2Document16 pagesChapitre 2arnaud.michauxPas encore d'évaluation
- Chapitre5 1Document9 pagesChapitre5 1Karim Radi100% (1)
- Conf 2 de Mol Au VV 21Document83 pagesConf 2 de Mol Au VV 21Royal DvDPas encore d'évaluation
- Chapitre 3 L Atome Version EcriteDocument14 pagesChapitre 3 L Atome Version EcriteLAYNA LAYNAPas encore d'évaluation
- CHAPITRE 6 - Liaisons ChimiquesDocument21 pagesCHAPITRE 6 - Liaisons ChimiquesRAMDEPas encore d'évaluation
- Liaison Chimique Fiche CoursDocument4 pagesLiaison Chimique Fiche CoursHamala SidibePas encore d'évaluation
- Cours Chimie Generale Et Minerale PrepareeDocument150 pagesCours Chimie Generale Et Minerale Prepareejoel fleuristalPas encore d'évaluation
- Chap 1 Liaison Covalente - Théorie de LewisDocument68 pagesChap 1 Liaison Covalente - Théorie de Lewisyassineredone4Pas encore d'évaluation
- Structure Electronique Des MoleculesDocument36 pagesStructure Electronique Des MoleculesAlex N'zuePas encore d'évaluation
- ChapV AtomistiqueDocument13 pagesChapV AtomistiqueAbdessamad ErraouiPas encore d'évaluation
- 7a. Liaisons Chimiques Os 2023Document14 pages7a. Liaisons Chimiques Os 2023paulverbaerePas encore d'évaluation
- Cours IntroductionCHODocument15 pagesCours IntroductionCHOrima.lettreuchPas encore d'évaluation
- 6088P3-Cours LC 2020Document33 pages6088P3-Cours LC 2020Ilyas BoufrraPas encore d'évaluation
- Cours Cristallochimie SMP4Document114 pagesCours Cristallochimie SMP4Mhamed TouilPas encore d'évaluation
- Polycopie 4Document14 pagesPolycopie 4sihem ayadiPas encore d'évaluation
- Fichier Produit 2114Document52 pagesFichier Produit 2114FlorinaPas encore d'évaluation
- Chapitre 8Document15 pagesChapitre 8khalilkbdzPas encore d'évaluation
- Cours introductionCHODocument15 pagesCours introductionCHOrima.lettreuchPas encore d'évaluation
- 2 - La Liaison ChimiqueDocument6 pages2 - La Liaison ChimiquemuratPas encore d'évaluation
- Chapitre I CH3 (Liaison Chimique)Document15 pagesChapitre I CH3 (Liaison Chimique)Achwak BelfadelPas encore d'évaluation
- Activité 5 - Les MoléculesDocument2 pagesActivité 5 - Les MoléculesAndré MadeiraPas encore d'évaluation
- Laison Chimique TestDocument2 pagesLaison Chimique TestGOUAREF SAMIRPas encore d'évaluation
- Liaison Chimique 1Document2 pagesLiaison Chimique 1Mohamed TouahriPas encore d'évaluation
- 01 E1 Liaison Covalente GéométrieDocument16 pages01 E1 Liaison Covalente GéométrieberthouPas encore d'évaluation
- Chimie - Chapitre VDocument15 pagesChimie - Chapitre Vmahjoub lachgarPas encore d'évaluation
- Chapitre 2Document24 pagesChapitre 2FATMAPas encore d'évaluation
- Etat Et Structure Mat-CourDocument9 pagesEtat Et Structure Mat-CourkokouPas encore d'évaluation