Académique Documents
Professionnel Documents
Culture Documents
Liquide S+L Solide
Transféré par
soudjoud bensayahTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Liquide S+L Solide
Transféré par
soudjoud bensayahDroits d'auteur :
Formats disponibles
I.6.
L’équation de Clausius-Clapeyron
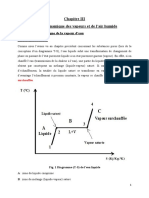
Les considérations suivantes sont valables pour l es équilibres (liquide -
vapeur), (solide -vapeur) et (solide -liquide) (Fig.VII.2).
Décrivons la variation de la pression (P) en fonction de la température
(T) pour un équilibre (liquide-vapeur) :
𝜕𝐺 𝜕𝐺
𝐺 𝑙 = 𝐺(𝑣) ⇒ 𝑑𝐺 𝑙 = 𝑑𝐺(𝑣) et 𝑑𝐺 = 𝜕𝑃 𝑇
𝑑𝑃 + 𝜕𝑇 𝑑𝑇 = 𝑉𝑑𝑃 − 𝑆𝑑𝑇
𝑃
𝑑𝑃 𝑆 𝑣 −𝑆(𝑙) 𝛥𝑆(𝑣𝑎𝑝𝑜𝑟𝑖𝑠𝑎𝑡𝑖𝑜𝑛 )
⇒ 𝑉(𝑙)𝑑𝑃 − 𝑆(𝑙)𝑑𝑇 = 𝑉(𝑣)𝑑𝑃 − 𝑆(𝑣)𝑑𝑇, d’où : = =
𝑑𝑇 𝑉 𝑣 −𝑉(𝑙) 𝛥𝑉(𝑣𝑎𝑝𝑜𝑟𝑖𝑠𝑎𝑡𝑖𝑜𝑛 )
𝛥𝐻(𝑣𝑎𝑝 )
, or on sait qu’à T= C t e : ∆𝑆 𝑣𝑎𝑝𝑜 = 𝑇
, en considérant la vap eur comme
un gaz parfait, et en négligeant le volume du liquide devant le volume de
la vapeur, on tire la relation de Clausius-Clapeyron:
𝑑𝑃 ∆𝐻 𝑣𝑎𝑝 𝑃.∆𝐻 𝑣𝑎𝑝
= = (VII.7)
𝑑𝑇 𝑇.𝑉 𝑣 𝑛𝑅 𝑇 2
Liquide
S+L
Solide
Point triple
Vapeur
S+V L+V
Fig.VII.2 Diagramme d’état P=f(T) et point
triple
Remarques :
1/ Par intégration en supposant que : ( ∆𝐻 𝑣𝑎𝑝 ≈ 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 ) pour un
domaine restreint de température, on trouve l’équation de Rankine :
∆𝐻 𝑣𝑎𝑝 𝑡𝑒
𝑙𝑛𝑃 = − 𝑛𝑅𝑇 + 𝐶 (VII.8)
2/ Si la température varie, alors ∆𝐻 𝑣𝑎𝑝 Varie selon la loi de KIRCHHOFF
déjà vue (équation (II.2)):
𝑇
∆𝐻 𝑣𝑎𝑝 à 𝑇 = ∆𝐻 𝑣𝑎𝑝 à 𝑇° + 𝑇°
𝑛(𝐶𝑝(𝑣) − 𝐶𝑝(𝑙) ) 𝑑𝑇
On aura la formule générale un peu complexe :
𝑃 ∆𝐻 𝑣𝑎𝑝 à 𝑇 (𝑇2 −𝑇1 ) 1 𝑇 1 𝑇
𝑙𝑛 𝑃2 = − °
𝑛𝑅𝑇2 𝑇1
+ 𝑅 𝑇12 𝑇 2 𝑇°
𝑛(𝐶𝑝(𝑣) − 𝐶𝑝(𝑙) ) 𝑑𝑇 𝑑𝑇 (VII.9)
1
3/ Pour une transformation (liquide -vapeur) ou (solide-vapeur) à
différentes pressions et températures, et si ( ∆𝐻 𝑣𝑎𝑝 ≈ 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 ), on a :
𝑃 ∆𝐻 𝑣𝑎𝑝 1 1
𝑙𝑛 𝑃2 = − 𝑛𝑅 𝑇2
−𝑇 (VII.10)
1 1
4/ Pour les liquides non polaires, ∆𝐻 𝑣𝑎𝑝 est obtenue approximativement
par la règle empirique de TROUTON :
∆𝐻 𝑣𝑎𝑝 𝐽
≈ 92 ( ) (VII.11)
𝑇 𝑚𝑜𝑙 .𝐾
5/ Si la température (T) est très loin de la température critique (T c ),
Dupré a proposé une relation empirique en se basant sur la relation affine
de l’enthalpie de vaporisation qui peut s’écrire : ∆𝐻 𝑣𝑎𝑝 = 𝑎 − 𝑏𝑇
𝑅𝑇 2 𝑑𝑃 𝑑𝑃 𝑀
(Fig.VII.3), et puisque : ∆𝐻 𝑣𝑎𝑝 = 𝑀.𝑃 𝑑𝑇 , d’où l’on tire : 𝑃
= 𝑅𝑇 2 𝑎 − 𝑏𝑇 𝑑𝑇
d’où par intégration on trouve :
𝑎𝑀 𝑏𝑀
𝑙𝑛𝑃 = − − 𝑙𝑛𝑇 + 𝐶 𝑡𝑒 (VII.12)
𝑅𝑇 𝑅
6/ DUPPERAY a proposé une formule empirique pour le calcul de la
pression de vapeur saturante pour l’eau entre 100°C et 200°C :
𝑡 4
𝑃𝑠 = (VII.13)
100
Avec : P s en (atm) et la température : t en (°C).
7/ Joseph Bertrand a aussi proposé une autre équation pour le calcul de la
pression de vapeur saturante de l’eau :
2
𝑃𝑠 = 760 + 27,13 𝑡 − 100 + 0,4 𝑡 − 100 (VII.14)
Avec : P s en (mm Hg) et t en (°C).
I.7. Variation de ∆𝑯 𝒗𝒂𝒑 en fonction de la température
D’après la courbe du diagramme d’état P=f T Fig.VII.2 , et d’après la
𝑑𝑃
relation de ∆𝐻 𝑣𝑎𝑝 avec ( 𝑑𝑇 , on peut dire que tan que l’équilibre liquide -
𝑑𝑃
vapeur) existe, 𝑑𝑇
≠ 0, mais quand 𝑇 → 𝑇𝑐 on a : 𝑉𝑙 → 𝑉𝑣 ⇒ ∆𝐻 𝑣𝑎𝑝 → 0.
L’expérience montre que la courbe : ∆𝐻 𝑣𝑎𝑝 = 𝑓 𝑇 a une allure représentée
par la figure (Fig.VII.3).
Le domaine où la variation de l’enthalpie de vaporisation en fonction de la
température est linéaire, correspond à la formule proposée par Dup ré
∆𝐻 𝑣𝑎𝑝 = 𝑎 − 𝑏𝑇 (Voir remarques précédentes : n°5).
∆𝑯𝒗
(∆𝑯𝒗 = 𝒂 − 𝒃𝑻)
𝑻𝑪
Fig.VII.3 Variation de (∆𝑯𝒗 ) en fonction de la
température
Vous aimerez peut-être aussi
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Ayyoub DAHBIPas encore d'évaluation
- Cours 1&2 Reseaux MobilesDocument97 pagesCours 1&2 Reseaux MobilesRwayda Nadim100% (1)
- ! Exercices - Logique-CombinatoireDocument10 pages! Exercices - Logique-CombinatoireTimo Shmitt100% (1)
- La CristallographieDocument22 pagesLa Cristallographiemilk198582% (11)
- Climatisation PassiveDocument30 pagesClimatisation PassiveAhmad ElhamriPas encore d'évaluation
- Cherif AhmedDocument5 pagesCherif AhmedMed Val ABPas encore d'évaluation
- Mutagénèse 2020Document24 pagesMutagénèse 2020assiPas encore d'évaluation
- cours-2èmeLMD-Thermo-chim-3ème SemaineDocument3 pagescours-2èmeLMD-Thermo-chim-3ème SemaineWaliD MerabeTPas encore d'évaluation
- Thermo - Chapitre V-L2 GM - FT - UambDocument28 pagesThermo - Chapitre V-L2 GM - FT - UambMathilde MimiPas encore d'évaluation
- Exercice 1:: Tapez Une Équation IciDocument8 pagesExercice 1:: Tapez Une Équation IcizeblaouarPas encore d'évaluation
- Chap II Aspect Cinétique de La ThermodynamiqueDocument21 pagesChap II Aspect Cinétique de La ThermodynamiqueJean Marc LengePas encore d'évaluation
- TD, GP, L2, Thermodinamique Chimique, Thermodynamique Des Substances Pures - TextMarkDocument5 pagesTD, GP, L2, Thermodinamique Chimique, Thermodynamique Des Substances Pures - TextMarkMä NëlPas encore d'évaluation
- MecaFluChap34 CorrDocument6 pagesMecaFluChap34 CorrChristian AmadouPas encore d'évaluation
- Doc. 4Document5 pagesDoc. 4Adje Kponon-eklouPas encore d'évaluation
- Examen S4 Juin 2019 - SolutionDocument6 pagesExamen S4 Juin 2019 - SolutionMalki imanePas encore d'évaluation
- Premier Principe de La ThermodynamiqueDocument9 pagesPremier Principe de La ThermodynamiqueCRYPTEXPas encore d'évaluation
- Cours PHY 302 2Document13 pagesCours PHY 302 2S.Théophile KOURAPas encore d'évaluation
- BoussinesqDocument17 pagesBoussinesqhassanPas encore d'évaluation
- TP Tmi Gaz ParfaitDocument8 pagesTP Tmi Gaz ParfaitImen NaijaPas encore d'évaluation
- TP Equation de Bernoulli - UMBB STHDocument25 pagesTP Equation de Bernoulli - UMBB STHmourad100% (1)
- Cours Chimie Chap III Principe2 ThermodynamiqueDocument5 pagesCours Chimie Chap III Principe2 ThermodynamiqueDoudou AminePas encore d'évaluation
- Série3 Thermodynamique 2022Document3 pagesSérie3 Thermodynamique 2022Ramatoulaye CAMARAPas encore d'évaluation
- UNB MPI TD Thermodynamique 2023Document4 pagesUNB MPI TD Thermodynamique 2023Traoré InoussaPas encore d'évaluation
- Chapitre 10 Equilibre Liquide - VapeurDocument28 pagesChapitre 10 Equilibre Liquide - VapeurNd'a Evrard KonanPas encore d'évaluation
- Resume (2) ThermodynamiqueDocument13 pagesResume (2) ThermodynamiqueVas poPas encore d'évaluation
- Examen Final 2021Document2 pagesExamen Final 2021Serigne Saliou SyllaPas encore d'évaluation
- Les CompresseursDocument4 pagesLes CompresseursZaziPas encore d'évaluation
- CHAPITRE II Particule Dans Un Champ ElectromagnetiqueDocument31 pagesCHAPITRE II Particule Dans Un Champ ElectromagnetiqueM'pounguiPas encore d'évaluation
- Thermodynamique Partie II VF PDFDocument53 pagesThermodynamique Partie II VF PDFmezzi houssemPas encore d'évaluation
- Corrigé TD 3 MarakechDocument5 pagesCorrigé TD 3 MarakechIsmail SalamaPas encore d'évaluation
- Production Denergie Electrique - Chapitre III - DjerradaDocument18 pagesProduction Denergie Electrique - Chapitre III - DjerradaMouhand AoudjitPas encore d'évaluation
- Bibliographie DistllationDocument12 pagesBibliographie DistllationBrave ZinebPas encore d'évaluation
- TD Froid Exercice D'applicationDocument4 pagesTD Froid Exercice D'applicationRachid BouchenafaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Assia AssiaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Linda KoundziPas encore d'évaluation
- R Sum de Cours Thermodynamque 1Document2 pagesR Sum de Cours Thermodynamque 1EliasPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Assia AssiaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4chakib abPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4medPas encore d'évaluation
- ResumeThermodynamique 4 PDFDocument2 pagesResumeThermodynamique 4 PDFSaihi OussemaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4SirineJamoussiPas encore d'évaluation
- Résumé Thermodynamiquel1Document2 pagesRésumé Thermodynamiquel1Teddy RavatsyPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Assia AssiaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Güneş PrįnPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4BeQio100% (1)
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Youssef BouazzaouiPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Coulibaly DavidPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Assia AssiaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Assia AssiaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4anas100% (1)
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4BensabeurPas encore d'évaluation
- ResumeThermodynamique 4 PDFDocument2 pagesResumeThermodynamique 4 PDFSaihi OussemaPas encore d'évaluation
- ResumeThermodynamique 4Document2 pagesResumeThermodynamique 4Youssef FaradiPas encore d'évaluation
- Pression de Vapeur Saturante: Tracé Et Étude de La Courbe de Saturation.Document7 pagesPression de Vapeur Saturante: Tracé Et Étude de La Courbe de Saturation.kadirikakaPas encore d'évaluation
- Correction - Série 1 - Statique Des FluidesDocument8 pagesCorrection - Série 1 - Statique Des Fluidesasmaa jaPas encore d'évaluation
- Merged 20200621 174311Document41 pagesMerged 20200621 174311Ali FguiriPas encore d'évaluation
- Chapitre IDocument7 pagesChapitre IMa RwaPas encore d'évaluation
- Chapitre III Vapeur Deau Et Air Humide 2019Document10 pagesChapitre III Vapeur Deau Et Air Humide 2019mohamed ouled diafPas encore d'évaluation
- Corrigé Série 1 MDF1Document5 pagesCorrigé Série 1 MDF1mechemache abdeldjalilPas encore d'évaluation
- Chap I 01Document6 pagesChap I 01Chanbi ChanbiPas encore d'évaluation
- TP Perte de Charge Groupe 14 - 1Document20 pagesTP Perte de Charge Groupe 14 - 1BarryPas encore d'évaluation
- Correction Enonce 0002 v01Document3 pagesCorrection Enonce 0002 v01Gaël MOUKENGUEPas encore d'évaluation
- Chapitre IVet VDocument15 pagesChapitre IVet VÉtoile D'orPas encore d'évaluation
- Questions de Cours Master ME Ben M'sik-M1Document9 pagesQuestions de Cours Master ME Ben M'sik-M1Kha LidPas encore d'évaluation
- Exemple Compte Rendu - ThermoDocument40 pagesExemple Compte Rendu - ThermoMohamed AmanePas encore d'évaluation
- Chapitre 01 Demarche Scientifique Pour Aborder Les Problematiques Resume PPTDocument22 pagesChapitre 01 Demarche Scientifique Pour Aborder Les Problematiques Resume PPTAbdelghani TakaoutPas encore d'évaluation
- PalmerDocument6 pagesPalmerHamza BouabdallahPas encore d'évaluation
- SchemaDocument22 pagesSchemaLoïka Manuela DjomgouéPas encore d'évaluation
- Intro PythonDocument22 pagesIntro PythonHajji WissalPas encore d'évaluation
- Les Essais Du Puits Et Les Interprétations DesDocument137 pagesLes Essais Du Puits Et Les Interprétations DesLahcen SaidiPas encore d'évaluation
- TP2 ES Term Complexitã© Du Systã Me ClimatiqueDocument4 pagesTP2 ES Term Complexitã© Du Systã Me ClimatiqueIsmail KhoulidPas encore d'évaluation
- Exercices Corrigés - Les AnnuitésDocument4 pagesExercices Corrigés - Les Annuitésloubna.hoummani100% (1)
- Correction TD MaintenanceDocument5 pagesCorrection TD MaintenanceMohamed OuladPas encore d'évaluation
- MMA 2010 Solution VL F PDFDocument26 pagesMMA 2010 Solution VL F PDFOualid50% (2)
- Partie A: Evaluation Des Ressources 24 PointsDocument2 pagesPartie A: Evaluation Des Ressources 24 PointsNarcisse DziekamPas encore d'évaluation
- Rapport2 G1A T2Document9 pagesRapport2 G1A T2AHMED LEBBARPas encore d'évaluation
- FIltrage Numerique RII Et RIFDocument27 pagesFIltrage Numerique RII Et RIFG POWERPas encore d'évaluation
- Les Relativites Espace-Temps-Gravitation !!!Document22 pagesLes Relativites Espace-Temps-Gravitation !!!Samiro TatbetPas encore d'évaluation
- 1 Iwcf Introduction Iap2023Document24 pages1 Iwcf Introduction Iap2023Tou NechPas encore d'évaluation
- Série Exercices-PMM 2021Document5 pagesSérie Exercices-PMM 2021Hicham RouidjiPas encore d'évaluation
- TP N°1Document6 pagesTP N°1home bonePas encore d'évaluation
- Cours Éléctronique AnalogiqueDocument134 pagesCours Éléctronique AnalogiqueDhahri Yadhahri100% (1)
- Le MEDAFDocument6 pagesLe MEDAFmsidoPas encore d'évaluation
- Communications Num Eriques Travaux Pratiques (15 H) Mod Elisation Et Etude D'une Cha Ine de Communication Num EriqueDocument11 pagesCommunications Num Eriques Travaux Pratiques (15 H) Mod Elisation Et Etude D'une Cha Ine de Communication Num EriqueYasser éducation scientifiquePas encore d'évaluation
- UML Correction 2Document2 pagesUML Correction 2nizarawiPas encore d'évaluation
- Chap I ConsommateurDocument63 pagesChap I ConsommateurÀbdèrràhim AboussemdaiPas encore d'évaluation
- Chapitre 1 Ensembles Et ApplicationsDocument13 pagesChapitre 1 Ensembles Et ApplicationsColmain NassiriPas encore d'évaluation
- Ladjouzi SamiaDocument108 pagesLadjouzi SamiaBoucif Nihal AminaPas encore d'évaluation
- Travail Et Energie Cinetique Cours 2Document9 pagesTravail Et Energie Cinetique Cours 2Smove Oner100% (1)