Académique Documents
Professionnel Documents
Culture Documents
DM nc2b02 de Thermo Stat
Transféré par
AdamTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
DM nc2b02 de Thermo Stat
Transféré par
AdamDroits d'auteur :
Formats disponibles
MP-Spé Thermodynamique 2019-2020
Devoir Maison n◦2 : Capacités thermiques
1. Rappeler la définition thermodynamique de la capacité thermique à volume constant. Donner alors la définition de la
capacité thermique à pression constante. Retrouver la relation liant ces deux grandeurs valable pour les gaz parfaits.
(a) En physique statistique, rappeler le théorème
d’équipartition de l’énergie.
(b) Utiliser ce théorème pour trouver la capacité
thermique à volume constant d’un gaz parfait
monoatomique contenant N molécules.
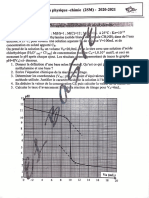
(c) Pour un gaz parfait diatomique, on a représenté
la capacité thermique à volume constant molaire
(divisée par la constante des gaz parfaits R) en
fonction de la température :
(d) Compléter le graphe pour des basses
températures. Interpréter le graphe en lien
avec le théorème d’équipartition de l’énergie.
2. Utiliser toujours le théorème d’équipartition de l’énergie pour déterminer la capacité thermique à température ambiante
d’un solide constitué de N atomes. Comment s’appelle cette loi ?
3. On considère un système de N particules à deux niveaux d’énergie ±E à la température T obéissant à la statistique
de Boltzmann.
(a) Donner un exemple de situation physique où on rencontre ce type de configuration.
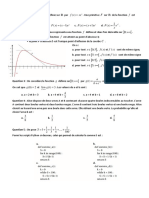
(b) Donner la probabilité qu’un particule soit dans le niveau d’énergie +E.
(c) Déterminer l’énergie moyenne du système de N particules. Tracer l’allure de son évolution avec la température et
interpréter physiquement.
(d) Déterminer la capacité thermique à volume constant de ce système. Tracer l’allure de son évolution avec la
température.
(e) Calculer la variance ∆E 2 de ce système et donner la relation liant cette grandeur avec la capacité thermique à
volume constant. Quel théorème retrouve-t-on ?
4. Afin de pouvoir évaluer précisément la capacité thermique d’un solide, on utilise le modèle unidimensionnel d’Einstein
de 1907. Chaque atome de masse m est considéré comme un oscillateur harmonique au sens quantique à une dimension.
}ω
Les niveaux d’énergie d’un tel système sont quantifiés εn = (n + 1/2)}ω.On pose u =
kT
(a) Pour un solide en équilibre avec un thermostat de température T , exprimer la probabilité pn (u) qu’un atome soit
dans l’état indicé par n.
}ω }ω
(b) Montrer que l’énergie moyenne ε(T ) d’un atome vaut : ε(T ) = coth( )
2 2kT
P 1
On donne : n=0 nexp(−αn) = α pour α > 0.
2
4sh ( )
2
1
(c) En déduire la capacité thermique moalaire du solide.On rappelle que coth0 (x) = − 2
sh x
(d) Quelle est la limite à haute température ? Quelle loi retrouve-t-on ?
(e) Tracer l’allure de la capacité thermique molaire du solide.
http://prepanouar.wordpress.com 1/1 Durée : 2 heure
Vous aimerez peut-être aussi
- Équations différentielles: Les Grands Articles d'UniversalisD'EverandÉquations différentielles: Les Grands Articles d'UniversalisPas encore d'évaluation
- Analyse FonctionnelleDocument32 pagesAnalyse Fonctionnellesouhail100% (3)
- Tuyauteries. Re - Sistance Des E - Le - Ments - 1re Partie - ARTICLEDocument30 pagesTuyauteries. Re - Sistance Des E - Le - Ments - 1re Partie - ARTICLEelmandoubPas encore d'évaluation
- Note de Calcul Support Tuyautrie ExecutionDocument12 pagesNote de Calcul Support Tuyautrie ExecutionMed Samai100% (2)
- Traitement Et Épuration de Leau L3 HydDocument370 pagesTraitement Et Épuration de Leau L3 HydSidahmed Ramzi100% (4)
- Pages de Bac Blanc 2Document5 pagesPages de Bac Blanc 2Khaouda Driss100% (1)
- La Verrerie Du LaboratoireDocument16 pagesLa Verrerie Du Laboratoiredz girlPas encore d'évaluation
- DC2 (26 01 08)Document5 pagesDC2 (26 01 08)Seif Souid100% (4)
- Devoir 13 12Document7 pagesDevoir 13 12Mohamed GarmoumPas encore d'évaluation
- PH402Document27 pagesPH402ALI DOCTAR MASSIBOUPas encore d'évaluation
- TD Thermo StatDocument5 pagesTD Thermo StatAdama KouraogoPas encore d'évaluation
- Module 6Document2 pagesModule 6Yvann ArutoPas encore d'évaluation
- Phy StatDocument7 pagesPhy StatDaoud El CaidPas encore d'évaluation
- 43.. Dvs1 Revision Math Et Sciences 2019 Ka Me DDocument5 pages43.. Dvs1 Revision Math Et Sciences 2019 Ka Me DYassine RiahiPas encore d'évaluation
- td3 PDFDocument3 pagestd3 PDFazzamPas encore d'évaluation
- TDDocument3 pagesTDazzamPas encore d'évaluation
- TD de Physique Statistique Série N°2: Universite Abdelmalek Essaadi Année 17-18 Faculte Des Sciences Smp5 TetouanDocument2 pagesTD de Physique Statistique Série N°2: Universite Abdelmalek Essaadi Année 17-18 Faculte Des Sciences Smp5 TetouanYassine EL FAKHAOUIPas encore d'évaluation
- Stat Partiel1408 MastripDocument3 pagesStat Partiel1408 Mastripmame gor fayePas encore d'évaluation
- Concours Commun Marocain Session: 1997 MP Épreuve de Physique I Durée: 4 HDocument3 pagesConcours Commun Marocain Session: 1997 MP Épreuve de Physique I Durée: 4 HZakariaPas encore d'évaluation
- TD Transfert de Chaleur Et de Masse ApprofondiDocument6 pagesTD Transfert de Chaleur Et de Masse ApprofondiHamza ZitouniPas encore d'évaluation
- ds1 2013 PDFDocument5 pagesds1 2013 PDFMustapha ElhafiPas encore d'évaluation
- Ecoulement CompressibleDocument9 pagesEcoulement Compressibledj.amin07Pas encore d'évaluation
- Travaux Dirig Esn 1 Introduction ' Alam Ecanique Quantique: L2-Mia-Pc Exercice 1Document4 pagesTravaux Dirig Esn 1 Introduction ' Alam Ecanique Quantique: L2-Mia-Pc Exercice 1Ismaël TchagnaniPas encore d'évaluation
- E ph2mp2021Document8 pagesE ph2mp2021Siham JiwooPas encore d'évaluation
- Cours - Physique DEVOIR CONTROLE N°2 - Bac Sciences Exp (2012-2013) MR TLILI TOUHAMIDocument3 pagesCours - Physique DEVOIR CONTROLE N°2 - Bac Sciences Exp (2012-2013) MR TLILI TOUHAMIMohamed HamdenePas encore d'évaluation
- Yech BahDocument29 pagesYech BaholfaPas encore d'évaluation
- Serie 11Document1 pageSerie 11SawadogoPas encore d'évaluation
- Partiel Phys Stat 2011Document4 pagesPartiel Phys Stat 2011Andrew BenPas encore d'évaluation
- 23_mp_sujet_phyDocument6 pages23_mp_sujet_phykoitaabdoulaye12.maPas encore d'évaluation
- EMD1Document6 pagesEMD1Amada TarekPas encore d'évaluation
- C46Document6 pagesC46Samir TouiliPas encore d'évaluation
- Partiel Phys Stat 2010Document2 pagesPartiel Phys Stat 2010mariem OuriPas encore d'évaluation
- TD T1: Du Gaz Parfait Aux Gaz RéelsDocument6 pagesTD T1: Du Gaz Parfait Aux Gaz RéelsBen Mrad HaithamPas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR Abdmouleh Nabil PDFDocument4 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Sciences Exp (2016-2017) MR Abdmouleh Nabil PDFMohamed Saidi100% (1)
- TDThermo 5Document5 pagesTDThermo 5Ihsan MokhlissePas encore d'évaluation
- Ds 6Document4 pagesDs 6Subhane JohnPas encore d'évaluation
- TP Master Ma 21-22 S2Document47 pagesTP Master Ma 21-22 S2Ayoub BPas encore d'évaluation
- Thermodynamique Statistique 2022 IPEIN SeriesDocument4 pagesThermodynamique Statistique 2022 IPEIN SeriesGhada BousselmiPas encore d'évaluation
- Sujet Physiq IG2006Document2 pagesSujet Physiq IG2006Atou RamPas encore d'évaluation
- Série TD 1Document6 pagesSérie TD 1Manuel ArzolaPas encore d'évaluation
- LC202 Devoir2 10-11Document4 pagesLC202 Devoir2 10-11Lo MomathPas encore d'évaluation
- Corrige Devoir 12Document7 pagesCorrige Devoir 12Yassir Sadiq ElfilaliPas encore d'évaluation
- TD3 Marrakech PDFDocument3 pagesTD3 Marrakech PDFJenina Manks100% (1)
- DS 8Document4 pagesDS 8Houssam BenkerroumPas encore d'évaluation
- Dev 1Document3 pagesDev 1Jeremie BoudreaultPas encore d'évaluation
- Problème 1 Thermodynamique MP (1)Document3 pagesProblème 1 Thermodynamique MP (1)elhaffarisoumia123Pas encore d'évaluation
- TD1 PH Materiaux2 P3-24Document2 pagesTD1 PH Materiaux2 P3-24fredericcoutignoPas encore d'évaluation
- Rattapage Electrocinetique 2020Document2 pagesRattapage Electrocinetique 2020Farida LimaPas encore d'évaluation
- TD ThermiqueDocument4 pagesTD Thermiqueahmed kitariPas encore d'évaluation
- DM5 Thermo+electrocinétique PDFDocument6 pagesDM5 Thermo+electrocinétique PDFAnis SouissiPas encore d'évaluation
- Chauffage Par Micro-OndesDocument5 pagesChauffage Par Micro-OndesBacem KakaPas encore d'évaluation
- Devoir Syn N - 1 4éme SCDocument4 pagesDevoir Syn N - 1 4éme SChamziPas encore d'évaluation
- Module 10Document3 pagesModule 10Yvann ArutoPas encore d'évaluation
- Exc Prem PrincipeDocument6 pagesExc Prem PrincipeRommel NguyenPas encore d'évaluation
- Null 8Document6 pagesNull 8Fati FleurPas encore d'évaluation
- TherDocument9 pagesTherSaliou SENEPas encore d'évaluation
- Thermo Chap3 SystA Mes OuvertsDocument14 pagesThermo Chap3 SystA Mes OuvertsLouise TehaniPas encore d'évaluation
- TD1: Systèmes Thermodynamiques: Exercice 1Document2 pagesTD1: Systèmes Thermodynamiques: Exercice 1YURI 3.14Pas encore d'évaluation
- P1MP22é PDFDocument6 pagesP1MP22é PDFahmed aboulkacemPas encore d'évaluation
- DM nc2b05 de Thermo Stat 1Document4 pagesDM nc2b05 de Thermo Stat 1AdamPas encore d'évaluation
- ctr1 2018Document2 pagesctr1 2018azzamPas encore d'évaluation
- Devoir de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2012-2013) MR Mohsen Ben Lamine 2Document5 pagesDevoir de Synthèse N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2012-2013) MR Mohsen Ben Lamine 2Zeineb BoulabiarPas encore d'évaluation
- TD1 ThermoDocument6 pagesTD1 ThermoLodvert T. POATYPas encore d'évaluation
- DM nc2b05 de Thermo Stat 1Document4 pagesDM nc2b05 de Thermo Stat 1AdamPas encore d'évaluation
- CNC 2000 MP Physique 2Document10 pagesCNC 2000 MP Physique 2Abderrahman SrailPas encore d'évaluation
- These: Présentée Pour L'obtention Du Grade de Docteur en SciencesDocument157 pagesThese: Présentée Pour L'obtention Du Grade de Docteur en SciencesAdamPas encore d'évaluation
- Un Corrigé-1Document10 pagesUn Corrigé-1AdamPas encore d'évaluation
- PDF Résumé - Géorgiques - VirgileDocument22 pagesPDF Résumé - Géorgiques - Virgileلا إلٰه إلّا اللهPas encore d'évaluation
- CNC MP Physique1 2013eDocument13 pagesCNC MP Physique1 2013eAbdellatif Elouarrate100% (1)
- AutomatiqueDocument52 pagesAutomatiqueAdamPas encore d'évaluation
- Jabri TradDocument1 pageJabri TradAdamPas encore d'évaluation
- Resume MecaniqueDocument6 pagesResume MecaniqueAdamPas encore d'évaluation
- Préparation Concours 2020 - Dynamique - PFD-TEC - Applications (LAAS9)Document12 pagesPréparation Concours 2020 - Dynamique - PFD-TEC - Applications (LAAS9)AdamPas encore d'évaluation
- Préparation Concours20 CinématiqueDocument7 pagesPréparation Concours20 CinématiqueAdamPas encore d'évaluation
- Révisions Et CinétiqueDocument47 pagesRévisions Et CinétiqueAdamPas encore d'évaluation
- Cours CH1 - Cinétique Des Systèmes MatérielsDocument15 pagesCours CH1 - Cinétique Des Systèmes MatérielsAdamPas encore d'évaluation
- Préparation Concours 2020 - Dynamique (PFD-TEC) - FormulaireDocument5 pagesPréparation Concours 2020 - Dynamique (PFD-TEC) - FormulaireAdamPas encore d'évaluation
- Physique Essentiel - Du.coursDocument74 pagesPhysique Essentiel - Du.coursED-DBIBI fatimaezzahraePas encore d'évaluation
- La Fabrication Des Composants en Verre OptiqueDocument4 pagesLa Fabrication Des Composants en Verre OptiquebouxPas encore d'évaluation
- Concours General 2017 PC-CDocument10 pagesConcours General 2017 PC-CEric LefrançaisPas encore d'évaluation
- Chapitre 2 CRMDocument15 pagesChapitre 2 CRMOussama AbirPas encore d'évaluation
- Chap C1 - Introduction Aux Nombres ComplexesDocument14 pagesChap C1 - Introduction Aux Nombres ComplexesjonathanbourlangesPas encore d'évaluation
- CH IIIDocument20 pagesCH IIIWissam TizaPas encore d'évaluation
- ELM Leblanc AxeliaDocument12 pagesELM Leblanc AxeliaWalid Aouini80% (5)
- Manuel Physique Chimie 2AC S2 FR)Document26 pagesManuel Physique Chimie 2AC S2 FR)Yassine AarabPas encore d'évaluation
- Cours de Mécanique - Exerci...Document4 pagesCours de Mécanique - Exerci...Parfait KoudjouPas encore d'évaluation
- Cours Sur L'asservissement de Ce SystemeDocument17 pagesCours Sur L'asservissement de Ce SystemedaudePas encore d'évaluation
- Cours 2022 Lmeca1855Document3 pagesCours 2022 Lmeca1855azfghyPas encore d'évaluation
- MESSAID BelkacemDocument263 pagesMESSAID BelkacemWalidBenHamidouche100% (1)
- Sujet Bac 23 Polynésie p3 49Document1 pageSujet Bac 23 Polynésie p3 49Shreck N'rollPas encore d'évaluation
- Familles Sommables-4Document16 pagesFamilles Sommables-4Sam ManiPas encore d'évaluation
- IssaadiThinhinene SaadMDocument67 pagesIssaadiThinhinene SaadMAymen BenguessoumPas encore d'évaluation
- CavitationDocument17 pagesCavitationDODOHICHAM50% (2)
- Travaux Diriges Sur Les Fonctions NumeriquesDocument2 pagesTravaux Diriges Sur Les Fonctions Numeriquesarmelo simbePas encore d'évaluation
- A Propos Des Groupes Algébriques Semi-SimplesDocument13 pagesA Propos Des Groupes Algébriques Semi-SimplesjeamichelPas encore d'évaluation
- ROLLON - R162281422 - Bosch RexrothDocument11 pagesROLLON - R162281422 - Bosch RexrothalessandroPas encore d'évaluation
- 6119 Enonce ScootelecDocument7 pages6119 Enonce Scooteleckamal100% (1)
- Moulay Ismail 2 PDFDocument4 pagesMoulay Ismail 2 PDFmarwaneeeePas encore d'évaluation
- Tension SuperficielleDocument14 pagesTension SuperficielleALLOLO100% (1)
- 25352Document231 pages25352Mak RamPas encore d'évaluation
- Chapitre 3 ConductionDocument92 pagesChapitre 3 ConductionchadiPas encore d'évaluation
- QW 3132Document165 pagesQW 3132zandePas encore d'évaluation
- Reduction D Endomorphismes Corrige Niveau 2Document13 pagesReduction D Endomorphismes Corrige Niveau 2Kenneth KodjoPas encore d'évaluation