Académique Documents
Professionnel Documents
Culture Documents
M Moundounga Pour Meh
Transféré par
juvelyescobar0Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
M Moundounga Pour Meh
Transféré par
juvelyescobar0Droits d'auteur :
Formats disponibles
Enoncé 1
1. L’éosine est un colorant utilisé pour ses propriétés asséchantes. Les flacons
d’éosines disponibles en pharmacie ont un volume 𝑉 = 2,0 𝑚𝐿 et une
concentration massique en éosine égale à 𝑡 = 20 𝑔. 𝐿 . On verse le contenu
d’un flacon d’éosine dans une fiole jaugée de volume 𝑉 = 50,0 𝑚𝐿, que l’on
complète avec de l’eau jusqu’au trait de jauge. On note 𝑡 la concentration
massique de la solution ainsi préparée.
1.1. Définir la dilution
1.2. Etablir la relation qui les concentrations massiques 𝑡 et 𝑡 et les volumes 𝑉 et
𝑉 .
1.3. Déterminer la concentration massique 𝑡 .
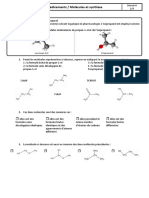
2. L’équation de la réaction chimique modélisant la transformation qui a lieu dans
l’étape 1 est :
2.1. Recopier la formule de l’oléine, entourer les groupes caractéristiques et
donner le nom de la fonction chimique correspondante.
2.2. Nommer la réaction chimique ainsi réalisée.
2.3. Déterminer la formule semi-développée du produit A formé.
2.4. La famille de l’acide oléique est 𝐶 𝐻 − 𝐶𝑂𝑂𝐻. Il appartient à la famille des
acides gras. Déterminer si l’acide oléique est saturé ou saturée.
3. Lors d’une course, un sportif consomme une boisson énergétique. L’énergie
nécessaire aux muscles est fournie par la combustion d’un sucre, le glucose de
formule chimique 𝑪𝟔 𝑯𝟏𝟐 𝑶𝟔 dans le muscle. La réaction de combustion complète
du glucose produit du dioxyde de carbone et de l’eau.
3.1. Recopier l’équation de combustion complète et l’équilibrer en écrivant les
coefficients stœchiométriques. :
𝑪𝟔 𝑯𝟏𝟐 𝑶𝟔 + … . 𝑶𝟐 → ⋯ 𝑪𝑶𝟐 + … . 𝑯𝟐 𝑶
3.2. Calculer la masse molaire moléculaire du glucose.
On donne : 𝑴𝑪 = 𝟏𝟐 𝒈. 𝒎𝒐𝒍 𝟏
; 𝑴𝑶 = 𝟏𝟔 𝒈. 𝒎𝒐𝒍 𝟏 , 𝑴𝑯 = 𝟏 𝒈. 𝒎𝒐𝒍 𝟏
3.3. Déterminer la quantité de matière n contenue dans 18 g de glucose
provenant de la boisson énergétique.
Enoncé 2
Au laboratoire, la solution de soude est fabriquée à partir de pastilles
d’hydroxyde de sodium. Un élève pèse une masse 𝒎 = 𝟓, 𝟎 𝒈
1. Masse molaire et mole.
1.1.Écrire la formule de l’hydroxyde de sodium.
1.2. Montrer que la masse molaire moléculaire de l’hydroxyde de sodium est
𝑴 = 𝟒𝟎 𝒈/𝒎𝒐𝒍
On donne 𝑀 = 23 𝑔. 𝑚𝑜𝑙 ; 𝑀 = 16 𝑔. 𝑚𝑜𝑙 ; 𝑀 = 1 𝑔. 𝑚𝑜𝑙 .
1.3. Calculer la quantité de matière n d’hydroxyde de sodium correspondante.
2. Ces pastilles sont dissoutes dans un volume 𝑽 = 𝟓𝟎𝟎 𝒎𝑳 d’eau.
2.1. Écrire l’équation de dissolution de l’hydroxyde de sodium dans l’eau.
2.2. Nommer les ions présents dans cette solution.
2.3. Déterminer la concentration molaire des ions hydroxyde.
3. Le 𝒑𝑯 de cette est égal à 13.
3.1 .Nommer l’appareil qui permet de mesurer le 𝑝𝐻 d’une solution.
3.2. Préciser la nature acide, basique ou neutre en justifiant votre réponse.
3.3. Déterminer la concentration molaire des ions oxoniums
4. L’aspartame est un édulcorant de formule semi-développée suivante :
La boisson utilisée contient 50,0 mg d’aspartame. On souhaite determiner la
quantité de matiere d’aspartame contenue dans cette boisson.
4.1. Entourer les groupes fonctionnels présents dans cette molécule.
4.2. Ecrire la formule brute de cette molécule.
4.3. Calculer la masse molaire moléculaire de cette molécule.
4.4. Déterminer la quantité de matière n d’aspartame contenue dans cette
boisson.
On donne 𝑴𝑪 = 𝟏𝟐, 𝟎 𝒈. 𝒎𝒐𝒍 𝟏
; 𝑴𝑶 = 𝟏𝟔, 𝟎 𝒈. 𝒎𝒐𝒍 𝟏 , 𝑴𝑯 = 𝟏, 𝟎𝟎 𝒈. 𝒎𝒐𝒍 𝟏
,
𝑀(𝑁) = 14,0 𝒈. 𝒎𝒐𝒍 𝟏
Vous aimerez peut-être aussi
- Chapitre 2-0-Pliage Des TolesDocument32 pagesChapitre 2-0-Pliage Des TolesHamza Liberados80% (5)
- TD Solutions Aqueuses - Acide Fort Base Forte PH 2016Document6 pagesTD Solutions Aqueuses - Acide Fort Base Forte PH 2016Oumar Traoré100% (2)
- Textile HabillementDocument4 pagesTextile HabillementElmehdi TalbiPas encore d'évaluation
- Rapport BroyageDocument59 pagesRapport BroyageIhsan Afriad75% (4)
- Amelioration de La Disponibili - Safae JTITE - 4630Document151 pagesAmelioration de La Disponibili - Safae JTITE - 4630Zineddine El Mehdi MustaphaPas encore d'évaluation
- Mod4 Corrige ch8 Partie2Document8 pagesMod4 Corrige ch8 Partie2api-278378684100% (1)
- Biology Paper 1 TZ1 HLDocument16 pagesBiology Paper 1 TZ1 HLyara hazemPas encore d'évaluation
- TD MD ChimieDocument2 pagesTD MD ChimieMatthias KingPas encore d'évaluation
- Série Acide Base DosageDocument5 pagesSérie Acide Base DosageBac TechniquePas encore d'évaluation
- TD de CH 1Document2 pagesTD de CH 1Mohammed TahriPas encore d'évaluation
- Page de TitreDocument56 pagesPage de TitreShérif SebouPas encore d'évaluation
- Capture D'écran . 2023-04-05 À 11.49.07 PMDocument9 pagesCapture D'écran . 2023-04-05 À 11.49.07 PMcheikhna lemrabettPas encore d'évaluation
- Exercice Courrigé CH - SOLDocument53 pagesExercice Courrigé CH - SOLossamaelallouli213Pas encore d'évaluation
- Devoir 6Document1 pageDevoir 6valdxPas encore d'évaluation
- Série 01Document3 pagesSérie 01Nouhad KaisPas encore d'évaluation
- Série 01Document5 pagesSérie 01Nouhad KaisPas encore d'évaluation
- tp18 Dosage Phmetrique Aspirine PDFDocument3 pagestp18 Dosage Phmetrique Aspirine PDFČhîmïî Štā100% (1)
- Ex Chap1 CorrectionDocument13 pagesEx Chap1 CorrectionFabrice hsuPas encore d'évaluation
- Transformations Associées...Document3 pagesTransformations Associées...abderrahimebaouzinePas encore d'évaluation
- Travaux Diriges 2021Document11 pagesTravaux Diriges 2021alex talakaPas encore d'évaluation
- Dosages Directs: Exercice 1Document2 pagesDosages Directs: Exercice 1HasnaPas encore d'évaluation
- Exos Acide BaseDocument2 pagesExos Acide Basebahijmalak4Pas encore d'évaluation
- Solutions AqueuesDocument3 pagesSolutions AqueuesnorelPas encore d'évaluation
- Série D'exercices N°7-2BAC PC-CHIMIEDocument2 pagesSérie D'exercices N°7-2BAC PC-CHIMIEAymanePas encore d'évaluation
- SOLUTIONS AQUEUSES AU BAC TSE-STI-TSExpDocument6 pagesSOLUTIONS AQUEUSES AU BAC TSE-STI-TSExpModibo CoulibalyPas encore d'évaluation
- Activité Transformations Dans 2 SensDocument1 pageActivité Transformations Dans 2 Sens12xcrbnx12Pas encore d'évaluation
- AspirineDocument3 pagesAspirinemariem outahmiditPas encore d'évaluation
- SERIE 1 NOTION DE SOLUTION 3emeDocument2 pagesSERIE 1 NOTION DE SOLUTION 3emeHanine HmidaPas encore d'évaluation
- Sujet 1Document5 pagesSujet 1Lilia AlouiPas encore d'évaluation
- Prepa1S SolutionsAqueusesDocument5 pagesPrepa1S SolutionsAqueusesMabonzotPas encore d'évaluation
- Série Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943Document2 pagesSérie Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943dememamebousso09Pas encore d'évaluation
- Énoncés Exos Chap2 SpectroDocument6 pagesÉnoncés Exos Chap2 Spectrobahijmalak4Pas encore d'évaluation
- Série DosageDocument2 pagesSérie DosageNouhad KaisPas encore d'évaluation
- Exercices Sur Les SolutionsDocument1 pageExercices Sur Les SolutionsToons LandPas encore d'évaluation
- Serie 4 SOLUTIONS ACIDES ET BASIQUESDocument1 pageSerie 4 SOLUTIONS ACIDES ET BASIQUESdeyinPas encore d'évaluation
- 2022 Examen 2 Chimie Solutions Corrigé LDDocument7 pages2022 Examen 2 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- UntitledDocument6 pagesUntitledJabbour JabbourPas encore d'évaluation
- Série Les Réactions Acido BasiquesDocument2 pagesSérie Les Réactions Acido BasiquesIMAD EL BYDARYPas encore d'évaluation
- Chapitre 3-Transformations Chimiques S'effectuée Deux SensDocument2 pagesChapitre 3-Transformations Chimiques S'effectuée Deux SensMoulham KhalidPas encore d'évaluation
- Exercices Mole Et SolutionsDocument3 pagesExercices Mole Et SolutionsSidhoum Sid100% (2)
- Série 2 - ConcentrationDocument12 pagesSérie 2 - ConcentrationHamza Faraji100% (1)
- Epreuve Bac 2022 Chimie Série C D e Cameroun PDFDocument2 pagesEpreuve Bac 2022 Chimie Série C D e Cameroun PDFAmza Farel100% (2)
- Serie 1 Analytique BAKAKDocument1 pageSerie 1 Analytique BAKAKagregation physiquePas encore d'évaluation
- Notion PH EXOSDocument2 pagesNotion PH EXOSAbel MalléPas encore d'évaluation
- TR Acidobasiques PCDocument11 pagesTR Acidobasiques PCalaeddinePas encore d'évaluation
- CEEMS Chimie 2008Document5 pagesCEEMS Chimie 2008Madi Diop0% (1)
- Equilibre Chimique Série 4Document2 pagesEquilibre Chimique Série 4hurrem unsalezPas encore d'évaluation
- SC2-Les Solutions Electrolytiques1Document1 pageSC2-Les Solutions Electrolytiques1el jabri hibaPas encore d'évaluation
- UntitledDocument1 pageUntitledBenji JeanPas encore d'évaluation
- Ex0 C3 Reactions Totales Ou LimiteesDocument1 pageEx0 C3 Reactions Totales Ou LimiteesMed BriniPas encore d'évaluation
- Ph-Solution Aqueuse-Autoprotolyse de L'eau-TsDocument2 pagesPh-Solution Aqueuse-Autoprotolyse de L'eau-TsSeydina WadePas encore d'évaluation
- Les Solutions: Concentration D'une Solution-SolubilitéDocument2 pagesLes Solutions: Concentration D'une Solution-SolubilitéaliPas encore d'évaluation
- Exercice 1Document2 pagesExercice 1adji marieme dia100% (1)
- EsterficationsDocument9 pagesEsterficationssaid khachouPas encore d'évaluation
- TP1 ChimieDocument8 pagesTP1 ChimieHalima ZighPas encore d'évaluation
- CPHY-204 Dosage Du Sucre Dans Un Sirop Fiche ProfesseurDocument9 pagesCPHY-204 Dosage Du Sucre Dans Un Sirop Fiche ProfesseurWalid MouriniPas encore d'évaluation
- 9-Série de TD N°9 Physique Pharmaceutique 2021-2022Document2 pages9-Série de TD N°9 Physique Pharmaceutique 2021-2022fadia sellami100% (1)
- TD2 CSDocument2 pagesTD2 CSSimo Maro100% (1)
- Série (Etat D'équilibre)Document1 pageSérie (Etat D'équilibre)12xcrbnx12Pas encore d'évaluation
- Devoir 6 QCMDocument4 pagesDevoir 6 QCMvaldxPas encore d'évaluation
- SERIEC1Document4 pagesSERIEC1Mouhamed lamine SonkoPas encore d'évaluation
- PH Solutions Aqueuses 2024-Lsll - WahabdiopDocument2 pagesPH Solutions Aqueuses 2024-Lsll - WahabdiopAmadou Oury Diallo100% (1)
- TD Sur Les Alcools Terminale CD 2023Document3 pagesTD Sur Les Alcools Terminale CD 2023Admi BraccPas encore d'évaluation
- tp18c Dosage Phmetriq AspirineDocument3 pagestp18c Dosage Phmetriq AspirineMartialPas encore d'évaluation
- S Physique Chimie Obligatoire 2020 Polynesie Remplacement Sujet OfficielDocument15 pagesS Physique Chimie Obligatoire 2020 Polynesie Remplacement Sujet OfficielShahnas HAMITHPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Chap 1Document15 pagesChap 1Anonymous f5yW3N0jSPas encore d'évaluation
- 32examen National Physique Chimie Sciences Maths 2018 Rattrapage CorrigeDocument4 pages32examen National Physique Chimie Sciences Maths 2018 Rattrapage CorrigeAssia OunkhirPas encore d'évaluation
- Technologies de L'énergie Propre, Moins Connues, Faible Coût, Et Liées À L'évolution Des ApplicationsDocument388 pagesTechnologies de L'énergie Propre, Moins Connues, Faible Coût, Et Liées À L'évolution Des ApplicationsBen RusuisiakPas encore d'évaluation
- La Gaine de Câble À Fibre Optique ++++Document1 pageLa Gaine de Câble À Fibre Optique ++++Abdelhamid SammoudiPas encore d'évaluation
- Application Des Méthodes Expérimentales Dans Des Structures en B.ADocument25 pagesApplication Des Méthodes Expérimentales Dans Des Structures en B.ANazim KASSABPas encore d'évaluation
- MANSOURI Fatima-Converti - 3Document97 pagesMANSOURI Fatima-Converti - 3Ouail guePas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - 3ème Mathématiques (2015-2016) Mme Grissa HafidhaDocument3 pagesDevoir de Synthèse N°1 - Sciences Physiques - 3ème Mathématiques (2015-2016) Mme Grissa HafidhaaliPas encore d'évaluation
- Ads TPDocument6 pagesAds TPcélia ferPas encore d'évaluation
- TD 3 Et CorrectionDocument10 pagesTD 3 Et CorrectionCǿêûr Ðê PîirâtêPas encore d'évaluation
- 10 SD FRDocument4 pages10 SD FRabbes ben hemanaPas encore d'évaluation
- Fup FRDocument16 pagesFup FRMohamed ChelfatPas encore d'évaluation
- Adet 0251 Fraisage Usinage Matériaux MétalliquesDocument22 pagesAdet 0251 Fraisage Usinage Matériaux MétalliquesOkbaPas encore d'évaluation
- Extraction Solide Liquide Sur Pilote de GraineDocument78 pagesExtraction Solide Liquide Sur Pilote de GraineMaryem Ben SalemPas encore d'évaluation
- Analyse TGADocument20 pagesAnalyse TGAzhor El hallaoui100% (1)
- TDPermDocument4 pagesTDPermAmine HeddoubPas encore d'évaluation
- Leçon N6 Reactions Les Solutions Avec Les MetauxDocument3 pagesLeçon N6 Reactions Les Solutions Avec Les MetauxAgnaou MohamedPas encore d'évaluation
- PDR Pour Analyseur Chimiques Et SondesDocument19 pagesPDR Pour Analyseur Chimiques Et SondesSODEX FRANCEPas encore d'évaluation
- Les Structures PoreusesDocument9 pagesLes Structures PoreusesSeddik hPas encore d'évaluation
- T1 C1A2 COURS Evolution AtmosphèreDocument1 pageT1 C1A2 COURS Evolution AtmosphèresimousseePas encore d'évaluation
- Criteres D'acceptation API 1104Document1 pageCriteres D'acceptation API 1104Had Rayane100% (2)
- N2016SM PDFDocument8 pagesN2016SM PDFmjidooooPas encore d'évaluation
- Mémo Thermochimie Chap 1 MP 22Document3 pagesMémo Thermochimie Chap 1 MP 22emilian ghaniPas encore d'évaluation
- Norme Européenne: NF EN 10028-5Document13 pagesNorme Européenne: NF EN 10028-5Noureddine SemaraPas encore d'évaluation
- EFFICACITE ENERGETIQUE - Processus de Fabrication de Sucre (La Cosumar)Document21 pagesEFFICACITE ENERGETIQUE - Processus de Fabrication de Sucre (La Cosumar)Abdellah Samadi100% (3)