Académique Documents
Professionnel Documents
Culture Documents
Exos Acide Base
Transféré par
bahijmalak40 évaluation0% ont trouvé ce document utile (0 vote)
3 vues2 pagesTitre original
ExosAcideBase
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
3 vues2 pagesExos Acide Base
Transféré par
bahijmalak4Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
EXERCICES.
FORCE DES ACIDES ET DES BASES
Donnée pour tous les exercices : produit ionique de l’eau à 25°C : 𝐾𝑒 = 1,0 × 10−14
Exercice 1. Calculs de pH de solutions aqueuses d’acides et de bases fortes
1. Calculer le pH d’une solution d’acide chlorhydrique obtenue par dissolution de 𝑛0 = 2,4 × 10−4 mol
de chlorure d’hydrogène 𝐻𝐶𝑙(𝑔) (un acide fort) dans V0 = 200 mL d’eau.
2. L’acide nitrique pur HNO3(l) est un liquide incolore et inodore de masse volumique 1,4 g.cm-3. C’est
un acide fort en solution aqueuse. Calculer le volume d’acide nitrique à dissoudre dans de l’eau pour
obtenir 1,000 L de solution d’acide nitrique de pH = 1,6. Donnée : 𝑀(𝐻𝑁𝑂3 ) = 63,0 𝑔. 𝑚𝑜𝑙 −1
3. Calculer le pH d’une solution aqueuse de concentration molaire en ion amidure 𝑁𝐻2− (base forte)
apporté est 𝑐𝑏 = 1,5 × 10−5 𝑚𝑜𝑙. 𝐿−1
4. Calculer le pH d’une solution aqueuse d’hydroxyde de sodium 𝑁𝑎𝑂𝐻(𝑠) (composé ionique et base
forte) de concentration molaire en soluté apporté 𝑐𝑏 = 2,5 × 10−3 𝑚𝑜𝑙. 𝐿−1
Exercice 2. Acide faible ou fort ?
L’acide nitrique 𝐻𝑁𝑂3, l’acide sulfurique 𝐻2 𝑆𝑂4 , le chlorure d’hydrogène 𝐻𝐶𝑙 et l’acide éthanoïque
𝐶𝐻3 𝐶𝑂2 𝐻 sont quatre acides. Trois d’entre eux sont des acides forts et le 4 ème est un acide faible mais
lequel ??!! Pour identifier l’intrus, on réalise des solutions aqueuses avec chacun des acides et on mesure le
pH de la solution obtenue après dissolution dans l’eau distillée (à 25°C) :
quantité dissoute volume de solution
acide pH mesuré
en mole aqueuse obtenue
𝐻𝑁𝑂3 10,0 mmol 1,00 L 2,00
𝐻𝐶𝑙 15,0 mmol 500 mL 1,52
𝐶𝐻3 𝐶𝑂2 𝐻 10,0 mmol 1,00 L 3,33
𝐻2 𝑆𝑂4 40,0 𝜇mol 250 mL 3,50
Travail à faire : à l’aide des mesures de pH, identifier l’intrus !
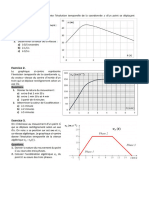
Exercice 3. La leucine, un acide alpha-aminé
La leucine est un acide aminé dans la formule topologique est donnée ci-contre.
1. Identifier les deux groupes caractéristiques présents dans la molécule.
2. En solution aqueuse, un transfert intramoléculaire d’un ion hydrogène a lieu
du groupe carboxyle vers le groupe amine. Écrire la formule topologique de l’amphion formé.
3. L’amphion est une espèce amphotère. Écrire les deux couples acide/base auxquels il appartient.
4. Établir sur un même diagramme les domaines de prédominance des espèces appartenant aux
couples de la leucine sachant que les 𝑝𝐾𝑎 sont de 2,4 et 9,9. Quelle espèce prédomine à 𝑝𝐻 = 8,4 ?
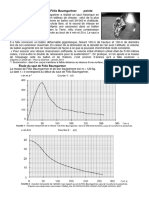
Exercice 4. L’eau de Javel
L’eau de Javel est une solution aqueuse fréquemment utilisée comme désinfectant ou comme décolorant.
L’espèce active contenue dans l’eau de Javel est l’ion hypochlorite 𝐶𝑙𝑂− . C’est une base faible. Le diagramme
de distribution associé à son couple 𝐻𝐶𝑙𝑂/𝐶𝑙𝑂− est donné ci-dessous.
1. Déterminer la valeur du 𝑝𝐾𝐴 du couple.
2. Une solution d’eau de Javel de concentration
molaire en soluté apporté de 60 𝜇𝑚𝑜𝑙. 𝐿−1 a un pH
de 8,5. Déterminer les concentrations molaires en
acide hypochloreux 𝐻𝐶𝑙𝑂 et en ions hypochlorite
dans cette eau de Javel.
Exercice 5. L’acide benzoïque
Une solution de volume 𝑉 = 100 𝑚𝐿 est obtenue par dissolution totale dans l’eau d’un échantillon de
1,0 𝑚𝑚𝑜𝑙 d’acide benzoïque de formule 𝐶6 𝐻5 𝐶𝑂2 𝐻. L’acide benzoïque est un acide faible.
Donnée : 𝑝𝐾𝑎 = 4,2 à 25°C pour le couple 𝐶6 𝐻5 𝐶𝑂2 𝐻/𝐶6 𝐻5 𝐶𝑂2−
1. Écrire l’équation de la réaction associée à la constante d’acidité de l’acide benzoïque.
2. À l’aide d’un tableau d’avancement, déterminer le pH de la solution.
3. Quelle quantité d’acide aurait-on dû introduire pour obtenir une solution de pH égal à 4,2 ?
Exercice 6. Déterminer une constante d’acidité
L’acide lactique de formule brute 𝐶3 𝐻6 𝑂3 est un acide faible. On prépare une solution aqueuse d’acide
lactique de concentration molaire en soluté apporté 𝑐𝑎 = 1,0 × 10−2 𝑚𝑜𝑙. 𝐿−1 . Une mesure de son pH à
25°C donne la valeur 3,0.
1. Écrire l’équation de la réaction de l’acide avec l’eau.
2. Déterminer la constante d’acidité du couple de l’acide lactique. Vérifier que 𝑝𝐾𝑎 = 3,9.
3. Comparer la force de l’acide lactique avec celle de l’acide éthanoïque (de 𝑝𝐾𝑎 = 4,8).
4. Comparer les forces de leurs bases conjuguées.
Exercice 7. Le pH d’une eau distillée
L’ion hydrogénocarbonate 𝐻𝐶𝑂3− est une espèce amphotère appartenant aux deux couples acide/base :
𝐻2 𝐶𝑂3 /𝐻𝐶𝑂3− de 𝑝𝐾𝑎1 = 4,2 et 𝐻𝐶𝑂3− /𝐶𝑂32− de 𝑝𝐾𝑎2 = 10,3 à 25°C.
Du dioxyde de carbone 𝐶𝑂2(𝑔) présent dans l’air se dissout dans de l’eau laissée à l’air libre.
1. Écrire l’équation de la réaction entre 𝐶𝑂2(𝑔) et l’eau, formant l’acide carbonique 𝐻2 𝐶𝑂3.
2. Écrire l’équation de la réaction de l’acide carbonique avec l’eau.
3. Une eau distillée (initialement de pH égal à 7,0) est laissée à l’air libre. Son pH baisse alors jusqu’à la
valeur de 5,5. Justifier cette baisse à l’aide de la question précédente.
4. Indiquer sur un même diagramme, les domaines de prédominance des trois espèces chimiques et en
déduire l’espèce prédominante dans l’eau distillée laissée à l’air libre.
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Acides Et Bases en Solution Aqueuse-1-1Document6 pagesAcides Et Bases en Solution Aqueuse-1-1Lumière HabaPas encore d'évaluation
- 5 Reactions Acido BasiquesDocument3 pages5 Reactions Acido BasiquesYouness SinePas encore d'évaluation
- Brochure de Chimie PDFDocument12 pagesBrochure de Chimie PDFAbdoul karim DansokoPas encore d'évaluation
- Banque D'exercicesDocument37 pagesBanque D'exercicesyves100% (4)
- TD PH COUPLE-ACIDE-BASE 2016Document13 pagesTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréPas encore d'évaluation
- Travaux Diriges de P.C.T N°3 Theme: Les Solutions AqueusesDocument2 pagesTravaux Diriges de P.C.T N°3 Theme: Les Solutions AqueusesPatrick OlingaPas encore d'évaluation
- 4 - Chimie TLeDocument52 pages4 - Chimie TLeAnas IsmailPas encore d'évaluation
- Exercices Supplementaires en Chimie Analytique PDFDocument18 pagesExercices Supplementaires en Chimie Analytique PDFyacine100% (1)
- TD 3 PCT 3ème GroupeDocument2 pagesTD 3 PCT 3ème GroupeEric SonaPas encore d'évaluation
- Acides Bases PDFDocument8 pagesAcides Bases PDFHafidi AhmedPas encore d'évaluation
- SOLUTIONS AQUEUSES AU BAC TSE-STI-TSExpDocument6 pagesSOLUTIONS AQUEUSES AU BAC TSE-STI-TSExpModibo CoulibalyPas encore d'évaluation
- Des Exo de SolutionDocument23 pagesDes Exo de SolutionAmel Lilou100% (1)
- TD Solutions Aqueuses - Acide Fort Base Forte PH 2016Document6 pagesTD Solutions Aqueuses - Acide Fort Base Forte PH 2016Oumar Traoré100% (2)
- 612a8ebfa14efdevoir 21 Chimie Minerale Niveau Terminale D EmptDocument1 page612a8ebfa14efdevoir 21 Chimie Minerale Niveau Terminale D EmptAdam MorokanPas encore d'évaluation
- Ph-Solution Aqueuse-Autoprotolyse de L'eau-TsDocument2 pagesPh-Solution Aqueuse-Autoprotolyse de L'eau-TsSeydina WadePas encore d'évaluation
- TD C5 TSDocument2 pagesTD C5 TScoumbacamara2705Pas encore d'évaluation
- PH Solutions Aqueuses 2024-Lsll - WahabdiopDocument2 pagesPH Solutions Aqueuses 2024-Lsll - WahabdiopAmadou Oury Diallo100% (1)
- Exercices Réactions Acido-BasiquesDocument4 pagesExercices Réactions Acido-Basiquesayyoub dhbPas encore d'évaluation
- Exercices Sur Les Ions en SolutionDocument7 pagesExercices Sur Les Ions en Solutionmustapha zaamPas encore d'évaluation
- Acide Base Faible CoupleDocument5 pagesAcide Base Faible CoupleBicaba MarkissPas encore d'évaluation
- C7 Af BF WahabDiopDocument5 pagesC7 Af BF WahabDiopGaye BachirPas encore d'évaluation
- Solutions AqueuesDocument3 pagesSolutions AqueuesnorelPas encore d'évaluation
- Série Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943Document2 pagesSérie Autoprolyse de L'eau Produit Ionique PH D'une Solution - Acide Fort - Base Forte - 113943dememamebousso09Pas encore d'évaluation
- Cours de VirologieDocument5 pagesCours de VirologieFrancisca AgboviPas encore d'évaluation
- TleD - CH - L8 - Acide Faible Base FaibleDocument12 pagesTleD - CH - L8 - Acide Faible Base FaibleDavid NiamienPas encore d'évaluation
- 2011 Liban Exo3 Sujet AciditeVin 4ptsDocument3 pages2011 Liban Exo3 Sujet AciditeVin 4ptsgrajzgrPas encore d'évaluation
- Exercices Supplementaires en Chimie Analytique PDFDocument18 pagesExercices Supplementaires en Chimie Analytique PDFbentouamiPas encore d'évaluation
- TD Exercices-Corrigés PDFDocument21 pagesTD Exercices-Corrigés PDFabdelouahed.rhaouiPas encore d'évaluation
- Brochure de Chimie TSMDocument53 pagesBrochure de Chimie TSMOūs Mān BeretePas encore d'évaluation
- File NameDocument1 pageFile Namestelinnkama3Pas encore d'évaluation
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 pagesSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinPas encore d'évaluation
- Capture D'écran . 2023-04-05 À 11.49.07 PMDocument9 pagesCapture D'écran . 2023-04-05 À 11.49.07 PMcheikhna lemrabettPas encore d'évaluation
- TD C567Document7 pagesTD C567Mouhamed SarryPas encore d'évaluation
- TD - Chimie Des Solutions 2022-2023Document2 pagesTD - Chimie Des Solutions 2022-2023Sirandou DiaoPas encore d'évaluation
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- 2008 Polynesie Exo1 Sujet Acides 7ptsDocument3 pages2008 Polynesie Exo1 Sujet Acides 7ptsla physique selon le programme FrançaisPas encore d'évaluation
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 pagesTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhPas encore d'évaluation
- TD Tampon 2013 lsll-WahabDiopDocument4 pagesTD Tampon 2013 lsll-WahabDiopFy EzahanaPas encore d'évaluation
- Serie Acide Fort - Base Forte TS2Document3 pagesSerie Acide Fort - Base Forte TS2Amadou Oury DialloPas encore d'évaluation
- S - Rie TD Chimie1Document12 pagesS - Rie TD Chimie1Aristide MfifenPas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- Chimie TleC, DDocument52 pagesChimie TleC, DDeffo100% (1)
- Série Réaction Acide BaseDocument5 pagesSérie Réaction Acide BaseScriblouPas encore d'évaluation
- PDF Document 36804ECC8D0E 1Document2 pagesPDF Document 36804ECC8D0E 1Mariam HoyekPas encore d'évaluation
- Exercices C7 TSDocument2 pagesExercices C7 TSkondemamadousaidouPas encore d'évaluation
- Chimie M1Document4 pagesChimie M1Elie KapouPas encore d'évaluation
- 1cm3ehhup 652709Document2 pages1cm3ehhup 652709Oumou Khaïry DiopPas encore d'évaluation
- C.P 22-23 Solution AqueusesDocument2 pagesC.P 22-23 Solution AqueusesdiarratogsibPas encore d'évaluation
- Solutions Aqueuses Acides Et BasiquesDocument3 pagesSolutions Aqueuses Acides Et BasiquesLiza mezariPas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- Examens TP Semestre 2Document3 pagesExamens TP Semestre 2Mamadou lamine DiattaPas encore d'évaluation
- Fiches Exercices Titrages-2010Document3 pagesFiches Exercices Titrages-2010Daniel Parnor100% (1)
- TD2 CSDocument2 pagesTD2 CSSimo Maro100% (1)
- TD Chimie Ana Lomé L2 2021Document12 pagesTD Chimie Ana Lomé L2 2021Bamon100% (2)
- Chapitre Acide BaseDocument23 pagesChapitre Acide BaseFakoro Abdul Aziz Doumbia100% (1)
- Acides Bases TDDocument5 pagesAcides Bases TDSalihou AlhadjiPas encore d'évaluation
- CH8 EXERCICES Concentration Molaire Des Espèces Moléculaires Dans Une Solution TCSbiof Prof - Mardi (WWW - Pc1.ma)Document3 pagesCH8 EXERCICES Concentration Molaire Des Espèces Moléculaires Dans Une Solution TCSbiof Prof - Mardi (WWW - Pc1.ma)Yassine BerchilPas encore d'évaluation
- Serie 5 Et 6 Solution Aqueuse Acide Fort Base ForteDocument7 pagesSerie 5 Et 6 Solution Aqueuse Acide Fort Base ForteCheujeu chaldouPas encore d'évaluation
- Eric C16 4.TP2Diffraction22Document2 pagesEric C16 4.TP2Diffraction22bahijmalak4Pas encore d'évaluation
- Eric C12 1particule Dans E PythonDocument5 pagesEric C12 1particule Dans E Pythonbahijmalak4Pas encore d'évaluation
- Eric C18 Principecellules PhotovoltaiqDocument3 pagesEric C18 Principecellules Photovoltaiqbahijmalak4Pas encore d'évaluation
- Exercices DiffractionDocument5 pagesExercices Diffractionbahijmalak4Pas encore d'évaluation
- Eric C09 3. Stratégies de SynthèseDocument9 pagesEric C09 3. Stratégies de Synthèsebahijmalak4Pas encore d'évaluation
- Eric C09 5. Synthèse Acétate de LinalyleDocument3 pagesEric C09 5. Synthèse Acétate de Linalylebahijmalak4Pas encore d'évaluation
- Eric C09 4.synthese - Du - Paracetamol-2Document6 pagesEric C09 4.synthese - Du - Paracetamol-2bahijmalak4Pas encore d'évaluation
- Eric C10 4.coursDocument3 pagesEric C10 4.coursbahijmalak4Pas encore d'évaluation
- Eric C09 4.synthese de L'aspirineDocument4 pagesEric C09 4.synthese de L'aspirinebahijmalak4Pas encore d'évaluation
- Eric C09 2. Synthèse Orga RappelsDocument3 pagesEric C09 2. Synthèse Orga Rappelsbahijmalak4Pas encore d'évaluation
- Eric C10 3traject ParabolpythonélèveDocument2 pagesEric C10 3traject Parabolpythonélèvebahijmalak4Pas encore d'évaluation
- Eric C10 5 ExosDocument4 pagesEric C10 5 Exosbahijmalak4Pas encore d'évaluation
- Eric C10 Exos de CinématiqueDocument2 pagesEric C10 Exos de Cinématiquebahijmalak4Pas encore d'évaluation
- Eric C10 2mouvement Objet Lancé VidéopointagetableurDocument3 pagesEric C10 2mouvement Objet Lancé Vidéopointagetableurbahijmalak4Pas encore d'évaluation
- Eric C10 1.exo Tracé VecteurDocument2 pagesEric C10 1.exo Tracé Vecteurbahijmalak4Pas encore d'évaluation
- Exercices CondensateurDocument10 pagesExercices Condensateurbahijmalak4Pas encore d'évaluation
- Exercices 0 2024 FKDocument10 pagesExercices 0 2024 FKbahijmalak4Pas encore d'évaluation
- Guide de Survie Parcoursup 2024Document389 pagesGuide de Survie Parcoursup 2024Alexia ZoghiPas encore d'évaluation
- Bac Blanc 2024 1Document5 pagesBac Blanc 2024 1bahijmalak4Pas encore d'évaluation
- Énoncés Exos Chap2 SpectroDocument6 pagesÉnoncés Exos Chap2 Spectrobahijmalak4Pas encore d'évaluation
- Eric C02 Exos Corrigé UV VisibleDocument8 pagesEric C02 Exos Corrigé UV Visiblebahijmalak4Pas encore d'évaluation
- Exos SatellitesDocument4 pagesExos Satellitesbahijmalak4Pas encore d'évaluation
- Série Dexercices Corrigés N°2Document7 pagesSérie Dexercices Corrigés N°2chada100% (1)
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Analyses Des EngraisDocument18 pagesAnalyses Des EngraisELBADA HamidPas encore d'évaluation
- Cours Résumés 2017 2018 (Cheikh Melainin) (SFAX Lycee Hedi Chaker)Document1 pageCours Résumés 2017 2018 (Cheikh Melainin) (SFAX Lycee Hedi Chaker)dcdPas encore d'évaluation
- BAC CetD 2006 Chimie (Corrigé)Document5 pagesBAC CetD 2006 Chimie (Corrigé)Ousmane Diarra100% (1)
- Détermination de La Constante D'aciditéDocument3 pagesDétermination de La Constante D'aciditéAnis Dahnen100% (2)
- Devoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)Document11 pagesDevoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)fayePas encore d'évaluation
- Villemin Gerard Free FRDocument5 pagesVillemin Gerard Free FRYoussef EttaajPas encore d'évaluation
- Fiche Des 5 TP Chimie MPDocument8 pagesFiche Des 5 TP Chimie MPLandry Yoboue100% (1)
- Exam 3 SMDocument4 pagesExam 3 SMKhaouda Driss100% (1)
- TPN: 3 Réactivité Chimique: Ph-Metrie Etude Des Courbes de Variation de PHDocument7 pagesTPN: 3 Réactivité Chimique: Ph-Metrie Etude Des Courbes de Variation de PHArradPas encore d'évaluation
- 2° Contrôle SMPC S2 2012 2013Document2 pages2° Contrôle SMPC S2 2012 2013lahssane hmidat100% (1)
- PH ExoDocument35 pagesPH ExoHicham Oublal100% (1)
- Chimie Des Solutions - Exam-SN - 21-22Document1 pageChimie Des Solutions - Exam-SN - 21-22hichamakaya1Pas encore d'évaluation
- Chimie Tle Exercices de Remise A Niveau by Educ Spec Org Conge de PaquesDocument14 pagesChimie Tle Exercices de Remise A Niveau by Educ Spec Org Conge de PaquesguillaumedjourkinePas encore d'évaluation
- 8 - Les Transformations Chimiques S'effectuant Dans Les Deux SensDocument10 pages8 - Les Transformations Chimiques S'effectuant Dans Les Deux Senspro alixPas encore d'évaluation
- tp-3 Physico Chimie Des Solution GuelmaDocument4 pagestp-3 Physico Chimie Des Solution GuelmaAmir AttafiPas encore d'évaluation
- AciabaseDocument15 pagesAciabaseMoustapha SallPas encore d'évaluation
- ANNALE DE Chimie TS PDF Filename UTF 8''ANNALE DE Chimie TS 1Document49 pagesANNALE DE Chimie TS PDF Filename UTF 8''ANNALE DE Chimie TS 1ralph nlend91% (78)
- AminesDocument23 pagesAminesLevier Poids100% (1)
- Exsm11 03rDocument1 pageExsm11 03rOudjoud KeddourPas encore d'évaluation
- Tp2a1 2Document11 pagesTp2a1 2univers_a91% (11)
- Calcul de PH - FORMULES & CONDITIONS - Fiche Résumé & Explications - Acides Bases - Chimie Bac+1 - YouTubeDocument3 pagesCalcul de PH - FORMULES & CONDITIONS - Fiche Résumé & Explications - Acides Bases - Chimie Bac+1 - YouTubedodiPas encore d'évaluation
- PH Calibration Poster A3 FR 30131318 V03.14 Original 31664Document1 pagePH Calibration Poster A3 FR 30131318 V03.14 Original 31664Armand Muteb AmkPas encore d'évaluation
- Acido Basiques Cours Et Exercices CorrigésDocument11 pagesAcido Basiques Cours Et Exercices CorrigésAnass Benahmed100% (1)
- Burkina 2015 Phys Chimie Serie D 1er Tour RempDocument4 pagesBurkina 2015 Phys Chimie Serie D 1er Tour RempEvrard KaborePas encore d'évaluation
- CNC MP 2008 Chimie CorrigeDocument6 pagesCNC MP 2008 Chimie CorrigeAsmaa KasmiPas encore d'évaluation
- Reactif ChimiqueDocument5 pagesReactif ChimiqueHana ChaabnaPas encore d'évaluation
- Rapport Acide BaseDocument10 pagesRapport Acide BaseBouafia AbdelrahmanePas encore d'évaluation