Académique Documents
Professionnel Documents
Culture Documents
TD-Composes Oxygenes - 2024 LSLL - Wahabdiop
TD-Composes Oxygenes - 2024 LSLL - Wahabdiop
Transféré par
sane20ka0 évaluation0% ont trouvé ce document utile (0 vote)
2 vues2 pagesTitre original
TD-Composes oxygenes - 2024 lsll_wahabdiop (8)
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
2 vues2 pagesTD-Composes Oxygenes - 2024 LSLL - Wahabdiop
TD-Composes Oxygenes - 2024 LSLL - Wahabdiop
Transféré par
sane20kaDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Pour vos cours à domicile 775136349
Année scolaire : 2023-2024
Cellules de Sciences Physiques
Classe 1S2
SERIE D’EXERCICES SUR C5 : COMPOSES ORGANIQUES OXYGENES
Exercice 1 :
1) Nommer les composés suivants :
CH3
H3C CH2 CH OH H3C CH2 C CH2 OH
CH3
CH3
CH3
H3C CH2 O HC H3C CH2 CH2 O CH3
H CH3 O CH3
H3C CH CH2 C H3C CH2 C HC
O CH3
CH3
OH
OH
CH3
H3C CH C
H3C CH2 CH2 HC
CH3
O O HC
CH3
2) Écrire les FSD des composés suivants :
a) 2-méthylbutan-1-ol ; b) 2-éthyl-3-méthylbutanal ; c) acide3-méthylbutanoïque ;
d) éthoxy-2-méthylhexane e) 2,2-diméthylpentan-3-one ; f) 2,2-diméthylpentan-3-one ;
g/ 3-méthylpentanoate de méthyléthyle
Exercice 2 :
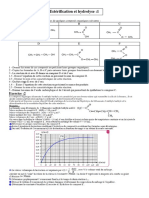
A - La combustion de 5,1g d’un monoester saturé fournit 11g de dioxyde de carbone.
1. Écrire l’équation bilan de la réaction de combustion de cet ester en fonction du nombre n d’atomes de
carbone qu’il contient.
2. Déterminer la formule brute de cet ester.
3. Donner les 8 formules semi-développées possibles de l’ester. Les nommer.
4. Quel est le volume de dioxygène mesuré dans les C.N.T.P nécessaire à la combustion.
B - On dissout une masse m = 0,185g d’un acide carboxylique saturé A dans un volume Ve = 500mL d’eau.
On prélève un volume v = 2OmL de cette solution que l’on dose complètement avec un volume Vb = 10mL
d’une solution d’hydroxyde de sodium de concentration Cb= 0,01mol.L-1. Déterminer la formule brute de
l’acide, sa formule semi-développée et son nom.
Exercice 3 :
La combustion complète de 0,37 g d’un alcool A nécessite un volume V= 0,72 L de dioxygène dans les
conditions de température et de pression où le volume molaire des gaz est égal à 24L.mol-1 .
1. Écrire l'équation de combustion d'un alcool.
2. Déterminer la formule brute de l'alcool A.
3. Donner la formule semi développée. Le nom et la classe de tous les alcools isomères correspondant
à cette formule brute.
4. On réalise l’oxydation de A dans le dioxygène de l'air on obtient un composé B qui réagit avec 1a D.N..P
.H et qui rosit le réactif de Shift.
4.1 Identifier l'alcool sachant que son isomère de position ne réagit pas au cours d’une oxydation
ménagée
4.2 Donner la formule semi-développée et le nom de B.
4.3 L’oxydation ménagée de B donne un composé C, donner la formule semi-développée et le nom de C ·
5. On réalise la déshydratation de l'alcool A à une température de 180°C on obtient un composé D.
(Wahab Diop) http://physiquechimie.godaddysites.com
Pour vos cours à domicile 775136349
5.1. Écrire l'équation de la réaction de de déshydratation de l’alcool A.
5.2 Donner la famille, la formule semi-développée et le nom de D.
Exercice 4 :
Les parties A et B sont indépendantes.
A- Soit un corps D de formule brute CnH2nO.
1. L'oxydation complète de 1 g de D donne 2,45 g de dioxyde de carbone. Écrire l'équation -- bilan de la
réaction et en déduire la formule brute de D.
2. Avec la D.N.P.H, D donne un précipité jaune. Quelles sont les formules semi-développées possibles de D
?
3. Le composé D donne un dépôt d'argent avec le nitrate d'argent ammoniac (réactif de Tollens), en
déduire la fonction chimique de D.
4. En milieu acide, D est oxydé de façon ménagé et donne l’acide 2 – méthylpropanoïque ; en déduire la
formule semi - développée précise de D. Quel est son nom ?
B- On veut déterminer la formule d'un acide carboxylique A, à chaîne carbonée saturée. On dissout une
masse m =622 mg de cet acide dans de l’eau pure : la solution obtenue a un volume V = 20O cm 3 On en
prélève un volume Va= 10 cm3 que l’on dose à l’aide d'une solution d'hydroxyde de sodium de
concentration Cb = 5.10-2 moL.L-1.
L'équivalence est atteinte quand on a versé un volume Vb = 8,4 cm3 de solution d'hydroxyde de sodium.
l. Déterminer la concentration molaire Ca de l'acide A.
2. Déterminer la quantité de matière de A contenue dans les 2OO cm3. En déduire sa masse molaire
3. Déterminer sa formule brute et son nom.
Exercice 5 :
On veut identifier un corps A dont la molécule est à chaîne carbonée saturée et ne possède qu’une seule
fonction organique.
1. Quand on fait réagir l’acide méthanoïque sur le corps A, il se forme de l’ester et de l’eau.
2. Quel est le nom de cette réaction ?
3. Écrire l’équation bilan de la réaction (On utilisera pour A sa formule générale); quelles sont les
caractéristiques de cette réaction ?
4. A l’état initial, on avait mélangé V = 150mL d’une solution d’acide méthanoïque de concentration molaire C
= 5.10-1mol/L avec mA = 3,70g du corps A. A l’équilibre, il reste n’1 = 5.10-2mol d’acide méthanoïque et m’A
= 1,85g du corps A qui n’ont pas réagi.
►A partir de ces données, montrer que la masse molaire moléculaire du corps A est MA = 74g/mol.
►En déduire les formules semi-développées possibles du corps A
►Une autre étude a montré que la molécule de A est chirale (molécule qui contient un carbone tétraédrique lié à 4 atomes
ou 4 groupes d’atomes tous différents). Quel est le nom du corps A ?
Exercice 6 :
O
Un ester A a pour formule R – C– O – R’. R et R’ étant des radicaux alkyles – CnH2n+1.
La masse molaire de cet ester A est M = 116g /mol. Par hydrolyse de cet ester A, on obtient deux composés un
acide carboxylique B et un alcool C.
1. Écrire l’équation chimique traduisant la réaction d’hydrolyse.
2. On prélève une masse m = 1,5g de l’acide carboxylique B que l’on dilue dans de l’eau pur. La solution
obtenue est dosée par une solution d’hydroxyde de sodium de concentration Cb = 2 mol.L-1. L’équivalence a
lieu lorsqu’on a versé Vb = 12,5cm3 de la solution d’hydroxyde de sodium.
a) Quelle est la molaire du corps B ?
b) Donner sa F.S.D et son nom.
3. Le composé C a pour formule brute C4H10O. Donner ses différents isomères. En déduire les différentes
formules semi-développées possibles pour l’ester A. Donner dans chaque cas le nom de l’ester.
4. L’oxydation de C conduit à un composé D qui donne avec la D.N.P.H un précipité jaune mais il est sans
action sur le réactif de Schiff.
a) Quels sont la formule semi-développée et le nom de D ?
b) Quel est le composé C ?
c) Donner la formule semi-développée de l’ester.
(Wahab Diop) http://physiquechimie.godaddysites.com
Vous aimerez peut-être aussi
- Exposé ZootechnieDocument6 pagesExposé ZootechnieSEDEROPas encore d'évaluation
- Compte Rendu TP 2 COIDocument5 pagesCompte Rendu TP 2 COISchahrazed NOUR100% (5)
- TD-CHIMIE Tle D N°11-SuperDocument2 pagesTD-CHIMIE Tle D N°11-SuperGANDEMAPas encore d'évaluation
- 612a82f9da0c5tp de Chimie Niveau Terminale D Empt BingervilleDocument6 pages612a82f9da0c5tp de Chimie Niveau Terminale D Empt Bingervillemarie liadéPas encore d'évaluation
- TD Ispp 2021-2022Document6 pagesTD Ispp 2021-2022Basile BamaPas encore d'évaluation
- CAHIER D'Exercices ChimieDocument67 pagesCAHIER D'Exercices ChimieAdama MaigaPas encore d'évaluation
- AlcanesDocument2 pagesAlcanesmed-salem9Pas encore d'évaluation
- ANNALE PC EXO de 1SDocument55 pagesANNALE PC EXO de 1Skountiyou92% (13)
- Estérification SerieDocument1 pageEstérification SerieNouhaila ChairPas encore d'évaluation
- 1S ChimieDocument10 pages1S ChimiePFE100% (4)
- Alcanes Renf 2023 atDocument4 pagesAlcanes Renf 2023 atKheicharbi WPas encore d'évaluation
- 1.CH13 TD Familles Molecules OrganiquesDocument11 pages1.CH13 TD Familles Molecules OrganiquesmahadPas encore d'évaluation
- TD Composes Oxygenes 2019 LSLL WahabdiopDocument2 pagesTD Composes Oxygenes 2019 LSLL WahabdiopPaul andre FayePas encore d'évaluation
- TD AlcoolsDocument3 pagesTD AlcoolsnutsugadjifaPas encore d'évaluation
- ExtraitDocument8 pagesExtraitLewis HamiltonPas encore d'évaluation
- Annale ChimieDocument53 pagesAnnale ChimiehamidouPas encore d'évaluation
- Alcools 2023 LSLL - WahabdiopDocument2 pagesAlcools 2023 LSLL - WahabdiopMatty DiopPas encore d'évaluation
- CHIMIE6CDocument5 pagesCHIMIE6CPc-med NouhPas encore d'évaluation
- TD Alcool 2024 LSLL - WahabdiopDocument4 pagesTD Alcool 2024 LSLL - WahabdiopFrédéric JeffersonPas encore d'évaluation
- PC GENE 063 SUJET Exo1 Chi EsterDocument3 pagesPC GENE 063 SUJET Exo1 Chi Esterlunary lockPas encore d'évaluation
- Chimie Organique Fonctionnelle Examen 11Document6 pagesChimie Organique Fonctionnelle Examen 11abdeljelilabdeljelil464Pas encore d'évaluation
- Alcools 2023 Lsll-WahabdiopDocument2 pagesAlcools 2023 Lsll-Wahabdioppapa samba sarrPas encore d'évaluation
- Car Bony Les Alpha-Beta InsaturesDocument7 pagesCar Bony Les Alpha-Beta InsaturesJean-François Abena100% (2)
- Complement de Cours Chapitre 1. Nomenclature PDFDocument17 pagesComplement de Cours Chapitre 1. Nomenclature PDFMorel TegangPas encore d'évaluation
- C2-1S AlcanesDocument2 pagesC2-1S AlcanesSerigne Abdou NiassePas encore d'évaluation
- Fiche Ex 04Document2 pagesFiche Ex 04Dony KravitzPas encore d'évaluation
- TD ALCANE Et TEC 1ère DDocument4 pagesTD ALCANE Et TEC 1ère DNguettia Yao jean Daniel Adou100% (1)
- AttachmentDocument155 pagesAttachmentFabrice KontchouPas encore d'évaluation
- Série 2 Isomérie 2020-2021Document3 pagesSérie 2 Isomérie 2020-2021Ayoub HmPas encore d'évaluation
- Chimie Organique 2014 DR DabiréDocument87 pagesChimie Organique 2014 DR DabiréGaétan YaméogoPas encore d'évaluation
- Série D'exercice 3S ALcools 2018Document3 pagesSérie D'exercice 3S ALcools 2018Ghada Daddou100% (4)
- 6 Exercices Réactions Acido-Basique 1Document1 page6 Exercices Réactions Acido-Basique 1RIDA SAMIPas encore d'évaluation
- LBKG 1718 TL c3 SavonsDocument5 pagesLBKG 1718 TL c3 SavonsMamadou WadePas encore d'évaluation
- Semestre Evoir N de Sciences Physiques H: Exercice 1Document5 pagesSemestre Evoir N de Sciences Physiques H: Exercice 1Mohamed KonatePas encore d'évaluation
- Interro 5 PsDocument1 pageInterro 5 Psaalaska4Pas encore d'évaluation
- Lid / Kaolack 1 S - ANNEE 2023-2024 CP SPDocument3 pagesLid / Kaolack 1 S - ANNEE 2023-2024 CP SPfatoufayediouf654Pas encore d'évaluation
- Exercices 1, Réactions Acido-Basique, Chtoukaphysique - 2Document1 pageExercices 1, Réactions Acido-Basique, Chtoukaphysique - 2boudhar mohamedPas encore d'évaluation
- Capture D'écran . 2023-05-11 À 02.16.46Document3 pagesCapture D'écran . 2023-05-11 À 02.16.46cmamadouidrissaPas encore d'évaluation
- Serie1 Org2-1Document2 pagesSerie1 Org2-1Bibi Biba100% (1)
- Coo NcorDocument4 pagesCoo NcorPFEPas encore d'évaluation
- Acides AminéDocument2 pagesAcides AminéNawel AloulouPas encore d'évaluation
- AlcènesDocument2 pagesAlcènesPFE100% (1)
- TD Composes Oxygenes 1sDocument7 pagesTD Composes Oxygenes 1scmskpd8c6kPas encore d'évaluation
- 1ère CD - APC - Quelques Composés OxygénésDocument5 pages1ère CD - APC - Quelques Composés OxygénésLAWSON NICOLASPas encore d'évaluation
- TD L2 Suite New 2015 2016Document18 pagesTD L2 Suite New 2015 2016Najimou Alade TidjaniPas encore d'évaluation
- TD Amine AcidesCarboxyliques 2020 LSLL - Wahab DDocument4 pagesTD Amine AcidesCarboxyliques 2020 LSLL - Wahab DOumou Khaïry Diop100% (1)
- Chim303atd00 02Document2 pagesChim303atd00 02Kader MilanoPas encore d'évaluation
- TD - Série 3 - (23-24)Document2 pagesTD - Série 3 - (23-24)akashiPas encore d'évaluation
- Serie de TD ChimieDocument5 pagesSerie de TD Chimieraouf teach 04Pas encore d'évaluation
- 2010 CtresEtrang Exo1 Correction Ester Fraise 2 5ptsDocument1 page2010 CtresEtrang Exo1 Correction Ester Fraise 2 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- M.ndoye Alcanes Renf 2023-2024Document2 pagesM.ndoye Alcanes Renf 2023-2024fatouthioune664Pas encore d'évaluation
- TD CH 2 EspoirDocument6 pagesTD CH 2 EspoirRodrigue TchoffoPas encore d'évaluation
- TSEchimie 1ere Periode CHIMIEDocument2 pagesTSEchimie 1ere Periode CHIMIEzefghh134Pas encore d'évaluation
- Serie N°1: Acides Carboxyliques Et Ses Derivees - TS: Nommer Les Composés SuivantsDocument6 pagesSerie N°1: Acides Carboxyliques Et Ses Derivees - TS: Nommer Les Composés SuivantsRom DantePas encore d'évaluation
- C3 Acides Carboxyliques Et DérivésDocument4 pagesC3 Acides Carboxyliques Et DérivésFerdinand MbayePas encore d'évaluation
- Chimie Organique GénéraleDocument39 pagesChimie Organique GénéraleINASSE BOUHAMIDIPas encore d'évaluation
- Top Exos ChimieDocument54 pagesTop Exos ChimieAlban tienouPas encore d'évaluation
- PC 1ère CD L6 Quelques Composés OxygénésDocument4 pagesPC 1ère CD L6 Quelques Composés OxygénésHypolite BAZIEPas encore d'évaluation
- 40 Limites Avec CorrectionDocument2 pages40 Limites Avec CorrectionclaasaalllPas encore d'évaluation
- Serie #8 Passage Entre Les Derives Des Acides CarboxyliquesDocument3 pagesSerie #8 Passage Entre Les Derives Des Acides CarboxyliquesMahmoud Essahbi Sahbi Daghsni100% (2)
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Courschim 2Document40 pagesCourschim 2Firaş BenzaidPas encore d'évaluation
- Chap 11Document11 pagesChap 11danielPas encore d'évaluation
- Boitier Amperemetre Marche Arret Urgence ATEX GRPDocument1 pageBoitier Amperemetre Marche Arret Urgence ATEX GRPachrafPas encore d'évaluation
- Chapitre II (Dégradation)Document13 pagesChapitre II (Dégradation)djidji nanaPas encore d'évaluation
- 3.1 Structure Et Propriétés Des Nucléotides Et Acis NucléiquesDocument39 pages3.1 Structure Et Propriétés Des Nucléotides Et Acis NucléiquessedighdahmanPas encore d'évaluation
- CYCLE TRICARBOXYLIQUE DE KREBS Vers EtudDocument30 pagesCYCLE TRICARBOXYLIQUE DE KREBS Vers EtudLaira ImiPas encore d'évaluation
- Engrais Biologiques Mai 2020Document75 pagesEngrais Biologiques Mai 2020Montassar BouslamaPas encore d'évaluation
- The SeDocument196 pagesThe SeSylia BoukhiarPas encore d'évaluation
- Impression 3d Presentation Generale Ensps - 1Document14 pagesImpression 3d Presentation Generale Ensps - 1richard mpackoPas encore d'évaluation
- BCH 200 ProtidesDocument42 pagesBCH 200 ProtidesTONDI ABDOU CHACOUR100% (1)
- Manya 2Document11 pagesManya 2Jonas lumbuPas encore d'évaluation
- CR Gnosie 2Document25 pagesCR Gnosie 2ludovicungPas encore d'évaluation
- Bio 4 Pour Tous M 76339 p.001-032Document32 pagesBio 4 Pour Tous M 76339 p.001-032louis.p.bernaertPas encore d'évaluation
- Alcènes ExercicesDocument5 pagesAlcènes ExercicesLamine Ould DidiPas encore d'évaluation
- Présentation + PLAN: Fonctionnement de La Pile MicrobienneDocument2 pagesPrésentation + PLAN: Fonctionnement de La Pile Microbienneamounei1303Pas encore d'évaluation
- Copia de Consolidado Registro Plaguicidas Al 2017Document944 pagesCopia de Consolidado Registro Plaguicidas Al 2017javier2rodassPas encore d'évaluation
- Physio DigestDocument77 pagesPhysio DigestElie NyamuhirwaPas encore d'évaluation
- Equilibre Esterification HydrolyseDocument8 pagesEquilibre Esterification HydrolyseHä'deel ÖdenmemişPas encore d'évaluation
- Alcénes - Alcynes 1S1-1S2 AT 22 Renf FinDocument6 pagesAlcénes - Alcynes 1S1-1S2 AT 22 Renf Finpapaaliouba3Pas encore d'évaluation
- Exposé Eaux UséesDocument9 pagesExposé Eaux UséesEmiscorpi Imene100% (3)
- Chapitre 4 Le Soleil Une Source D Energie EssentielleDocument24 pagesChapitre 4 Le Soleil Une Source D Energie EssentielleBouchra BarhouchPas encore d'évaluation
- BAC - C 2021 - Elément de Réponse Et Grille VFDocument12 pagesBAC - C 2021 - Elément de Réponse Et Grille VFMontcho HounlononPas encore d'évaluation
- Partie 1 Cours Phytohormones 01Document11 pagesPartie 1 Cours Phytohormones 01tarek aitPas encore d'évaluation
- Exercice SDocument16 pagesExercice SekaterinafpPas encore d'évaluation
- Etude de Composition Chimique Et Phyto-Chimique D'aloes VeraDocument64 pagesEtude de Composition Chimique Et Phyto-Chimique D'aloes VeraDieuvoulu Asemba Mondenge100% (1)
- Métabolisme Lipidique PDFDocument22 pagesMétabolisme Lipidique PDFMampianina Villa TolojanaharyPas encore d'évaluation
- Le Chevrefeuille Lonicera Caprifolium FR PDFDocument12 pagesLe Chevrefeuille Lonicera Caprifolium FR PDFMarie ChristinePas encore d'évaluation
- 1cm3tpdpg 546507Document3 pages1cm3tpdpg 546507Amadou Makhtar SeckPas encore d'évaluation