Académique Documents
Professionnel Documents
Culture Documents
Sem 06
Transféré par
bissaka Gildas TINKPENACopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Sem 06
Transféré par
bissaka Gildas TINKPENADroits d'auteur :
Formats disponibles
REPUBLIQUE TOGOLAISE
-------------------
Travail-Liberté-Patrie
ECOLE SUPERIEURE DES TECHNIQUES
UNIVERSITE DE LOME BIOLOGIQUES ET ALIMENTAIRES
ESTBA/GEE
COURS DE CHIMIE DE L’EAU :
CARACTERISATION DES EAUX
Janvier 2021
Prof. BAWA L. Moctar
Dr-Ing. AYAH Massabalo
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 0
TABLE DES MATIERES
Sem 06 - ÉQUILIBRES CHIMIQUES ET MATIERES ORGANIQUES DANS L’EAU
II.4. Equilibres Calcocarbonique
II.4.1. Généralités
II.4.2. Equation de neutralité électrique
II.4.3. Différentes formes du carbone minéral dans l’eau en fonction du pH
II.4.4. Agressivité d’une eau
II.4.5. Détermination de l’agressivité d’une eau
II.4.5.1. Equation de Langelier
II.4.5.2. Détermination expérimentale : Essai au marbre
II.4.5.3. Etude graphique de l’équilibre calcocarbonique
II.4.5.4. Correction des eaux agressives
II.4.5.5. Correction des eaux entartrantes
II.5. Composés organiques dans les eaux
II.5.1. Composés carbonés
II.5.2. Composés azotés
II.5.3. Composés phosphorés
II.5.4. Les sources diffuses de contamination : cas des pesticides.
II.5.5. Niveaux de concentration
II.6. Composés inorganiques dans les eaux (éléments traces métalliques)
II.6.1. Origines naturelles
II.6.2. Origines artificielles
II.6.3. Formes des éléments métalliques dans les eaux
II.7. Normes de qualité des eaux
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 1
Sem 06 - ÉQUILIBRES CHIMIQUES ET MATIERES ORGANIQUES DANS L’EAU
II.4. Equilibres Calcocarbonique
II.4.1. Généralités
Il y’a un grand nombre d’équilibres auxquels participent les sels dissous. Cependant,
l’équilibre calcocarbonique qui met en jeu les éléments fondamentaux est très
important pour plusieurs applications en traitement des eaux.
II.4.2. Equation de neutralité électrique
Dans les eaux naturelles, l’équation de neutralité électrique relie les concentrations des
éléments fondamentaux et des éléments caractéristiques des eaux.
∑équivalent cations = ∑équivalent anions
Forme réduite de l’équation : [H3O+] + 2 [Ca2+] + P = [OH-] + 2 [CO32-] + [HCO3-] + N
P = ∑cations caractéristiques et N = ∑anions caractéristiques
On peut avoir selon les types d’eau : N = P ; N > P ; ou N < P.
a) Relation entre les éléments fondamentaux : Constantes d’équilibre : ke’, k1’ ; k2’ ; ks’
- Ionisation de l'eau :
2H2O H3O+ + OH- (E1)
(E1) ke’ =
- Dissociation du CO2 (CO2, H2O ou CO3) dans l'eau :
H2CO3+ H2O H3O+ + HCO3- (E2)
HCO3- + H2O H3O+ + CO32- (E3)
(E2) k1’ =
(E3) k2’ =
- Dissociation du carbonate de calcium : CaCO3 Ca2+ + CO32- (E4)
(E4) ks’ =
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 2
b) Variation des constantes : Toutes ces constantes varient en fonction de la
température et de la force ionique de l'eau.
- Variation en fonction de la température pour une force ionique constante. Pour I = 0,
on a pke, pk1, pk2, pks = f(T°C).
T °C pke pk1 pk2 pks
0 14,940 6,583 10,627 8,022
10 14,526 6,475 10,490 8,151
20 14,167 6,393 10,377 8,280
25 14,000 6,366 10,329 8,342
30 13,836 6,345 10,290 8,395
40 13,537 6,314 10,220 8,514
50 13,263 6,297 10,172 8,625
- Variation des constantes en fonction de la force ionique pour une température
donnée. La force ionique (I) caractérise l'intensité des forces d'interaction qui s’exercent
entre les ions présents dans une solution.
I = ½∑Ci.Zi2 avec Ci : la concentration de l'ion i (mol/L) et Zi : sa valence.
Connaissant la valeur de la force ionique on calcule le coefficient de correction (ε) des
constantes d'équilibre :
= I
1+1.4 I
Puis on calcule les valeurs corrigées des constantes :
pke’ = pke - ε
pk1’ = pk1 - ε
pk2’= pk2 - 2ε
pks’= pks - 4ε
Avec pke ; pk1 ; pk2 ; pks les constantes à T °C et pour I = 0
Exemple : Calculer les valeurs corrigées des constantes à 30 °C en considérant les
solutions aqueuses suivantes :
1) Solution de NaCl à 10-3 M
2) Solution de CaSO4 à 10-3 M.
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 3
II.4.3. Différentes formes du carbone minéral dans l’eau en fonction du pH
On veut connaître la répartition du carbone minéral (CO2diss) suivant les valeurs du pH :
% [H2CO3] ; [HCO3-] ; [CO32-] = f(pH)
Cmin = (CO2)total = [H2CO3] + [HCO3-] + [CO32-]
A partir des constantes k1’ et k2’ et du pH on peut connaître la répartition de ces
différentes formes.
On montre que :
Cmin = (CO2)total =
% [H2CO3] =
% [HCO3-] =
% [CO32-] =
Diagramme de répartition (Cminé = f(pH))
pK1 ½[pK1-pk2] pK2
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 4
On observe que :
* pH < 4 Tout le Cminé est sous forme H2CO3
* 4 < pH < 8 [CO32-] = 0 ; on a H2CO3 et HCO3- en équilibre
et quand pH = pk1' = 6,3 On a [H2CO3] = [HCO3-] = 50 %
* pH > 8 [H2CO3] = 0 on a CO32- et HCO3- en équilibre
et quand pH = pk2' = 10,3 On a [CO32-] = [HCO3-] = 50 %
Remarque : Les eaux naturelles ont un pH compris entre 6,5 < pH < 8,5 caractérisée par
l’équilibre H2CO3 et HCO3-
II.4.4. Agressivité d’une eau
Dans l'eau le bicarbonate de calcium tend à perdre le CO2 et à précipiter le carbonate de
calcium. Cet état est traduit par l’équilibre suivant :
1
Ca(HCO3)2 CaCO3 + H2CO3 (CO2, H2O)
2
D’après cette équation, pour que les bicarbonates de calcium restent en solution, il doit
être en équilibre avec une certaine quantité de CO2 libre appelé CO2 équilibrant.
Distribution du CO2 dans l’eau
* (CO2) libre = (CO2) équilibrant Equilibre Calco-Carbonique
* (CO2) libre > (CO2) équilibrant Eau agressive
* (CO2) libre < (CO2) équilibrant Eau entartrante ou incrustante
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 5
II.4.5. Détermination de l’agressivité d’une eau
II.4.5.1. Equation de Langelier
A partir des expressions de pk2’ et pkS’, on détermine le pH que devrait avoir l'eau
pour être en équilibre Calcocarbonique : le pH de saturation de l’eau. On montre que :
pHs = pk2’ - pkS’ - log([Ca2+]) - log([HCO3-])
Connaissant le pH mesuré de l’eau (pHm).
* pHm = pHs Equilibre Calco - Carbonique
* pHm < pHs Eau agressive
* pHm > pHs Eau entartrante ; incrustante
II.4.5.2. Détermination expérimentale : Essai au marbre
Cet essai part du principe selon lequel si une eau est agressive, en la mettant en contact
avec une eau saturée de carbonate de calcium, on observe une dissolution de la phase
solide.
Cette dissolution s’accompagne d’une augmentation de pH et d’un accroissement de
dureté calcique et d’alcalinité de l’eau. Ainsi, on compare les valeurs (pHm, TCai et TACi)
avant l’essai et (pHs, TCaf et TACf) après l’essai.
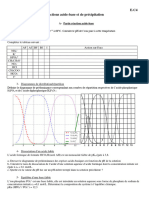
II.4.5.3. Etude graphique de l’équilibre calcocarbonique
Plusieurs diagrammes permettent d’étudier l’équilibre calcocarbonique d’une eau. On
peut citer : Hoover-Langelier, Hallopeau et Dubin, Legrand et Poirier, Thillmans, …
Il existe également des logiciels informatiques qui permettent d’étudier l’équilibre
calcocarbonique d’une eau.
Example 1 : Diagramme de Hoover-Langelier
C’est l’exploitation graphique de l’équation de Langelier. Ce diagramme permet de
déterminer graphiquement le pH de saturation d’une eau.
Données nécessaires :
- TAC en mgCaCO3/L ; - TDS ou Salinité en mg/L ;
- Tca en mg/L ; - Température en °C.
Le nomogramme comprend 5 colonnes :
- Colonne III Terme pk2’ – pkS’
- Colonne V Ligne de pivot
- Colonne IV Terme log(Ca2+)
- Colonne VII Valeur de pHs
- Colonne VI Terme log (HCO3-)
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 6
Utilisation du diagramme
- Par les valeurs de température et de salinité totale, on marque le terme pk’2 - pk’s sur
la colonne 1.
- Par une droite, joindre cette valeur à la valeur mesurée de Ca2+ sur la colonne 3. Cette
droite coupe la ligne pivot en un point M.
- Par une droite, joindre le point M de la ligne pivot au point correspondant à l’alcalinité
sur la colonne 5. Cette droite coupe la colonne 4 en un point indiquant la valeur de pHs.
Application 1 : Déterminer le pHs d’une eau dont les caractéristiques sont les suivantes :
Température = 30°C Ca2+ = 35 mg/L
Salinité totale = 480 mg/L TAC = 40 mgCaCO3/L
Example 2 : Diagramme de Hallopeau et Dubin
Ce diagramme permet de situer l’eau par rapport à l’équilibre calcocarbonique et de
déterminer les teneurs de CO2 (total, libre, équilibrant, agressif). Ce diagramme permet
également de déterminer les doses de réactifs alcalins de neutralisation.
Données nécessaires :
- Température en °C - TAC en mgCaCO3/L ou mgCaO/L
- pH - TCa en mgCaCO3/L ou mgCaO/L
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 7
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 8
Utilisation du diagramme
Une eau est représentée par deux points :
- Le premier point sur le diagramme principal P1 (TAC, pH)
- Le deuxième point sur le diagramme auxiliaire P2 (TAC/Ca2+, T°C)
- Tracer une droite parallèle à la droite de saturation de référence et passant par P2. On
a la droite de saturation de l’eau.
- Si P1 est en dessous de la droite de saturation, l’eau est agressive,
- Si P1 est au-dessus de la droite de saturation, l’eau est entartrante.
- Tracer une verticale passant par P1, cette droite coupe la droite de saturation de l’eau
et un point Ps.
- L’ordonnée de Ps donne le pHs de l’eau.
- Les teneurs en CO2 sont données par les droites obliques passant par P1 (CO2 libre) et
par Ps (CO2 équilibrant).
Remarque : L’exploitation des courbes de neutralisation (chaux et calcaire) nécessite
l’emploi de deux diagrammes identiques dont l’un est sur du papier calque.
Application 2 : Une eau présente les caractéristiques suivantes :
pH = 7.0 Température = 25°C
TAC = 12 °f Calcium = 16.7 °f.
- Situer l’eau par rapport à l’équilibre calcocarbonique
- Déterminer le pHs
- Déterminer CO2 libre, CO2 équilibrant et CO2 agressif.
II.4.5.4. Correction des eaux agressives
a) Les méthodes Physiques : On peut corriger les eaux agressives par voie physique ou
par voie chimique.
Les méthodes physiques consistent à élimination du CO2 par aération. Cette méthode
est intéressante dans le cas des eaux très chargées en CO2. Les méthodes utilisées sont
nombreuses.
- Méthodes par ruissellement
- Méthode par cascade
- Méthodes par insufflation d’air comprimé.
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 9
a) Les méthodes chimiques : Elles consistent à neutralisation le CO2 en excès par des
bases. On utilise la soude, la chaux, le calcaire ou le carbonate de sodium.
Dose
- Emploi de la soude Réactifs
(mg/mg de CO2 agressif)
H2CO3 + NaOH NaHCO3 + H2O Soude 0,91
- Emploi de la chaux
H2CO3 + Ca(OH)2 Ca(HCO3)2 + 2 H2O Chaux 0,84
- Emploi du calcaire
H2CO3 + CaCO3 Ca(HCO3)2 Calcaire 2,3
- Emploi du carbonate de sodium
H2CO3 + Na2CO3 2 NaHCO3 Carbonate de Na 2,4
Remarque :
- L’application de ces différents réactifs entraîne une modification des caractéristiques
de l’eau (Conductivité électrique, pH, TAC, Ca2+…).
- Le choix des réactifs dépend de plusieurs facteurs comme les considérations
techniques (mise en œuvre) et commerciales (Disponibilité sur le marché, coûts).
II.4.5.5. Correction des eaux entartrantes
Ce traitement permet d'éviter les dépôts de tartres. On emploie en général les acides
forts ou l’injection du CO2 comprimé :
- Emploi de l’acide chlorhydrique
2HCl + Ca(HCO3)2 2H2CO3 + CaCl2
- Emploi de l’acide sulfurique
H2SO4 + Ca(HCO3)2 2 H2CO3 + CaSO4
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 10
II.5. Composés organiques dans les eaux
Les eaux naturelles contiennent divers composés organiques pouvant provenir de deux
origines :
Origine naturelle : substance humiques et constituants cellulaires (sucres lipides, acides
aminés, protéines…)
Substances organiques provenant des activités humaines à l’échelle domestique,
agricole ou industriel comme les tensioactifs, les hydrocarbures, les pesticides…
On distinguera la micropollution carbonée, la micropollution azotée et la micropollution
phosphorée.
II.5.1. Composés carbonés
La présence de la matière organique d’origine naturelle résulte des mécanismes
suivants :
- des apports de matières organiques naturelles
- de la transformation du carbone minéral en carbone organique
- de la transformation du carbone organique en carbone minéral
On rencontre principalement les composés organiques des constituants cellulaires
comme les lipides et les carbohydrates. Les substances humiques constituent également
une fraction très importante
a) Lipides : constitués par les phospholipides et les glycolipides
- Lipides simples
- Phospholipides
- Glycolipides)
b) Carbohydrates : 15 à 35 % du poids sec des microorganismes et 60 à 90 % dans les
plantes)
- Monosaccharides
- Disaccharides
- Polysaccharides
- Amidon ; cellulose ; ...
c) Les substances Humiques (acides humiques et acides fulviques) : Proviennent de
l’humification des détritus animaux et végétaux. Elles représentent une classe très
importante de la matière organique dans les eaux naturelles. Les substances humiques
renferment dans leur structure des groupements hydroxyles, carboxyliques ou méthoxy
reliés par des chaînes aliphatiques.
Remarques : Les composés organiques introduits dans les eaux naturelles par les
activités domestiques, agricoles ou industrielles sont extrêmement variés et sont
généralement de faibles concentrations (µg/l ou ng/L).
On évalue la teneur du carbone dans les eaux par la mesure du COT (carbone organique
total), du COD (carbone organique dissout) et du COA (carbone organique assimilable).
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 11
II.5.2. Composés azotés
Les principaux constituants organiques azotés d’origine naturelle qu’on peut rencontrer
dans les eaux sont essentiellement les acides aminés, les protéines, les peptides (ADN,
ARN), les enzymes, les chlorophylles, : La forme minérale est représentée par l’azote
moléculaire, l ‘ammonium, les nitrites et les nitrates.
a) Minéral
- Ammoniac et sels ammoniacaux
- Nitrites
- Nitrates
b) Organoazotés
- Acides aminés
- Protéines
- Nucléotides
- Acides nucléiques (ADN ; ARN)
- Chlorophylles
c) Composés organiques de synthèse : Proviennent des activités de l’homme.
- Produits hytosanitaires
- Produits pharmaceutiques
- Détergents
- Engrais
- Colorants
- Inhibiteur de corrosion
II.5.3. Composés phosphorés
Le phosphore provient des roches apatites et du phosphore dissout provenant de la
matière vivante ou morte.
Outre les composés organophosphorés on peut citer
- Adénosine triphosphate (ATP)
- Flavine adénine dinucléotide (FAD)
- Coenzyme A
- Nicotinamide adénine dinucléotide (NAD+)
Les apports de phosphore résultant des activités humaines domestiques, industrielles
ou agricoles ont les origines suivantes :
- Eaux résiduaires urbaines (3 à 4 g P/ha/j)
- Effluents industriels (agroalimentaires, industries de synthèse d’engrais)
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 12
- Agriculture (engrais et pesticides organophosphorés
II.5.4. Les sources diffuses de contamination : cas des pesticides.
Les pesticides sont des composés organiques essentiellement de synthèse et très variés.
On peut citer les herbicides, les insecticides, les fongicides et les rodenticides.
Les sources sont d’origine
- Agricole
- Industriel
- Transfert de polluants atmosphériques
La source la plus importante est d’origine agricole. La pollution par les pesticides touche
aussi bien les eaux superficielles que les eaux souterraines.
Exemples :
- Insecticides : pyréthrines, lindane, parathion
- Herbicides : atrazine, simazine, monuron
- Fongicides : pentachlorophénol, manèbe
- Rodenticides : warfarine
Le danger de ces produits vient de leur dispersion dans la nature et de leur
accumulation dans les organismes vivants qui, à travers les chaînes alimentaires
finissent par concerner l’homme.
II.5.5. Niveaux de concentration
Le tableau suivant donne les ordres de grandeur des concentrations des grandes classes
de composés et leur participation au Carbone Organique Dissout (COD) dans les eaux
naturelles.
Composés Concentrations % COD
Substances Humiques 2 à 10 mg/L 40 - 60
Carbohydrates 100 à 500 µg/L 5 - 10
Acides carboxyliques 100 à 600 µg/L 5-8
Acides aminés 100 à 300 µg/L 2-3
Hydrocarbures 1 à 10 µg/L 0,5 - 1
Remarque : Les composés à l’état de trace : Aldéhydes ; cétones ; alcools ; éthers ;
chlorophylles ; stérols ; composés organiques soufrés ...
II.6. Composés inorganiques dans les eaux (éléments traces métalliques)
Les composés métalliques dans les eaux naturelles proviennent des origines naturelles
et des origines artificielles. Ces composés ont des concentrations très variées.
II.6.1. Origines naturelles
Apports par les matériaux constitutifs de l’écorce terrestre. Ces apports peuvent être
directe par contact entre les eaux et les matériaux ou indirecte par l’intermédiaire des
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 13
particules atmosphériques arrachées aux roches par érosion ou par des poussières des
éruptions volcaniques ou des micrométéorites. Les apports directs sont les plus
importants.
Exemple : Le fer et le manganèse sont parmi les éléments les plus abondants dans
l’écorce terrestre (5 % pour le fer et 0.1% pour le manganèse). La teneur du plomb dans
la croûte terrestre est de l’ordre de 8 à 20 ppm celle du cadmium est de l’ordre de 0.2
mg/kg.
Apports dus à la décomposition des matières vivantes d’origine animale ou végétale.
Ces apports sont plus faibles que les précédents.
II.6.2. Origines artificielles
On note deux sources principales.
a) Sources ponctuelles
Les rejets dans les eaux de surface d’effluents industriels (extraction et raffinage des
métaux, galvanoplastie…) et le lessivage des sols en zone urbaine par les eaux de
ruissellement sont les principales sources ponctuelles.
b) Sources diffuses.
Elles sont nombreuses et on peut citer par exemple :
- La dispersion dans l’atmosphère par les phénomènes de combustion à l’échelle
domestique ou industriel.
- La dispersion à la surface par des fertilisant qui peuvent contenir des métaux même à
l’état de trace.
II.6.3. Formes des éléments métalliques dans les eaux
Dans les eaux naturelles, les métaux peuvent se trouver sous forme de composés
dissous, sous forme de matière colloïdale ou encore sous forme de matières en
suspension.
- Les formes colloïdales et en suspension se trouvent sous deux formes.
- Sels insolubles (silicates, sulfures, oxydes, hydroxydes…)
- Matière organique ou argiles dans lesquelles les métaux sont fixés par adsorption,
échange d’ion ou par complexation.
- Les métaux dissous sont sous formes d’ions simples ou complexés ou sous forme de
chélates et de complexes organométalliques.
Le pH et le potentiel redox contrôlent la solubilisation et la répartition des espèces
métalliques dans l’eau.
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 14
II.7. Normes de qualité des eaux
Il existe des normes de qualité des eaux. Ces normes dépendent des usages de l’eau.
Exemples :
• Normes des eaux naturelles (grille de classification)
• Normes des eaux destinées à la production d’eau de consommation
• Normes des eaux de consommation (après traitement)
• Normes des eaux de loisirs
• Normes des eaux pour usages agricoles et pisciculture….
Les qualités requises sont forcément différentes selon que l’eau est utilisée pour la
production d’eau potable, pour la pisciculture, la baignade ou pour la production de la
vapeur d’eau.
Par exemple, en France, on a défini une grille de qualité pour chacun des usages (la grille
multiusage). Elle comporte 5 classes de qualité.
Classe 1 A : Elle caractérise les eaux considérées comme exemptes de pollution, ces
eaux sont aptes à satisfaire les usages les plus exigeants en qualité.
Classe 1B : D’une qualité légèrement moindre que la classe 1A, ces eaux peuvent
néanmoins satisfaire à tous les usages.
Classe 2 : Eau de qualité passable. Elle peut servir à la production d’eau potable, à
l’irrigation…
Classe 3 : Eaux de qualité médiocre, aptes à l’irrigation.
Hors classe : Eau dépassant la valeur maximale tolérée en classe 3 pour un ou plusieurs
paramètres. Elles sont considérées comme inaptes à la plupart des usages et peuvent
constituer une menace pour la santé publique et l’environnement.
Pour les eaux destinées à la consommation humaine, l’eau traitée, avant sa distribution
doit satisfaire certaines conditions.
Il existe pour chaque pays ou sous-région, des normes ou des directives de qualité
(OMS). On parle de CMA (concentration maximale admissible) ou de NG (nombre guide)
pour certains paramètres.
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 15
Exemple 1 : CRITERES DE POTABILITE PHYSICO-CHIMIQUE DES EAUX DE
CONSOMMATION
Directives de l’UE
Directives Normes
Paramètres Nombre Guide
OMS françaises Conc. maxi
(NG)
Turbidité (NTU) ˂5 - - -
Odeur - qualitative - - - -
Saveur - qualitative - - - -
pH 6,5-8,5 6,5 – 8,5 6,5-8,5 9,5
Température (°C) - 25 12 25
Conduc. élect. à 25°C (µS/cm) - 40 40 -
Alcalinité (TA & TAC) - °f - - - -
Carbonate (CO32-) - mg/L 100 150 - 150
Bicarbonate (HCO3-) - mg/L ˃30 (NG) - ˃30 -
Dureté (TH) - °f ˃15 - 60 ˃15
Calcium (Ca2+) - mg/L 10 (NG) - 10 -
Magnésium (Mg2+) - mg/L 50 50 30 50
Sodium (Na+) - mg/L 20 150 20 150
Potassium (K+) - mg/L - 12 10 12
Fe T(Fe2+,Fe3+) - mg/L 0,3 0,2 0,05 0,2
Manganèse (Mn2+) - mg/L 0,5 - - 0,05
Ammonium (NH4+) - mg/L 1,5 0,5 0,05 0,5
Chlorures (Cl-) - mg/L 250 20 25 250
Nitrates (NO3-) - mg/L 50 50 25 50
Nitrite (NO2 -) - mg/L 3 0,1 - 0,1
Sulfates (SO42-) - mg/L 40 250 25 250
Silice (SiO2) - mg/L - - - -
Orthophosphate . (PO43-) mg/L - - - -
Oxydabilité au KMnO4 (mg O2/L) - 5 2 5
Chlore résiduel libre (mgCl2/L) ≤ 0,5 ≤ 0,1 - -
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 16
Exemple 2 : QUELQUES PARAMETRES SELON LA DIRECTIVES UE DU 15/07/80
Paramètres CMA NG
Couleur 20 mg/L 1 mg/L
Turbidité 10 NTU 1 mg/L
Conductivité - 400 mg/L
Chlorures 200 mg/L 20 mg/L
Nitrates 50 mg/L 25 mg/L
Nitrites 0.1 mg/L -
Ammonium 0.5 mg/L 0.05 mg/L
Oxy. KMnO4 5 mg/L 2 mg/L
Fer 0.2 mg/L 0.05 mg/L
Manganèse 0.05 mg/L 0.02 mg/L
Cadmium 0.05 mg/L -
Pesticides 0.5 g/L -
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 17
Exemple 3 : GRILLE DE QUALITE DES EAUX DE SURFACE
CLASSE 1 CLASSE 2 CLASSE 3 CLASSE 4 CLASSE 5
N° Paramètres
Unités Excellente Bonne Moyenne Mauvaise Très mauvaise
Organoleptiques …………. ……………. ……………. ………………… ……………… …………………
01 Couleur (échelle Pt) mgPt/L < 20 20 - 50 50 - 100 100 - 200 > 200
02 Odeur (dilu à 25° C) subjective <3 3 - 10 10 - 20 > 20 -
Physico-chimiques …………. ……………. ……………. ………………… ……………… …………………
03 Température °C < 20 20 - 25 25 - 30 30 - 35 > 35
04 PH upH 6,5 - 8,5 6,5-8,5 6,5 - 9,2 < 6,5/ > 9,2 < 6,5 ou > 9,2
05 Conductivité à 20° C µS/cm < 750 750-1300 1300 - 2700 2700 - 3000 > 3000
06 Chlorures (Cl-) mg/L < 200 200-300 300 - 750 750 - 1000 > 1000
07 Sulfates (SO42-) mg/L < 100 100-200 200 - 250 250 - 400 > 400
08 MES mg/L < 50 50-200 200 - 1000 1000 - 2000 > 2000
09 O2 dissous mg/L >7 7-5 5-3 3-1 <1
10 DBO5 mg/L <3 3-5 5 - 10 10 - 25 >25
11 DCO mg/L < 30 30-35 35 - 40 40 - 80 >80
12 Oxydabilité KMnO4 mg/L ≤2 2-5 5 - 10 > 10 -
Substances Indésirables …………. ……………. ……………. ………………… ……………… ……………………
13 Nitrates (NO3-) mg/L ≤ 10 10-25 25 - 50 > 50 -
14 NTK mgN/L ≤1 1-2 2-3 >3 -
15 Ammonium mg/L ≤ 0,1 0,1-0,5 0,5 - 2 2-8 >8
16 Baryum mg/L ≤ 0,1 0,1-0,7 0,7 - 1 >1 -
17 Phosphates (PO43-) mg/L ≤ 0,2 0,2-0,5 0,5 - 1 1-5 >5
18 P total (Pt) mg/L ≤ 0,1 0,1-0,3 0,3 - 0,5 0,5 - 3 >3
19 Fe total (Fe) mg/L ≤ 0,5 0,5-1 1-2 2-5 >5
20 Cuivre (Cu) mg/L ≤ 0,02 0,02-0,05 0,05 - 1 >1 -
21 Zinc (Zn) mg/L < 0,5 0,5-1 1-5 >5 -
22 Manganèse (Mn) mg/L ≤ 0,1 0,1-0,5 0,5 - 1 >1 -
23 Fluorure (F-) mg/L ≤ 0,7 0,7-1 1 - 1,7 >1,7 -
24 Hydrocarbures mg/L ≤ 0,05 0,05-0,2 0,2 - 1 >1 -
25 Phénols mg/L ≤ 0,001 10-3-5.10-3 0,005 - 0,01 > 0,01 -
26 Détérgents anioniques mg/L ≤ 0,2 ≤ 0,2 0,2 - 0,5 0,5 - 5 >5
Substances Toxiques …………. ……………. ……………. ………………… ……………… …………………
27 Arsenic (As) µg/L ≤ 10 ≤ 10 10 -50 > 50 -
28 Cadmium (Cd) µg/L ≤3 ≤3 3-5 >5 -
29 Cyanures (CN-) µg/L ≤ 10 ≤ 10 10-50 > 50 -
30 Chrome total (Cr) µg/L ≤ 50 ≤ 50 ≤ 50 > 50 -
31 Plomb (Pb) µg/L ≤ 10 ≤ 10 10-50 > 50 -
32 Mercure (Hg) µg/L ≤1 ≤1 <1 >1 -
33 Nickel (Ni) µg/L ≤ 20 ≤ 20 20-50 > 50 -
34 Selenium (Se) µg/L ≤ 10 ≤ 10 ≤ 10 > 10 -
35 Pesticides par subst µg/L ≤ 0,1 ≤ 0,1 ≤ 0,1 > 0,1 -
36 Pesticides totaux µg/L ≤ 0,5 ≤ 0,5 ≤ 0,5 > 0,5 _
Bactériologiques …………. ……………. ……………. ………………… ……………….. …………………
38 Coliformes fécaux UFC /100ml ≤ 20 20 - 2000 2.103 - 2.104 > 20,000 -
39 Coliformes totaux UFC /100ml ≤ 50 50 - 5000 5. 103 - 5. 103 > 50,000 -
40 Streptoco. Fécaux UFC /100ml ≤ 20 20 - 1000 103 - 104 > 10.000 -
Biologie …………. ……………. ……………. ………………… ……………….. …………………
41 Chlorophylle a µg/L < 2,5 2,5 - 10 10 - 30 30 - 110 > 110
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 18
Exemple 4 : GRILLE DE QUALITE DES EAUX DESTINEES A LA PRODUCTION DE L'EAU POTABLE
A1 A2 A3
N° Catégorie →
G I G I G I
Paramètres organoleptiques
1 Couleur mgPt/L 10 20 50 100 50 200
2 Odeur à 25°C Subjective 3 - 10 - 20 -
Physico-chimiques
3 Température °C 20 30 20 30 20 30
4 PH upH 6,5-8,5 - 6,5-9,2 - 6,5-9,2 -
5 Cond, à 20°C μS/cm 1300 2700 1300 2700 1300 2700
6 Chlorures (Cl-) mg/L 300 750 300 750 300 750
7 Sulfates (SO42-) mg/L 200 - 200 - 200 -
8 MES mg/L 50 - 1000 - 2000 -
9 Oxygène dissous mgO2/L 7(90%) - 5(70%) - 3(50%) -
10 DBO5 mgO2/L 3 - 7 - 10 -
11 DCO mgO2/L - - 25 - 40 -
12 Oxydabilité KMnO4 mgO2/L 2 - 5 - 10 -
Substances indésirables
13 Bore mg/L - 1 - 1 - 1
14 Ammonium mgNH4/L 0,05 0,5 1 1,5 2 4
15 NTK mgN/L 1 - 2 - 3 -
16 Nitrates (NO3) mg/L - 50 - 50 - 50
17 Phosphores mgP2O5/L 0,4 - 0,7 - 0,7 -
18 Baryum mg/L - 1 - 1 - 1
19 Cuivre (Cu) mg/L - 1 - 1 - 1
20 Zinc (Zn) mg/L - 5 - 5 - 5
21 Manganèse mg/L - 0,1 0,1 0,1 1 -
22 Fer dissous (Fe) mg/L - 0,3 1 2 1 3
23 Fluorures (F) mg/L 0,7 1,5 0,7 1,5 0,7 1,5
24 Hydrocarbures mg/L - 0,05 - 0,2 0,5 1
26 Phénols mg/L - 0,001 - 0,005 - 0,01
27 Détérg anioniques mg/L - 0,5 - 0,5 - 0,5
13 Bore mg/L - 1 - 1 - 1
Substances toxiques
28 Arsenic (As) μg /L - 50 - 50 - 100
29 Cadmium (Cd) μg /L 1 5 1 5 1 5
30 Chrome total (Cr) μg /L - 50 - 50 - 50
31 Plomb (Pb) μg /L - 50 - 50 - 50
32 Mercure μg /L - 1 - 1 - 1
33 Sélénium (Se) μg /L - 10 - 10 - 10
34 Nickel (Ni) μg /L - 50 - 50 - 50
35 Cyanures (CN-) μg /L - 50 - 50 - 50
36 Pesticide par subst μg /L - 0,1 - 0,1 - 0,1
37 Pesticides totaux μg /L - 0,5 - 0,5 - 0,5
38 HAP μg /L - 0,2 - 0,2 - 0,2
Paramètres bactériologiques
39 Coliformes fécaux /100ml 20 - 2000 - 20000 -
40 Coliformes totaux /100ml 50 - 5000 - 50000 -
41 Streptocoques fécaux /100ml 20 - 1000 - 10000 -
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 19
PrBLM/Dr-Ing.AM Cours chimie de l’eau : Caractérisation des Eaux 2019 20
Vous aimerez peut-être aussi
- Chapitre 5 - Equilibre Calco - Carbonique de L'eauDocument37 pagesChapitre 5 - Equilibre Calco - Carbonique de L'eauSara Qrm80% (5)
- Série Des Exercices en Chimie Des Eaux 2021Document5 pagesSérie Des Exercices en Chimie Des Eaux 2021Bøũdįāf Khäwlå100% (3)
- Spe Physique Chimie 2021 Zero 1 Sujet OfficielDocument11 pagesSpe Physique Chimie 2021 Zero 1 Sujet OfficielChahid OUAAZIZIPas encore d'évaluation
- TP Dosage Ions HydrogenocarbonateDocument3 pagesTP Dosage Ions Hydrogenocarbonatefszkd2mgg9Pas encore d'évaluation
- DST TS 2020Document37 pagesDST TS 2020Kenza MiraPas encore d'évaluation
- Examen Blanc N°2 Du Baccalauréat Année: 2020Document8 pagesExamen Blanc N°2 Du Baccalauréat Année: 2020Mehdi AgPas encore d'évaluation
- Equilibre Calco-Carbonique (Enregistrement Automatique)Document33 pagesEquilibre Calco-Carbonique (Enregistrement Automatique)Mouniratou Nazé100% (1)
- Simili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023Document10 pagesSimili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023SABOUR MOHAMMEDPas encore d'évaluation
- NC003 - Neutralisation Et Reminéralisation Des Eaux AgressivesDocument7 pagesNC003 - Neutralisation Et Reminéralisation Des Eaux AgressivesTCHIMOUPas encore d'évaluation
- Ecole Nationale Supérieure Polytechnique de MarouaDocument4 pagesEcole Nationale Supérieure Polytechnique de MarouaNative Emerick Kokea TielaPas encore d'évaluation
- E.C4 - Réaction Acide Base Et de PrécipitationDocument4 pagesE.C4 - Réaction Acide Base Et de Précipitationnoamassin78Pas encore d'évaluation
- 2 2020 Tle SPE Sujetzero Exo1 Sujet CaptureCO2 4ptsDocument2 pages2 2020 Tle SPE Sujetzero Exo1 Sujet CaptureCO2 4ptsalbert einschteinPas encore d'évaluation
- Spe Physique Chimie 2021 Metropole 2 CorrigeDocument11 pagesSpe Physique Chimie 2021 Metropole 2 CorrigeChahid OUAAZIZIPas encore d'évaluation
- Entrainement. Bac - Blanc - RemovedDocument22 pagesEntrainement. Bac - Blanc - RemovedMouad BouizzouPas encore d'évaluation
- Spe Physique Chimie 2021 Metropole 2 Sujet OfficielDocument13 pagesSpe Physique Chimie 2021 Metropole 2 Sujet OfficielChahid OUAAZIZIPas encore d'évaluation
- Annales Chimie Des EauxDocument17 pagesAnnales Chimie Des EauxMourad Rabah100% (2)
- Notions de Chimie de LeauDocument142 pagesNotions de Chimie de Leaunaoual baghliPas encore d'évaluation
- TD04Document2 pagesTD04Ñäḑ ĴoqĶễrPas encore d'évaluation
- MP CHIMIE CCP 1 2013.enonceDocument7 pagesMP CHIMIE CCP 1 2013.enonceMohssine ElaissaouiPas encore d'évaluation
- 2nde PARTIE A TP 8Document2 pages2nde PARTIE A TP 8sandra.le.duPas encore d'évaluation
- Chimie: Epreuve Specifique - Filiere MPDocument6 pagesChimie: Epreuve Specifique - Filiere MPZAguirPas encore d'évaluation
- TD Système Des Carbonates EnoncéDocument3 pagesTD Système Des Carbonates EnoncéwalidPas encore d'évaluation
- AlcalinitéDocument2 pagesAlcalinitéAlkatel Al HanounePas encore d'évaluation
- Exos21 Acides BasesDocument4 pagesExos21 Acides BasesSohaib LaminePas encore d'évaluation
- Chimie Des Eaux - L2 - TD N°1Document4 pagesChimie Des Eaux - L2 - TD N°1cosinus50% (2)
- 2021 03 Metro Sujet2 ExoA Aquarium 10ptsDocument4 pages2021 03 Metro Sujet2 ExoA Aquarium 10ptsYassinePas encore d'évaluation
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Sujet Eau 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- 2010 AmNord Exo1 Sujet Eau 6 5ptsDocument3 pages2010 AmNord Exo1 Sujet Eau 6 5ptsHarakat ElhoucinePas encore d'évaluation
- TD 07-08Document43 pagesTD 07-08Farid Kikani100% (1)
- Exam B Dec 2021Document2 pagesExam B Dec 2021Carmel BABAPas encore d'évaluation
- TransReaAcideBaseExercices 16-17 PDFDocument7 pagesTransReaAcideBaseExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- TD Corrigé c222-BCG-S2Document37 pagesTD Corrigé c222-BCG-S2ïLÿãsPas encore d'évaluation
- TD 07-08Document43 pagesTD 07-08Oumarou KontaPas encore d'évaluation
- 2021 03 Metro Sujet2 Exo1 Aquarium 10pts CorrectionDocument8 pages2021 03 Metro Sujet2 Exo1 Aquarium 10pts Correctionzebi IncomprisPas encore d'évaluation
- Devoir HydrogeochimieDocument12 pagesDevoir HydrogeochimieSoo 16Pas encore d'évaluation
- Analyse Des Eaux DDocument8 pagesAnalyse Des Eaux DAmira ZedPas encore d'évaluation
- DS02Document9 pagesDS02baatoutmbPas encore d'évaluation
- Prob 10Document10 pagesProb 10Dounia ChahidPas encore d'évaluation
- Détermination Du C02 Libre Des Eaux Courantes en Pratique Écologique Par Une Méthode Mixte de Mesure, Acidimétrique Et GraphiqueDocument23 pagesDétermination Du C02 Libre Des Eaux Courantes en Pratique Écologique Par Une Méthode Mixte de Mesure, Acidimétrique Et GraphiquedorianesegdaPas encore d'évaluation
- Epreuve Chimie 1 Preparation Au CNC 2021Document7 pagesEpreuve Chimie 1 Preparation Au CNC 2021Meriem El AbzazePas encore d'évaluation
- TD1 023 024Document7 pagesTD1 023 024ilyesfares49Pas encore d'évaluation
- Sujet Chimie FMSB 2004Document10 pagesSujet Chimie FMSB 2004Bile DjetouanPas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- Tac TaDocument5 pagesTac TaDana SalasPas encore d'évaluation
- TD 3 + TD 4 +TD 5 (Chimie 2)Document4 pagesTD 3 + TD 4 +TD 5 (Chimie 2)Albert SamaPas encore d'évaluation
- TD2 L3PCDocument2 pagesTD2 L3PCpgerbaud8Pas encore d'évaluation
- Chapitre IV-Equilibre Calcocarbonique-CDocument8 pagesChapitre IV-Equilibre Calcocarbonique-CSafa HAISSOUNAPas encore d'évaluation
- D'après Le Site: Bac S 2015 Liban Exercice Ii. Une Piscine Naturelle ChaufféeDocument4 pagesD'après Le Site: Bac S 2015 Liban Exercice Ii. Une Piscine Naturelle Chaufféesaber mimiPas encore d'évaluation
- DS1 2022-2023 Sujet Corrige BaremeDocument10 pagesDS1 2022-2023 Sujet Corrige Baremearnaud.bedouinPas encore d'évaluation
- TAC - Titre Alcalimétrique CompletDocument8 pagesTAC - Titre Alcalimétrique Completabderrahimn67% (3)
- Chimie Élément CobaltDocument2 pagesChimie Élément Cobalttcheva jokhanan TiambiPas encore d'évaluation
- Examen5 Réactivité Chimique FST-MeknèsDocument19 pagesExamen5 Réactivité Chimique FST-Meknèsyakubuojonugwa32Pas encore d'évaluation
- 2009 Antilles Exo3 Sujet EauDistillee PH 4ptsDocument2 pages2009 Antilles Exo3 Sujet EauDistillee PH 4ptsMalak El jadiriPas encore d'évaluation
- Exercices Révision GénéraleDocument3 pagesExercices Révision Généraleklunx0% (1)
- TD 4 La ThermochimieDocument12 pagesTD 4 La ThermochimiekoumaPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Glucides: Les Grands Articles d'UniversalisD'EverandGlucides: Les Grands Articles d'UniversalisPas encore d'évaluation
- Télédétection de l'eau: Progrès des techniques de vision par ordinateur pour la télédétection de l’eauD'EverandTélédétection de l'eau: Progrès des techniques de vision par ordinateur pour la télédétection de l’eauPas encore d'évaluation
- 3.chapitre 3 - CopieDocument26 pages3.chapitre 3 - CopieBadreddine BouzaraPas encore d'évaluation
- Equilibre Acido-Basique PolycopiéDocument9 pagesEquilibre Acido-Basique PolycopiéAnouar BenguegaPas encore d'évaluation
- Transfert de Matiere ExposeDocument10 pagesTransfert de Matiere ExposeOusmane Ibro boubéPas encore d'évaluation
- Devoir Maison 1 S2Document4 pagesDevoir Maison 1 S2labiadsihame73Pas encore d'évaluation
- La Technologie Du Beton Basf PDFDocument138 pagesLa Technologie Du Beton Basf PDFC.E.B.I MAROCPas encore d'évaluation
- MA300 Ions 12Document20 pagesMA300 Ions 12Meziane BouktitPas encore d'évaluation
- ch2 - Atouts - Électricité - Partie II - GroupeDocument3 pagesch2 - Atouts - Électricité - Partie II - GroupeHoda AMENZOUPas encore d'évaluation
- Pras Olivier 2011 VFDocument261 pagesPras Olivier 2011 VFATTAH Régis Patrick AusséPas encore d'évaluation
- الفيزياء والكيمياء - شعبة العلوم التجريبية مسلك علوم الحياة والأرض (خيار فرنسية) المكيف - الموضوع-1Document20 pagesالفيزياء والكيمياء - شعبة العلوم التجريبية مسلك علوم الحياة والأرض (خيار فرنسية) المكيف - الموضوع-1ennassikiPas encore d'évaluation
- Corps Purs Et MélangesDocument3 pagesCorps Purs Et MélangesMaría Pilar Sierra LabartaPas encore d'évaluation
- Tp1 RéacteurDocument8 pagesTp1 RéacteurÄyyoüb El-BchiriPas encore d'évaluation
- Le Phonographe-1929Document102 pagesLe Phonographe-1929JacquescutterPas encore d'évaluation
- Entretien Et Reparation Des Ouvrages D'artDocument97 pagesEntretien Et Reparation Des Ouvrages D'artkaka lotyPas encore d'évaluation
- Maj Liste Positive Additifs Version FR Du 22-01-2024Document233 pagesMaj Liste Positive Additifs Version FR Du 22-01-2024kfmetalkPas encore d'évaluation
- TP DibenzilidèneacétoneDocument8 pagesTP DibenzilidèneacétoneAMI INEPas encore d'évaluation
- 7 Réactions Acido-BasiquesDocument8 pages7 Réactions Acido-BasiquesMed yahyaPas encore d'évaluation
- TD N°1 S5 - SVI Biologie MoléculaireDocument3 pagesTD N°1 S5 - SVI Biologie Moléculaireawatif errPas encore d'évaluation
- Controle 1 s1 1bac SM 2023 Prof - Elhamri (WWW - Pc1.ma)Document2 pagesControle 1 s1 1bac SM 2023 Prof - Elhamri (WWW - Pc1.ma)Qamin100% (1)
- T.P.2: Dco, Dbo Demande Chimique en OxygèneDocument8 pagesT.P.2: Dco, Dbo Demande Chimique en OxygèneABDELRAHMEN KHORCHANIPas encore d'évaluation
- Série Est-Hyd-Loi D'action de MasseDocument3 pagesSérie Est-Hyd-Loi D'action de Masseأسماء النخليPas encore d'évaluation
- QCM Corrigées de Biologie Cellulaire - Coursdemedecine - Free-HDocument23 pagesQCM Corrigées de Biologie Cellulaire - Coursdemedecine - Free-Hdeadbysunrisee85% (47)
- TD 2Document3 pagesTD 2Benjamin FiavePas encore d'évaluation
- Brochure Publicitaire Majdoline MejdiDocument2 pagesBrochure Publicitaire Majdoline MejdiMejdoline MejdiPas encore d'évaluation
- YepDocument256 pagesYepDumas TchibozoPas encore d'évaluation
- CHAPITRE I - Notions de CristallographieDocument14 pagesCHAPITRE I - Notions de Cristallographiekgu yryrtyPas encore d'évaluation
- Dosage-2Document4 pagesDosage-2hammadi hassine0% (1)
- PR151.0-43.01procédure de Qualification Du PH-mètreDocument8 pagesPR151.0-43.01procédure de Qualification Du PH-mètreBenrabah AbderrahmanePas encore d'évaluation
- Lot 19 Ravalement Enduits Ite PerpignanDocument9 pagesLot 19 Ravalement Enduits Ite PerpignanAEMa CCCPas encore d'évaluation
- Coursdedroi Tdesobli Gati Onsi: Cycledeli Cenceendroi TDocument44 pagesCoursdedroi Tdesobli Gati Onsi: Cycledeli Cenceendroi TLionel nkoloPas encore d'évaluation
- Cannabis FDocument64 pagesCannabis FKhaïda KarismatikPas encore d'évaluation