Académique Documents
Professionnel Documents
Culture Documents
Insert IGF1 - FR - 313231 - 17
Transféré par
LeïlaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Insert IGF1 - FR - 313231 - 17
Transféré par
LeïlaDroits d'auteur :
Formats disponibles
DiaSorin S.p.A.
Via Crescentino snc - 13040 Saluggia (VC) - Italy
|
www.diasorin.com
Modifications : § 11
Suppressions : § 4
Section : Matériel nécessaire, mais non fourni (relatif au système) :
LIAISON® Light Check ([REF] 319101)
LIAISON ® IGF-I ( [REF] 313231)
1. UTILISATION
Dosage in vitro pour la détermination quantitative de l’IGF-I (Insulin-like Growth Factor I) dans le sérum humain. Le dosage doit être réalisé
sur les automates de la gamme LIAISON® Analyzer.
2. INTÉRÊT CLINIQUE
Le facteur de croissance analogue à l’insuline de type I (IGF-I, également appelé somatomédine C ou Sm-C) est un polypeptide à chaîne
unique de 70 acides aminés. C’est un facteur trophique présent à des concentrations élevées dans la circulation sanguine, qui médie une
grande partie des effets de l’hormone de croissance, sinon la plupart. L’IGF-I est principalement synthétisé dans le sang par le foie, qui est
riche en récepteurs GH, mais également dans de nombreux autres tissus sensibles à son action trophique. L’IGF-I a une structure
tridimensionnelle similaire à celle de l’insuline.
L’IGF-I fait partie d’une classe de peptides dont les concentrations sériques sont principalement stimulées par l’hormone de croissance
humaine (human growth hormone, GH) et retardées par la malnutrition. Chez les humains, 2 peptides ont été identifiés : l’IGF-I et l’IGF-II.
Dans le sérum, une grande partie de l’activité GH-dépendante stimulant la croissance est imputable à l’IGF-I. Les effets anaboliques et
stimulant la croissance médiés par les IGF incluent la prolifération cellulaire et la synthèse des protéines.
L’IGF-I agit sur presque toutes les cellules de l’organisme humain, en particulier celles des muscles, des os, du foie, des reins, des nerfs, de la
peau et des poumons. Outre ses effets analogues à ceux de l’insuline, l’IGF-I peut aussi réguler la croissance et le développement des cellules,
en particulier des cellules nerveuses, ainsi que la synthèse de l’ADN cellulaire. La sécrétion d’IGF-I dure toute la vie. Elle atteint un maximum lors
des poussées de croissance pendant la puberté. Les taux les plus bas sont observés pendant la petite enfance et chez les personnes âgées.
On a constaté que l’IGF-I influençait la structure et les fonctions neuronales tout au long de la vie. Des études expérimentales ont montré qu’il
était capable de préserver la fonction des cellules nerveuses et de stimuler la croissance nerveuse. De par ces propriétés, l’IGF-I humain
recombinant est utilisé dans les essais cliniques pour le traitement de la sclérose latérale amyotrophique (SLA).
L’IGF-I humain recombinant a récemment fait son entrée sur le marché des compléments alimentaires, de même que l’hormone de croissance
humaine recombinante et plusieurs substances appelées sécrétagogues ou libérateurs d’hormone de croissance.
L’IGF-I en complément alimentaire a éventuellement des effets anaboliques et lipolytiques mais le mécanisme d’action est inconnu.
Dans le sang, les IGF sont liés à des protéines de transport. Ces protéines de liaison sont indubitablement responsables des concentrations
d’IGF-I relativement élevées dans le sang et de l’absence de fluctuations relativement rapides. Du fait de cette stabilité relative de la concentration
d’IGF-I dans le sang, le dosage de l’IGF est un indicateur fiable de la sécrétion de l’hormone de croissance (GH), alors que les concentrations de
GH elles-mêmes varient considérablement et que des tests de provocation sont souvent nécessaires pour pouvoir les interpréter.
Utilisation comme test de diagnostic
La concentration d’IGF-I dans le sang peut être mesurée à partir de 10-1000 ng/mL.
Étant donné que sa concentration varie très peu tout au long de la journée, l’IGF-I est utilisé pour le dépistage du déficit et de l’excès d’hormone
de croissance.
L’IGF-I comme agent thérapeutique
L’IGF-I est un éventuel neuroprotecteur impliqué dans la lutte contre les effets indésirables de la sclérose latérale amyotrophique (SLA).
Utilisé en complément alimentaire, on attribue à l’IGF-I des propriétés anti-vieillissement, le développement de la masse musculaire maigre,
une amélioration des performances sportives et sexuelles, la protection des articulations, des propriétés antidiabétiques, antiathérosclérotiques,
neuroprotectrices, somnifères, le renforcement des défenses immunitaires, et bien d’autres effets encore. Aucune preuve crédible n’étaye
toutefois ces revendications pour l’IGF-I en prise orale. Des concentrations élevées d’IGF-I ont été associées à une augmentation du risque de
plusieurs cancers, en particulier du cancer de la prostate.
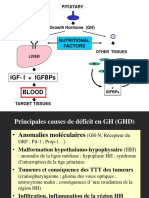
Concentrations faibles :
La concentration d’IGF-I est systématiquement basse chez les enfants déficients en GH (hypopituitarisme). L’injection de GH la fait
augmenter. En général, une concentration normale chez un enfant de petite taille est fortement en défaveur d’un diagnostic de déficit en GH,
en particulier chez les enfants âgés de 5-6 ans. À cet âge, des concentrations anormalement basses peuvent être différenciées de la normale.
Les taux sériques peuvent être bas chez les enfants déficients en GH qui présentent un craniopharyngiome. Même si un taux normal
suggère une absence de déficit en GH, un taux bas chez un enfant présentant un retard de croissance ne permet pas de conclure à un
hypopituitarisme.
Concentrations augmentées :
Les concentrations sériques d’IGF-I sont augmentées de manière fiable et prévisible chez les patients atteints d’acromégalie et chez
les enfants atteints de gigantisme en raison d’un excès d’hormone de croissance hypophysaire chez les enfants.
Des concentrations sériques d’IGF-I élevées chez les adolescents doivent toutefois être interprétées avec prudence car il est normal qu’elles
soient élevées pendant la puberté : pendant cette période, elles peuvent être 4 à 5 fois plus élevées que chez les adultes.
La grossesse est également associée à des concentrations sériques élevées.
Les maladies rares caractérisées par l’incapacité à produire l’IGF-I ou à répondre à l’IGF-I sont responsables d’un type d’anomalie de croissance
appelé nanisme de Laron, qui répond mal à un traitement par l’hormone de croissance.
LIAISON® IGF-I ([REF] 313231)
1 / 10 FR - 17 - 2015-10-13
3. PRINCIPE DU DOSAGE
La méthode de détermination quantitative de l’IGF-I est un dosage immunologique par chimiluminescence de type sandwich (CLIA) en une
seule étape, qui est effectué après la séparation de l’IGF-I des protéines de liaison. Un anticorps monoclonal est utilisé pour revêtir des
particules magnétiques (phase solide) et un autre anticorps monoclonal est lié à un dérivé de l’isoluminol (conjugué anticorps-isoluminol).
Pendant l’incubation, l’IGF-I présent dans les étalons, les échantillons ou les contrôles se lie à la phase solide et au conjugué.
Après l’incubation, le matériel non lié est éliminé par un cycle de lavage.
Ensuite, la réaction de chimiluminescence débute par l’injection automatique des réactifs Starter dans les modules réactionnels.
Le signal lumineux, et par conséquent la quantité de conjugué d’isoluminol, est mesuré au moyen d’un photomultiplicateur en RLU
(RLU, relative light units), et indique la concentration d’IGF-I présente dans les étalons, les échantillons ou les contrôles.
4. MATÉRIEL FOURNI
L’ordre des réactifs est le même que celui des compartiments du réactif Integral.
Réactif Integral pour 100 déterminations
2,3 mL [SORB] Suspension de particules magnétiques : contenant des particules magnétiques revêtues d’un anticorps
monoclonal anti-IGF-I (6B) (souris), de la SAB (sérumalbumine bovine) et de l'azide de sodium à 0,09 %
12,0 mL [CONJ] Conjugué : contenant un anticorps monoclonal anti-IGF-I (2D 557112) (souris) marqué par un dérivé de
l’isoluminol, de la SAB (sérumalbumine bovine) et de l'azide de sodium à 0,09 %
18,0 mL [BUF|N] Tampon de neutralisation : contenant l’IGF-II (humain, recombinant), de la SAB (sérumalbumine bovine) et de
l'azide de sodium à 0,09 %
28,0 mL [BUF|Ac] Solution d’acidification : contenant 0,01 Mol HCl
Tous les réactifs sont fournis prêts à l’emploi.
Les éléments suivants sont inclus avec le réactif Integral :
3 x 1,0 mL [CAL|1] Étalon bas : contenant l’IGF-I (humain, recombinant) dans de la SAB
®
(sérumalbumine bovine), et du ProClin 300 à 0,1 %
3 x 1,0 mL [CAL|2] Étalon haut : contenant l’IGF-I (humain, recombinant) dans de la SAB
®
(sérumalbumine bovine), et du ProClin 300 à 0,1 %
8 x blanche [CAL|1] Pour étiqueter les tubes d'étalon aliquoté
Étiquette à code-barres, petite
8 x blanche [CAL|2] Pour étiqueter les tubes d'étalon aliquoté
Étiquette à code-barres, petite
Les étalons sont fournis lyophilisés.
Matériel nécessaire, mais non fourni (relatif au système)
®
Automate LIAISON XL Analyzer Automate LIAISON® Analyzer
®
LIAISON Wash/System Liquid ([REF] 319100) LIAISON® Wash/System Liquid ([REF] 319100)
LIAISON® XL Waste Bags ([REF] X0025) LIAISON® Waste Bags ([REF] 450003)
LIAISON® XL Cuvettes ([REF] X0016) LIAISON® Module ([REF] 319130)
®
LIAISON XL Starter Kit ([REF] 319200) LIAISON® Starter Kit ([REF] 319102) ou LIAISON® XL Starter Kit ([REF] 319200)
®
LIAISON XL Disposable Tips ([REF] X0015) LIAISON® Cleaning Kit ([REF] 310990)
®
LIAISON Light Check 12 ([REF] 319150)
Matériel supplémentaire nécessaire
®
LIAISON IGF-I Control ([REF] 319134)
5. PRÉCAUTIONS D’UTILISATION
Réservé à un usage diagnostique in vitro.
Toutefois, puisqu’il n’est pas possible de garantir l’absence totale d’agents pathogènes, tout matériel d’origine humaine doit être considéré
comme potentiellement infectieux et doit être manipulé avec précaution.
6. RÈGLES DE SÉCURITÉ
Ne pas manger, ni boire, ni fumer ou se maquiller pendant le dosage.
Ne pas pipeter avec la bouche.
Éviter tout contact direct avec l'ensemble du matériel potentiellement infectieux en portant des vêtements de laboratoire, des lunettes de
protection et des gants à usage unique.
Se laver soigneusement les mains à la fin de chaque dosage.
Éviter de provoquer des éclaboussures ou des vaporisations. Si cela arrivait, chaque goutte de réactif biologique doit être nettoyée avec une
solution d'hypochlorite de sodium contenant 0,5 % de chlore actif et le moyen utilisé doit être traité comme un déchet infectieux.
Tous les échantillons et les réactifs contenant du matériel biologique utilisés pour effectuer le test doivent être considérés comme susceptibles
de transmettre des agents infectieux. Les déchets doivent être manipulés avec précaution et être éliminés conformément aux directives du
laboratoire ainsi qu'aux dispositions réglementaires en vigueur dans chaque pays.
Le matériel réutilisable doit être stérilisé de manière appropriée conformément à la législation et aux directives locales.
Vérifier l'efficacité du cycle de stérilisation/décontamination.
Ne pas utiliser de trousses ou de composants dont la date figurant sur l'étiquette est dépassée.
LIAISON® IGF-I ([REF] 313231)
2 / 10 FR - 17 - 2015-10-13
Réactifs contenant de l'azide de sodium (< 0,1 %) [CE No : 247-852-1] :
DIRECTIVE CE No 1272/2008
MENTIONS DE DANGER/RISQUE EUH 210 - Fiche de données de sécurité disponible sur demande
®
Réactifs contenant du ProClin :
DIRECTIVE CE No 1272/2008
RÉACTIFS [CAL|1] [CAL|2]
CLASSIFICATION DE LA SUBSTANCE Sensibilisation cutanée, Catégorie 1
MENTION D'AVERTISSEMENT Avertissement !
SYMBOLES/PICTOGRAMMES
SGH07 – Point d’exclamation
MENTIONS DE DANGER/RISQUE H317 – Peut provoquer une allergie cutanée.
P261 – Éviter de respirer les brouillards ou les aérosols.
P280 – Porter des gants et des vêtements de protection, et un équipement
CONSEILS DE PRUDENCE/ SÉCURITÉ
de protection des yeux.
P363 – Laver les vêtements contaminés avant réutilisation.
CONTIENT :
masse de réaction de :
(uniquement les substances prescrites
5-chloro-2-méthyl-4-isothiazolin-3-one [CE No 247-500-7] et
conformément à l'article 18 du règlement
2-méthyl-2H-isothiazol-3-one [CE No 220-239-6] (3:1) (ProClin® 300).
CE 1272/2008).
7. PRÉPARATION DES RÉACTIFS
7.1. Réactif Integral
Suivre scrupuleusement les précautions suivantes concernant la manipulation des réactifs :
Pour garantir les performances correctes du dosage, agiter par rotation ou retourner le réactif Integral avec précaution avant de le placer sur
l'automate d'immunoanalyse. En présence d'une éventuelle floculation dans les réactifs Integral, s'assurer de sa disparition complète avant de
placer le réactif Integral à bord de l'automate d'immunoanalyse. Éviter la formation de mousse.
Remise en suspension des particules magnétiques
Les particules magnétiques doivent être remises en suspension intégralement avant de placer le réactif Integral dans l’automate. Suivre les
étapes indiquées ci-après afin de garantir la mise en suspension complète des particules :
Avant d’ôter les opercules des compartiments, agiter légèrement le compartiment des particules magnétiques à l’aide de la molette jusqu’à ce
que la solution soit marron. Le fait d’agiter horizontalement le réactif Integral doucement et avec soin favorisera la suspension des particules
magnétiques (éviter cependant la formation de mousse). Contrôler visuellement le fond du compartiment des particules magnétiques pour
s’assurer que toutes les particules sédimentées ont été effectivement remises en suspension. Si nécessaire, répéter la procédure jusqu’à ce
que toutes les particules magnétiques aient été remises en suspension. Retirer les opercules et essuyer doucement la surface de chaque
septum pour éliminer le liquide résiduel.
Formation de mousse dans les réactifs
Pour garantir les prestations optimales du réactif Integral, il est indispensable d’éviter toute formation de mousse. Observer les recommandations
suivantes afin d’empêcher la formation de mousse :
Avant toute utilisation du réactif Integral, contrôler visuellement les réactifs et notamment les étalons pour exclure la présence de mousse.
Si après la remise en suspension des particules magnétiques il y a formation de mousse, placer le réactif Integral dans l’automate et laisser la
mousse se disperser. Le réactif Integral est prêt à l’emploi lorsqu’il a été laissé au repos à l’intérieur de l’automate, lorsque les particules
magnétiques sont maintenues en agitation automatiquement et que la mousse a été entièrement dispersée.
Chargement du réactif Integral dans le compartiment à réactifs de l’automate d’immunoanalyse
Automate LIAISON® Analyzer
Placer le réactif Integral dans le compartiment à réactifs de l’automate d’immunoanalyse, en veillant à ce que l’étiquette à code-barres soit
à gauche, et attendre 30 minutes avant utilisation. Pendant cette période, les particules magnétiques sont agitées et remises en suspension
automatiquement.
Se reporter au manuel d’utilisation de l’automate pour charger les échantillons et démarrer le test.
Automate LIAISON® XL Analyzer
L’automate LIAISON® XL Analyzer est pourvu d’un dispositif magnétique interne, à l’état solide, qui favorise la dispersion des microparticules
avant de placer un réactif Integral dans le compartiment à réactifs de l’automate d’immunoanalyse. Se reporter au manuel d’utilisation de
l’automate d’immunoanalyse pour avoir des renseignements détaillés.
Placer le réactif Integral dans la rainure prévue à cet effet.
Laisser reposer le réactif Integral à l’intérieur du dispositif magnétique à l’état solide pendant au moins 30 secondes (et jusqu’à plusieurs
minutes). Répéter l’opération si nécessaire.
Placer le réactif Integral dans le compartiment à réactifs de l’automate d’immunoanalyse, en veillant à ce que l’étiquette soit à gauche, et attendre
15 minutes avant utilisation. Pendant cette période, les particules magnétiques sont agitées et remises en suspension automatiquement.
Se reporter au manuel d’utilisation de l’automate pour charger les échantillons et démarrer le test.
LIAISON® IGF-I ([REF] 313231)
3 / 10 FR - 17 - 2015-10-13
7.2. Étalons
Les étalons de la trousse LIAISON® IGF-I sont fournis lyophilisés.
Reconstituer à l’aide de 1,0 mL d’eau désionisée ou distillée.
Laisser reposer les flacons pendant 10 minutes à environ 18-25 °C.
Agiter délicatement les flacons par inversion. Éviter la formation de mousse.
Si nécessaire, aliquoter les étalons comme indiqué au paragraphe 8 et étiqueter les tubes avec les petites étiquettes blanches fournies.
Pour obtenir des détails sur l’utilisation des étalons, consulter le manuel d’utilisation de l’automate d’immunoanalyse.
Consulter le paragraphe 8 pour la conservation des étalons.
7.3. Contrôles
Consulter les instructions de la trousse LIAISON® IGF-I Control pour la préparation et la manipulation adéquates des contrôles.
8. CONSERVATION ET STABILITÉ DES RÉACTIFS
8.1. Réactif Integral
Non ouvert : stable à 2-8 °C jusqu’à la date de péremption.
Ouvert : à bord de l’automate d'immunoanalyse ou à 2-8 °C : stable pendant 4 semaines (voir § 12).
Au terme de ce délai, il est possible d’utiliser le réactif Integral si les contrôles restent dans les limites attendues.
®
Toujours utiliser le même automate d’immunoanalyse LIAISON Analyzer pour un réactif Integral déjà ouvert.
Ne pas congeler.
Le réactif Integral est à conserver verticalement afin de faciliter la remise en suspension des particules magnétiques.
Utiliser le portoir de stockage fourni avec les automates de la gamme LIAISON® Analyzer pour la conservation du réactif Integral en position
verticale.
Conserver à l’abri de toute lumière directe.
8.2. Étalons
Lyophilisés : Stables à 2-8 °C jusqu’à la date de péremption.
Reconstitués : Stables pendant 1 jour à bord de l’automate d’immunoanalyse.
Congelés : Les parties aliquotes peuvent être conservées à -20 °C pendant un mois maximum.
Immédiatement après la reconstitution, les étalons peuvent être aliquotés et congelés. Les étalons doivent être utilisés le jour où ils ont été
décongelés. Le volume minimum d’une partie aliquote est de 210 µL (60 µL d’étalon + 150 µL de volume mort).
Les parties aliquotes ne peuvent être congelées et décongelées qu’une seule fois.
Lors de la manipulation des étalons, prendre les précautions nécessaires pour éviter la contamination bactérienne.
9. PRÉLÈVEMENT ET PRÉPARATION DES ÉCHANTILLONS
Le seul type d’échantillon validé est le sérum humain.
Recueillir le sérum conformément aux méthodes établies. Éviter toute hémolyse. Avant le dosage, décongeler avec soin, agiter les échantillons
décongelés et éliminer les bulles d’air le cas échéant. Les échantillons décongelés doivent être conservés à 2-8 °C et utilisés dans les 6 heures.
Si le test n’est pas effectué le jour du prélèvement de l’échantillon, séparer le sérum du sédiment et le conserver dans un tube distinct à -20 °C.
Ne pas utiliser des échantillons fortement hémolysés ou lipémiques, ni des échantillons contenant des particules en suspension ou présentant
une contamination microbienne évidente.
Ne pas utiliser les échantillons coagulés.
Éviter les cycles de congélation et de décongélation répétés. Éliminer les résidus de chaque partie aliquote utilisée pour le dosage.
Le volume minimum d’échantillon nécessaire pour une analyse est de 170 µL (20 µL d’échantillon + 150 µL de volume mort).
La solution d’acidification fournie dans le réactif Integral est uniquement validée pour un usage dans le cadre d’une prédilution. Aucun diluant
n’est fourni pour les échantillons dont la concentration excède l’intervalle du dosage.
10. ÉTALONNAGE
L’utilisation des solutions d’étalonnage spécifiques à chaque dosage permet d’ajuster les valeurs mesurées en unités relatives de luminescence
(RLU) sur la courbe maîtresse attribuée. Une solution d’étalonnage permet d’effectuer jusqu’à 11 étalonnages (au total).
Les étalons doivent être utilisés uniquement avec le lot de réactif Integral auquel ils correspondent. Ne pas utiliser d'étalons qui
correspondent à un lot de réactif Integral différent dans le même dosage. Pour garantir la bonne correspondance entre les lots,
le numéro de lot de l'étalon est également imprimé sur l'étiquette du réactif Integral.
Le ré-étalonnage en triplets est obligatoire chaque fois qu’au moins une des conditions suivantes s’applique :
- Un nouveau lot de réactifs Integral ou de réactifs Starter est utilisé.
- Le dernier étalonnage a été effectué il y a plus de 14 jours.
- L’automate d’immunoanalyse a subi un entretien.
- Les valeurs des contrôles sont en dehors des limites attendues.
®
Automate LIAISON Analyzer : les valeurs des étalons sont enregistrées dans les codes-barres de l’étiquette du réactif Integral.
®
Automate LIAISON XL Analyzer : les valeurs des étalons sont enregistrées dans l’étiquette d’identification par radiofréquence (Radio Frequency
IDentification transponder, étiquette RFID).
11. PROCÉDURE DE DOSAGE
Afin d’assurer les performances optimales du dosage, suivre attentivement les instructions contenues dans le manuel d’utilisation de l’automate
d’immunoanalyse.
Automate LIAISON® Analyzer : tous les paramètres du dosage sont identifiés par les codes-barres figurant sur l’étiquette du réactif Integral.
Si l'étiquette à code-barres ne peut être lue par l'automate d'immunoanalyse, ne pas utiliser le réactif Integral. Ne pas jeter le réactif Integral ;
contacter votre assistance technique DiaSorin locale pour obtenir des instructions.
®
Automate LIAISON XL Analyzer : tous les paramètres du dosage sont identifiés par les informations codées dans l'étiquette d'identification
par radiofréquence (Radio Frequency IDentification transponder, étiquette RFID) du réactif Integral. Si l'étiquette RFID ne peut être lue par
l'automate d'immunoanalyse, ne pas utiliser le réactif Integral. Ne pas jeter le réactif Integral ; contacter votre assistance technique DiaSorin
locale pour obtenir des instructions.
LIAISON® IGF-I ([REF] 313231)
4 / 10 FR - 17 - 2015-10-13
L’automate LIAISON® Analyzer exécute les opérations suivantes :
Pré-traitement automatique (1:20)
1. Distribution de l’échantillon ou des contrôles dans le module de réaction
2. Distribution de la solution d’acidification
3. Distribution de l’échantillon dilué, des contrôles dilués ou de l’étalon dans le module de réaction
4. Distribution des particules magnétiques revêtues (phase solide), du tampon de neutralisation et du conjugué
5. Incubation
6. Lavage avec le Wash/System Liquid
7. Ajout du réactif Starter et mesure de la lumière émise
L’automate LIAISON® XL Analyzer exécute les opérations suivantes :
Pré-traitement automatique (1:20)
1. Distribution de l’échantillon ou des contrôles dans la cuvette de réaction
2. Distribution de la solution d’acidification
3. Distribution du tampon de neutralisation, des particules magnétiques revêtues (phase solide) et du conjugué
4. Distribution de l’échantillon dilué, des contrôles dilués ou de l'étalon dans la cuvette de réaction
5. Incubation
6. Lavage avec le Wash/System Liquid
7. Ajout du réactif Starter et mesure de la lumière émise
12. CONTRÔLE DE QUALITÉ
Les contrôles LIAISON® sont à analyser en simple pour évaluer la performance du test. Le contrôle de qualité peut être effectué en utilisant le
sérum de contrôle LIAISON® ou les contrôles dédiés du commerce :
- au moins une fois par jour de travail,
- chaque fois qu’un nouveau réactif Integral est utilisé,
- chaque fois que la trousse est étalonnée,
- chaque fois qu’un nouveau lot de réactifs Starter est utilisé,
- pour vérifier les performances d’un Integral ouvert depuis plus de 4 semaines,
- ou conformément aux recommandations ou aux exigences des réglementations locales ou organisations accréditées.
Les valeurs des contrôles doivent être comprises dans les limites attendues : à chaque fois que l’un des contrôles est en dehors des limites
attendues, l’étalonnage doit être refait et les contrôles doivent être testés à nouveau. Si les valeurs des contrôles se trouvent à plusieurs
reprises en dehors des limites prédéfinies après l’étalonnage, le test doit être répété en utilisant un flacon de contrôle neuf. Si les valeurs des
contrôles sont en dehors des limites attendues, les résultats ne sont pas à reporter.
La performance d’autres contrôles doit être évaluée pour s’assurer de leur compatibilité avec ce test avant utilisation. Il est donc essentiel
d’établir les intervalles de valeurs appropriés pour le matériel de contrôle de qualité employé.
13. INTERPRÉTATION DES RÉSULTATS
L’automate d’immunoanalyse calcule automatiquement les concentrations d’IGF-I des échantillons exprimées en ng/mL. Se reporter au manuel
d’utilisation de l’automate LIAISON® pour avoir des renseignements détaillés.
Les étalons et les contrôles peuvent donner des résultats différents de concentration ou en unités relatives de luminescence (RLU, relative
light units) sur les automates d’immunoanalyse LIAISON® et LIAISON® XL, mais les résultats des patients sont équivalents.
13.1. Intervalle de dosage :
L’automate d’immunoanalyse calcule automatiquement les concentrations d’IGF-I jusqu’à 1500 ng/mL.
Facteur de conversion :
1 ng/mL x 0,13 = 0,13 nmol/L
1 nmol/L x 7,69 = 7,69 ng/mL
13.2. Norme de référence
Le dosage se réfère à la 1st WHO International Standard for Insulin-like Growth Factor-I (1ère norme internationale de l’OMS pour le facteur
de croissance analogue à l’insuline de type I), code NIBSC : 02/254.
Les résultats sont exprimés en ng/mL.
13.3. Valeurs de référence
Afin de déterminer les valeurs de référence de base en fonction de l'âge et du sexe, une étude a été réalisée avec le dosage LIAISON IGF-I
chez 4419 individus (2813 patients pédiatriques et 1606 patients adultes) issus d'une population apparemment en bonne santé.
Les valeurs de référence centrales à 95 % ont été établies conformément à la directive du CLSI C28-A3 et en appliquant la méthode de
lissage des centiles de Royston-Wright. Les résultats, exprimés en ng/mL, sont intégralement rapportés dans les tableaux et graphiques au
paragraphe 15.11.
Il est recommandé à chaque laboratoire d'établir sa propre plage de valeurs escomptées pour la population prise en compte.
LIAISON® IGF-I ([REF] 313231)
5 / 10 FR - 17 - 2015-10-13
14. LIMITES DU DOSAGE
Les réactifs de la trousse ne doivent être utilisés que dans les automates de la gamme LIAISON® Analyzer.
Les composants individuels des réactifs ne doivent en aucun cas être séparés du réactif Integral.
La trousse ne doit pas être utilisée au-delà de la date de péremption figurant sur l’étiquette extérieure.
Afin d’obtenir des résultats fiables, il faut suivre strictement le mode opératoire et effectuer les manipulations de façon appropriée.
La contamination bactérienne des échantillons ou leur inactivation par la chaleur peuvent modifier les résultats du test.
Cependant, un résultat non-pathologique n’exclut pas toujours la possibilité d’une anomalie de croissance et doit être interprété en association
avec d’autres explorations diagnostiques.
Les résultats du test sont indiqués de façon quantitative. Cependant, le diagnostic d’une maladie de croissance ne doit pas être établi d’après
le résultat d’un seul dosage, mais en prenant également en considération les investigations cliniques et l’avis d’un médecin. Toute décision
d’ordre thérapeutique doit être prise au cas par cas.
Bien qu’il existe des agents pouvant neutraliser les anticorps anti-souris (HAMA, human anti-mouse antibodies), des concentrations de HAMA
très élevées peuvent parfois influencer les résultats du dosage.
Les réactifs Integral ne peuvent pas être échangés entre les différents types d’automates (LIAISON® et LIAISON® XL). Une fois qu’un réactif
Integral a été introduit dans un type d’automate particulier, il doit toujours être utilisé sur cet automate jusqu’à épuisement. En raison des
problèmes de traçabilité qui découlent de l’affirmation ci-avant, le suivi des patients ne doit pas être effectué sur différents types d’automates.
® ®
Il doit toujours être effectué sur le même type d’automate (soit LIAISON , soit LIAISON XL).
15. CARACTÉRISTIQUES DU DOSAGE
15.1. Spécificité analytique
La spécificité analytique est définie comme la capacité du test à détecter exactement l’analyte en présence de facteurs pouvant interférer
dans la matrice de l’échantillon.
15.2. Interférences
Des études contrôlées sur des facteurs potentiellement interférents ont démontré que les caractéristiques du test ne sont pas modifiées par
des concentrations de bilirubine inférieures à 0,2 mg/mL, d’hémoglobine inférieures à 1000 mg/dL ou de triglycérides inférieures à 30 mg/mL.
15.3. Réactions croisées
Des études contrôlées sur des substances potentiellement interférentes n'ont montré aucune interférence à la concentration de chaque
substance listée ci-dessous avec le dosage LIAISON® IGF-I.
Substances Concentration testée
Triglycérides 3 000 mg/dL
Hémoglobine 1 000 mg/dL
Bilirubine non conjuguée 30 mg/dL
Bilirubine conjuguée 20 mg/dL
SAH 4 g/dL
Proinsuline 140 000 ng/mL
Insuline 12 000 µIU/mL
TSH 450 mIU/L
IGF-II 100 000 ng/dL
LH 500 mIU/mL
IGFBP1 5 000 ng/mL
IGFBP2 5 000 ng/mL
IGFBP3 20 000 ng/mL
IGFBP4 5 000 ng/mL
IGFBP5 5 000 ng/mL
IGFBP6 5 000 ng/mL
HGH 1 000 ng/mL
15.4. Fidélité avec l’automate LIAISON® Analyzer
Plusieurs échantillons à différentes concentrations d’IGF-I ont été testés pour déterminer la répétabilité et la reproductibilité du dosage
(c’est-à-dire, la variabilité intra-essai et inter-essais).
Répétabilité. 40 réplicats ont été testés au cours d’une même session d’analyses pour évaluer la répétabilité.
Reproductibilité. 20 réplicats ont été testés sur plusieurs jours en utilisant 2 lots de réactif Integral différents pour évaluer la reproductibilité.
Variabilité intra-essai Variabilité inter-essais
Moyenne Moyenne
CV (%) n* CV (%) n*
(ng/mL) (ng/mL)
71,2 4,40 40 77,5 8,5 20
189,3 4,59 40 202,6 4,3 20
412,7 2,37 40 367,9 3,8 20
* nombre de déterminations
LIAISON® IGF-I ([REF] 313231)
6 / 10 FR - 17 - 2015-10-13
15.5. Fidélité avec l’automate LIAISON® XL Analyzer
Plusieurs échantillons à différentes concentrations d’IGF-I ont été testés pour déterminer la répétabilité et la reproductibilité du dosage
(c’est-à-dire, la variabilité intra-essai et inter-essais).
Répétabilité. 20 réplicats ont été testés au cours d’une même session d’analyses pour évaluer la répétabilité.
Reproductibilité. 20 réplicats ont été testés sur plusieurs jours en utilisant 2 lots de réactif Integral différents pour évaluer la reproductibilité.
Variabilité intra-essai Variabilité inter-essais
Moyenne Moyenne
CV (%) n* CV (%) n*
(ng/mL) (ng/mL)
69,9 5,1 20 79,7 9,6 20
182,9 3,5 20 186,9 7,1 20
589,5 3,0 20 316,9 5,6 20
* nombre de déterminations
Les résultats se réfèrent aux groupes d’échantillons étudiés ; il ne s’agit pas de prestations garanties car des différences peuvent exister entre
les différents laboratoires et lieux géographiques.
15.6. Justesse
La justesse du dosage a été contrôlée au moyen du test de dilution et de surcharge.
15.7. Test de dilution
Le test de dilution a été réalisé sur des échantillons de sérum à concentrations élevées en IGF-I ou dilués en série à l’aide du diluant pour
échantillons. Une analyse de régression linéaire des concentrations en IGF-I mesurées par rapport aux concentrations attendues a été réalisée.
Résultats rapportés en ng/mL :
Test de dilution
400
350
Valeur mesurée
300
250
200
150
100
50
0
0 50 100 150 200 250 300 350
Valeur attendue
Y = 1,1223x + 5,86 r = 0,997
15.8. Test de surcharge
®
Des échantillons de sérum ont été dosés après une adjonction progressive d’IGF-I afin d’évaluer la récupération du test LIAISON IGF-I.
Le tableau ci-dessous donne un exemple de la récupération des concentrations d’IGF-I dans un sérum faiblement titré après adjonction d’un
sérum fortement titré.
Valeur Valeur Valeur Valeur
Récupération Récupération
Dilution mesurée escomptée Dilution mesurée escomptée
(%) (%)
(ng/mL) (ng/mL) (ng/mL) (ng/mL)
Sérum 1 : Sérum 3 :
titre élevé 1,0 434,8 - - titre élevé 1,0 421,2 - -
0,8 387,5 379,2 102 0,8 372,4 374,6 99
0,6 335,5 323,6 104 0,6 349,5 328,1 107
0,4 278,7 268,0 104 0,4 296,5 281,6 105
0,2 219,6 212,3 103 0,2 230,8 235,1 98
0,1 183,3 184,5 99 0,1 209,9 211,8 99
Sérum 2 : 0,0 156,7 - - Sérum 4 : 0,0 188,6 - -
titre faible titre faible
15.9. Effet crochet (High-dose hook effect)
L’effet crochet à fortes doses (HDH, high-dose hook effect) a été déterminé en ajoutant l’IGF-I à des pools de sérum humain jusqu’à une
concentration maximale de 11000 ng/mL.
Lorsque des échantillons contenant des concentrations très élevées d’analyte sont dosés, l’effet crochet peut minimiser les concentrations en
donnant des valeurs inférieures aux valeurs réelles. La présence d’un effet crochet a été évaluée en analysant 5 échantillons à titre élevé en
IGF-I. Tous les échantillons ont donné des valeurs de concentration au-dessus de l’intervalle de mesure. Ces résultats indiquent l’absence de
classification erronée des échantillons.
LIAISON® IGF-I ([REF] 313231)
7 / 10 FR - 17 - 2015-10-13
15.10. Sensibilité analytique et fonctionnelle
Sensibilité analytique :
La sensibilité analytique est définie comme étant la dose minimale détectable d’analyte qui peut se distinguer du point zéro ; c’est-à-dire
2 écarts type au-dessus de zéro.
Sensibilité fonctionnelle :
La sensibilité fonctionnelle est définie comme étant la concentration minimale d’analyte qui peut être déterminée avec une variabilité
inter-essais < 20 %.
Limite de détection Limite de quantification
(sensibilité analytique) (sensibilité fonctionnelle)
Gamme d’automates
3 ng/mL 10 ng/mL
LIAISON® Analyzer
15.11. Tableaux et graphiques des valeurs de référence
FEMMES (F) HOMMES (M)
Âge N Percentiles IGF-I (ng/mL) Âge N Percentiles IGF-I (ng/mL)
e e
(ans) Médiane 2,5 97,5 (ans) Médiane 2,5e 97,5e
0 26 42 8 131 0 26 37 11 100
1 28 49 9 146 1 48 44 12 120
2 84 57 11 165 2 90 52 13 143
3 78 68 13 187 3 96 61 14 169
4 82 81 15 216 4 90 72 15 200
5 84 98 19 251 5 102 83 16 233
6 112 119 24 293 6 117 96 17 269
7 58 145 30 342 7 57 111 18 307
8 71 174 39 396 8 83 128 20 347
9 106 206 49 451 9 105 147 23 386
10 69 240 62 504 10 68 169 29 424
11 59 271 76 549 11 73 193 37 459
12 62 298 90 581 12 74 218 49 487
13 70 317 104 596 13 67 242 64 508
14 85 324 115 591 14 55 264 83 519
15 55 319 121 564 15 63 281 102 520
16 61 304 122 524 16 39 291 119 511
17 49 284 120 479 17 37 291 131 490
18 33 263 117 436 18 31 284 137 461
19 28 245 113 399 19 28 270 137 428
20 36 231 109 372 20 43 254 133 395
21 45 221 107 351 21 40 237 127 364
22 21 213 105 337 22 36 222 120 338
23 24 207 103 326 23 12 208 112 316
24 18 202 102 317 24 15 196 105 298
25 16 197 100 311 25 13 185 99 283
26 13 193 98 305 26 15 177 94 271
27 15 190 96 301 27 20 170 90 262
28 17 186 93 297 28 19 165 87 255
29 14 183 91 293 29 8 162 84 250
30 14 179 89 290 30 8 159 83 246
31 9 176 87 286 31 8 158 82 244
32 19 173 85 283 32 14 157 82 243
33 18 170 83 280 33 23 157 82 242
34 14 168 82 279 34 7 157 82 242
35 11 167 81 278 35 13 156 83 241
36 8 165 80 277 36 15 156 83 240
37 16 164 80 277 37 22 156 83 239
38 9 163 79 276 38 7 155 83 238
39 15 161 78 274 39 19 155 83 238
40 18 158 76 271 40 13 154 82 237
41 12 155 75 267 41 10 153 81 236
42 19 151 73 263 42 18 151 80 235
43 11 147 71 258 43 13 149 78 233
44 13 144 69 253 44 19 147 76 230
45 15 140 66 249 45 10 144 74 227
46 24 137 64 246 46 16 142 72 225
LIAISON® IGF-I ([REF] 313231)
8 / 10 FR - 17 - 2015-10-13
FEMMES (F) HOMMES (M)
Âge N Percentiles IGF-I (ng/mL) Âge N Percentiles IGF-I (ng/mL)
e e
(ans) Médiane 2,5 97,5 (ans) Médiane 2,5e 97,5e
47 11 134 62 243 47 16 140 71 224
48 12 131 60 240 48 13 139 69 224
49 16 128 59 238 49 9 139 68 225
50 8 126 57 236 50 18 139 67 225
51 13 124 55 235 51 23 138 66 225
52 19 122 53 234 52 12 136 65 222
53 16 121 52 233 53 14 133 64 218
54 17 119 51 233 54 12 130 62 214
55 8 118 49 234 55 16 128 61 210
56 15 117 48 235 56 25 125 59 206
57 12 117 47 236 57 16 123 58 204
58 18 116 46 238 58 9 122 56 203
59 17 116 44 240 59 15 121 55 203
60 9 115 43 241 60 11 121 53 206
61 11 114 41 243 61 13 122 51 209
62 18 113 40 244 62 8 122 49 214
63 9 112 38 244 63 10 123 46 219
64 14 110 36 244 64 13 123 43 225
65 8 108 34 241 65 4 124 40 231
66 7 106 32 238 66 10 124 37 236
67 10 103 30 235 67 7 123 34 240
68 11 101 28 231 68 6 123 31 243
69 22 99 27 228 69 7 122 29 245
70 7 97 26 226 70 17 121 27 246
71 10 96 24 224 71 4 120 26 245
72 8 96 24 222 72 12 118 25 242
73 10 95 23 221 73 13 116 24 236
74 18 95 22 220 74 4 112 23 229
75 11 94 21 218 75 7 109 22 221
76 14 94 20 216 76 9 105 22 212
77 4 93 20 214 77 7 101 21 204
78 8 92 19 210 78 5 97 20 196
79 16 90 18 206 79 1 94 19 189
80 7 89 18 200 80 7 91 18 184
81 6 87 18 193 81 10 89 17 180
82 8 85 17 186 82 2 87 16 177
83 7 82 17 179 83 4 86 16 176
84 11 81 17 173 84 3 86 16 176
85 5 79 17 167 85 5 87 15 177
LIAISON® IGF-I ([REF] 313231)
9 / 10 FR - 17 - 2015-10-13
16. BIBLIOGRAPHIE
1. Georg Brabant, Alexander von zur Mühlen, Christian Wüster, Michael B. Rankec, Jürgen Kratzsch, Wieland Kiess, Jean-Marie
Ketelslegers, Lars Wilhelmsen, Lena Hulthén, Bernhard Saller, Anders Mattsson, Jürgen Wilde, Rudolf Schemer, Peter Kanni.
Serum Insulin-Like Growth Factor I Reference Values for an Automated Chemiluminescence Immunoassay System: Results from a
Multicenter Study. Hormone Res 2003; 60:53-60.
2. Tietz Clinical Guide to Laboratory Tests. Fourth Edition 2006.
th
3. Williams Textbook of Endocrinology 9 Edition 1998.
4. Regina E. Chestnut, Valerie Quarmby. Evaluation of total IGF-I assay methods using samples from Type I and Type II diabetic
patients. J Immunol Methods 2002; 259: 11-24.
5. Clemmons DR, on behalf of the conference participants. Consensus statement on the standardization and evaluation of growth
hormone and insulin-like growth factor assays. Clin. Chem. 2011; 57: 555–559.
6. Royston P. and Wright E.M., A Method for Estimating Age-Specific Reference Intervals ('Normal Ranges') Based on Fractional
Polynomials and Exponential Transformation. Journal of the Royal Statistical Society - Series A, 1998; 161 (1): 79-101.
Pour contacter le service clientèle au Canada, téléphoner au numéro gratuit : 1-800-328-1482.
LIAISON® IGF-I ([REF] 313231)
10 / 10 FR - 17 - 2015-10-13
Vous aimerez peut-être aussi
- Insert HGH - FR - 310340 - 06Document12 pagesInsert HGH - FR - 310340 - 06LeïlaPas encore d'évaluation
- Les Innovations Dans Le Traitement Du DiabèteDocument8 pagesLes Innovations Dans Le Traitement Du DiabèteKhalid SalmiPas encore d'évaluation
- 8 SouberbielleDocument34 pages8 SouberbielleFahim RafikPas encore d'évaluation
- Igf 1Document2 pagesIgf 1mélissa MatoubPas encore d'évaluation
- INSULINEDocument6 pagesINSULINEdrhamidalboPas encore d'évaluation
- INSULINE ET SES EFFETS PHYSIOLOGIQUESDocument6 pagesINSULINE ET SES EFFETS PHYSIOLOGIQUESMariettePas encore d'évaluation
- 12-Protéines PlasmatiquesDocument59 pages12-Protéines Plasmatiquesrahamamaiga808Pas encore d'évaluation
- INSULINEDocument4 pagesINSULINEnawarPas encore d'évaluation
- 5-Pancréas Endocrine PDFDocument31 pages5-Pancréas Endocrine PDFthierno amadou bah100% (1)
- Axe HPT-HPPDocument36 pagesAxe HPT-HPPRezagui ImadPas encore d'évaluation
- Mced Ahnf Explorations Biologiques Et Radiologiques PDFDocument8 pagesMced Ahnf Explorations Biologiques Et Radiologiques PDFKhawlaAzizPas encore d'évaluation
- Hypoglycémies OrganiquesDocument7 pagesHypoglycémies Organiquesbendjebbarnorelhoda07Pas encore d'évaluation
- IfutGliadinIgGKitZenit FRDocument15 pagesIfutGliadinIgGKitZenit FRFarid AbderahmanePas encore d'évaluation
- CL PRLTC FRDocument7 pagesCL PRLTC FRFarid AbderahmanePas encore d'évaluation
- Apo A1Document2 pagesApo A1Souad DahmaPas encore d'évaluation
- Physio2an Endocrino-Pancreas Endocrine2018bouchihaDocument71 pagesPhysio2an Endocrino-Pancreas Endocrine2018bouchihaaimen benkhabchechePas encore d'évaluation
- Contrôle Microbiologique Du Lait Cru Et Lait Pasteurisé de L'unité de ZELFANADocument43 pagesContrôle Microbiologique Du Lait Cru Et Lait Pasteurisé de L'unité de ZELFANAAbdenour SenoussiPas encore d'évaluation
- Apolipoproteines A1-B1Document2 pagesApolipoproteines A1-B1zlimitounePas encore d'évaluation
- Physiologie Du Pancréas EndocrineDocument4 pagesPhysiologie Du Pancréas EndocrineSaken667Pas encore d'évaluation
- Présentation 1Document22 pagesPrésentation 1Olfa KarouiPas encore d'évaluation
- Diabete Support de Cours 2022Document67 pagesDiabete Support de Cours 2022minasoaPas encore d'évaluation
- 4 AntidiabetiquesDocument5 pages4 AntidiabetiquesBENCHABANE OUSSAMAPas encore d'évaluation
- 0313FDocument2 pages0313FÃßD ÔûñîPas encore d'évaluation
- ALBUMINE Méthode BCGDocument2 pagesALBUMINE Méthode BCGDavid kyPas encore d'évaluation
- ALT TGP (IFCC) MonoréactifDocument2 pagesALT TGP (IFCC) MonoréactifDavid kyPas encore d'évaluation
- Rapport de TP Action de L'insulineDocument7 pagesRapport de TP Action de L'insulinebenjamingbodoPas encore d'évaluation
- Rapport de TP BIO 332 Action de Linsulin PDFDocument7 pagesRapport de TP BIO 332 Action de Linsulin PDFzokenPas encore d'évaluation
- 1997-Bioforma-08-Hémoglobine Glyquée-LipidesDocument88 pages1997-Bioforma-08-Hémoglobine Glyquée-Lipidesaya prodigePas encore d'évaluation
- Antidiabétiques REL 2017Document15 pagesAntidiabétiques REL 2017khouloud gazzehPas encore d'évaluation
- Test Au Glucagon Stimulation de La GHDocument1 pageTest Au Glucagon Stimulation de La GHFahim RafikPas encore d'évaluation
- Amylase PNPGDocument2 pagesAmylase PNPGSouad DahmaPas encore d'évaluation
- Test A L Insuline Stimulation de La GHDocument1 pageTest A L Insuline Stimulation de La GHSabrina CherifPas encore d'évaluation
- Apo B PDFDocument6 pagesApo B PDFFouad RahiouyPas encore d'évaluation
- Calibrants Et Contrôles Pour ASLO 2Document1 pageCalibrants Et Contrôles Pour ASLO 2zlimitounePas encore d'évaluation
- Eexercice Et Axe Somatotrope Meriam GaddasDocument51 pagesEexercice Et Axe Somatotrope Meriam GaddasPixel service HosniPas encore d'évaluation
- IGFBP3Document2 pagesIGFBP3mon ipadPas encore d'évaluation
- Purification Des ProtDocument11 pagesPurification Des ProtIsaac AvaloPas encore d'évaluation
- DIPEPTIVENDocument3 pagesDIPEPTIVENneamtzu_doru1180Pas encore d'évaluation
- Exercices TDDocument4 pagesExercices TDLilou Ṧṹpeř MaboullPas encore d'évaluation
- BIOLABO ASLO Calibrants Et Contrôles 4Document1 pageBIOLABO ASLO Calibrants Et Contrôles 4tararPas encore d'évaluation
- PIMAC IMAL FR v2 - 02 12 2021Document2 pagesPIMAC IMAL FR v2 - 02 12 2021oussama salahiPas encore d'évaluation
- AcromégalieDocument7 pagesAcromégalieAounAbdellahPas encore d'évaluation
- PLURIGIN Ovuli Foglietto Illustrativo Rev.30.10.18 (Francese)Document1 pagePLURIGIN Ovuli Foglietto Illustrativo Rev.30.10.18 (Francese)Magdalena LauraPas encore d'évaluation
- 08.04.Diététique CoursDocument6 pages08.04.Diététique CoursHADJI MEDPas encore d'évaluation
- Apo BDocument2 pagesApo BSouad DahmaPas encore d'évaluation
- Protéines Totales Méthode BIURETDocument2 pagesProtéines Totales Méthode BIURETzlimitounePas encore d'évaluation
- Minicap Immunotyping. Ref - 05Document27 pagesMinicap Immunotyping. Ref - 05Karmass JallalPas encore d'évaluation
- Les AntidiabétiquesDocument12 pagesLes AntidiabétiquesLahcen ElmoumouPas encore d'évaluation
- AlbumineDocument4 pagesAlbumineSouad DahmaPas encore d'évaluation
- DOSAGE DES PROTEINES PAR LA METHODE COLORIMETRIQUE - Imprimé 2014-2015Document3 pagesDOSAGE DES PROTEINES PAR LA METHODE COLORIMETRIQUE - Imprimé 2014-2015Rim AbouttiPas encore d'évaluation
- BIOLABO ASLO Calibrants Et Contrôles 1Document1 pageBIOLABO ASLO Calibrants Et Contrôles 1tararPas encore d'évaluation
- Rubéole IggDocument21 pagesRubéole IggJacob MadibaPas encore d'évaluation
- Nutrition ParentéraleDocument29 pagesNutrition ParentéraleLANDRY BEREPas encore d'évaluation
- Pediatrie5an TD Interpretation Dun Bilan-BiologiqueDocument37 pagesPediatrie5an TD Interpretation Dun Bilan-BiologiqueCheick SERMEPas encore d'évaluation
- 13-Le Traitement Du DT2 PolycopDocument23 pages13-Le Traitement Du DT2 PolycopMohamed IkbalPas encore d'évaluation
- Innamestudie Propyleenglycol in Dranken FRDocument3 pagesInnamestudie Propyleenglycol in Dranken FRPicanol JacquelinePas encore d'évaluation
- 11-Glucagon - Effets Physiologiques Et MétaboliquesDocument53 pages11-Glucagon - Effets Physiologiques Et MétaboliquesNour klPas encore d'évaluation
- Insert ALDOSTERONE - FR - 310450 - 2Document14 pagesInsert ALDOSTERONE - FR - 310450 - 2LeïlaPas encore d'évaluation
- Guide de l'indice Pral (Potential Renal Acid Load): 527 aliments classés selon leur pouvoir acidifiant ou alcalinisantD'EverandGuide de l'indice Pral (Potential Renal Acid Load): 527 aliments classés selon leur pouvoir acidifiant ou alcalinisantPas encore d'évaluation
- UdeM Maîtrise en Santé Publique-2022-09!17!054515Document11 pagesUdeM Maîtrise en Santé Publique-2022-09!17!054515Filipe da Angela CuletePas encore d'évaluation
- Cmq 82436 Fmsq Cotisation 2023Document1 pageCmq 82436 Fmsq Cotisation 2023ssgroleaumdPas encore d'évaluation
- Examen Lettre Et PH 2020 2emeDocument2 pagesExamen Lettre Et PH 2020 2emeSonia BenamarPas encore d'évaluation
- Module 3 - Etiquette A4 A Utiliser Au BesoinDocument1 pageModule 3 - Etiquette A4 A Utiliser Au Besoiniddees cesfPas encore d'évaluation
- Expression Orale 1ASDocument2 pagesExpression Orale 1ASInes Soualah100% (1)
- Échappement Et Tolérance Des Tumeurs À L'apoptose: Pierre-Yves Dietrich Paul R. WalkerDocument8 pagesÉchappement Et Tolérance Des Tumeurs À L'apoptose: Pierre-Yves Dietrich Paul R. WalkerNsangwaPas encore d'évaluation
- Attestation DroitsDocument2 pagesAttestation DroitsKanePas encore d'évaluation
- SVT 1ère A_L5_La Régulation Des NaissancesDocument9 pagesSVT 1ère A_L5_La Régulation Des Naissancesothnielkehi6Pas encore d'évaluation
- 5b-Dystrophie MusculaireDocument15 pages5b-Dystrophie MusculaireFadila MararPas encore d'évaluation
- EEGCNEDocument2 pagesEEGCNEFtiho ChouPas encore d'évaluation
- Radio-Anatomie de L'oreilleDocument62 pagesRadio-Anatomie de L'oreilleHeyfaPas encore d'évaluation
- Les Instruments Et Les Modes de Gestion Des Déchets en AlgérieDocument4 pagesLes Instruments Et Les Modes de Gestion Des Déchets en AlgériemarouaPas encore d'évaluation
- Article Revision 1Document1 pageArticle Revision 1eggyPas encore d'évaluation
- Jean-Paul Dusabe - Epiphysiolyse Fémorales SupérieureDocument9 pagesJean-Paul Dusabe - Epiphysiolyse Fémorales SupérieureRay Costaa100% (1)
- Imagerie Des SeinsDocument48 pagesImagerie Des SeinsHayat HayatPas encore d'évaluation
- DR Morse Le Corps Sait Se Guérir de Toutes Les MaladiesDocument3 pagesDR Morse Le Corps Sait Se Guérir de Toutes Les MaladiessimosimoPas encore d'évaluation
- Programme SFMPP 2023 13.09Document20 pagesProgramme SFMPP 2023 13.09martin.dubuc-extPas encore d'évaluation
- Guide de Poche de La Gestion Des Approvisionnement en ContraceptifsDocument75 pagesGuide de Poche de La Gestion Des Approvisionnement en Contraceptifsnaidar jobPas encore d'évaluation
- Arret Cardio Respiratoire Presentation de Medecine SportiveDocument64 pagesArret Cardio Respiratoire Presentation de Medecine SportiveMAMADOU LAMINE DIOPPas encore d'évaluation
- Le Savon de Marseille TPDocument6 pagesLe Savon de Marseille TPInLoPas encore d'évaluation
- TP Et TCA FRDocument6 pagesTP Et TCA FRedmainkPas encore d'évaluation
- Rhumatisme Articulaire Aigu Chez L'enfantDocument27 pagesRhumatisme Articulaire Aigu Chez L'enfantDouhi OussamaPas encore d'évaluation
- Securite Routiere Texte FLEDocument2 pagesSecurite Routiere Texte FLEVincent DurrenbergerPas encore d'évaluation
- Découvrez L EFTDocument3 pagesDécouvrez L EFTJm ThnPas encore d'évaluation
- 2022 Lyon 060Document83 pages2022 Lyon 060larabiPas encore d'évaluation