Académique Documents
Professionnel Documents
Culture Documents
La Température Est Supposée Constante Pendant L'expérience
Transféré par
berthelot0 évaluation0% ont trouvé ce document utile (0 vote)
17 vues2 pagesTitre original
Untitled
Copyright
© © All Rights Reserved
Formats disponibles
DOC, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOC, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
17 vues2 pagesLa Température Est Supposée Constante Pendant L'expérience
Transféré par
berthelotDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOC, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Bac S 2014 Liban Spécialité Exercice III
: Tensioactifs (5 points) http://labolycee.org
La majorité des détergents ou des cosmétiques utilisés au quotidien contiennent des tensioactifs.
Le dodécylsulfate de sodium (SDS) est l’un des plus utilisés.
Document 1 : Structure d’un tensioactif et formation de micelles
Les tensioactifs ont une structure dite amphiphile : ils possèdent un groupe caractéristique
hydrophile et une longue chaîne carbonée hydrophobe.
Les tensioactifs forment alors un film continu à la surface de l’eau : les têtes hydrophiles
plongent dans l’eau et les chaînes carbonées se dressent hors de l’eau, serrées les unes
contre les autres.
Mais que se passe-t-il lorsque cette couche est saturée ? Les molécules s’associent alors pour
former des micelles : les chaînes carbonées se regroupent, entourées des têtes hydrophiles en
contact avec l’eau.
D’après un texte tiré de « Matière et matériaux », E.Guyon, Pour la science
Document 2 : Protocole expérimental de mesure de la concentration micellaire critique
(CMC)
Une solution de SDS de concentration molaire CSDS = 0,040 mol.L-1 a été préparée à l’avance
pour éviter la présence de mousse.
On introduit dans un bécher 75 mL d’eau distillée et on ajoute un volume V de la solution de
SDS. La conductivité de la solution obtenue est mesurée avec une sonde conductimétrique.
Les mesures sont consignées dans le tableau ci-après.
C désigne la concentration molaire du SDS dans le mélange obtenu.
La température est supposée constante pendant l’expérience.
V
2,0 5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0 50,0
(mL)
C
1,0 4,71 6,67 8,42 10,0 11,4 12,7 13,9 16,0
(mmol.L-1)
9,07 21,8 41,1 55,5 65,0 72,0 77,6 82,7 87,6 96,0
(mS.m-1)
Données : Formule brute du SDS : C12H25SO4Na
Masse molaire du SDS : M = 288 g.mol-1
Espèce tensioactive du SDS : ion dodécylsulfate C12H25OSO3–
1. L’ion dodécylsulfate
Une représentation très schématique de l’ion dodécylsulfate est donnée ci-après :
Indiquer la partie hydrophile et la partie hydrophobe de l’ion dodécylsulfate et la manière dont ce
schéma rend compte de la structure de l’ion.
2. Le SDS dans l’eau
2.1. Représenter, sous forme d’un schéma, la manière dont les tensioactifs se placent à la surface
de l’eau.
2.2. L’un des trois schémas ci-dessous correspond à celui d’une micelle de SDS dans l’eau.
Lequel ? Justifier.
SCHÉMA A SCHÉMA B SCHÉMA C
2.3. En moyenne, la masse molaire des micelles de SDS dans l’eau est égale à 17 kg.mol -1.
Le nombre d’ions dodécylsulfate présents dans la micelle représentée ci-dessus
correspond-il à la réalité ? Justifier par un calcul.
3. Détermination de la concentration micellaire critique du SDS
L’apparition de micelles se produit au-delà d’une certaine concentration massique en tensioactif,
appelée concentration micellaire critique (CMC) exprimée en g.L -1.
3.1. Déterminer la valeur manquante dans le tableau du document 2.
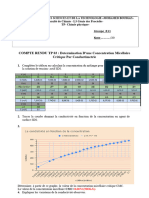
3.2. La courbe de l’ANNEXE 2 À RENDRE AVEC LA COPIE a été tracée à partir des mesures
obtenues expérimentalement. Elle permet de déterminer, par une méthode graphique, la
concentration micellaire critique (CMC) du SDS.
3.2.1. Quelles sont les grandeurs représentées en abscisse et en ordonnée ?
Préciser leurs unités.
3.2.2. Expliquer l’allure de la courbe.
Justifier le fait que la valeur de la concentration micellaire critique (CMC) du SDS peut
être déduite de l’abscisse du point de la rupture de pente.
3.2.3. On verse 0,30 g de SDS dans 200 mL d’eau distillée.
La solution obtenue comporte-t-elle des micelles ?
Expliquer la démarche suivie.
ANNEXE 2 À RENDRE AVEC LA COPIE
Exercice III : Question 3.2.
Vous aimerez peut-être aussi
- Simulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysD'EverandSimulation des vibrations mécaniques, 2e édition: par Matlab, Simulink et AnsysPas encore d'évaluation
- TP - Principe de Mesure de La CMC PDFDocument4 pagesTP - Principe de Mesure de La CMC PDFfatimazahra0% (1)
- Travaux Diriges GPC 402Document6 pagesTravaux Diriges GPC 402Benito BenitoPas encore d'évaluation
- 2014 Liban Spe Exo3 Correction TensioactifsDocument2 pages2014 Liban Spe Exo3 Correction TensioactifsOussama El BouadiPas encore d'évaluation
- TP6 Tensioactif Mousse ÉmulsionDocument2 pagesTP6 Tensioactif Mousse ÉmulsionhalkaPas encore d'évaluation
- Pci-Fiche Td-2-Ing2-Stgp-22-23Document2 pagesPci-Fiche Td-2-Ing2-Stgp-22-23Yavo Vivas AKEPas encore d'évaluation
- TP 2 CMCDocument3 pagesTP 2 CMCkadere83Pas encore d'évaluation
- GénéralitésDocument5 pagesGénéralitésIlyes ChPas encore d'évaluation
- Tensioactifs Anioniques Tensioactifs Cationiques Tension Actifs Zwitterioniques Ou Amphotères Tensioactifs Non IoniquesDocument7 pagesTensioactifs Anioniques Tensioactifs Cationiques Tension Actifs Zwitterioniques Ou Amphotères Tensioactifs Non IoniquesFatima YahiaPas encore d'évaluation
- TPPPDocument6 pagesTPPPso loPas encore d'évaluation
- TP2 CMC L3 GP 2019-2020 PDFDocument6 pagesTP2 CMC L3 GP 2019-2020 PDFBouchra Benabdallah100% (9)
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Activite1 Dosage Conductimetrique Par ComparaisonDocument4 pagesActivite1 Dosage Conductimetrique Par ComparaisonCharbonPas encore d'évaluation
- Compte Rendu TP 03 DETERMINATION DE CMC-2020-2021-1Document4 pagesCompte Rendu TP 03 DETERMINATION DE CMC-2020-2021-1nasroud5Pas encore d'évaluation
- Compte renduTP2Document2 pagesCompte renduTP2rara roroPas encore d'évaluation
- Bfem 1997 1Document1 pageBfem 1997 1Diabel Diop100% (1)
- Masses Molaires Atomiques: M (H) 1,0 G Mol M (C) 12,0 G Mol M (O) 16,0 G Mol M (Ca) 40,0 G Mol M (CL) 35,5 G.mol M (Fe) 55,8 G MolDocument4 pagesMasses Molaires Atomiques: M (H) 1,0 G Mol M (C) 12,0 G Mol M (O) 16,0 G Mol M (Ca) 40,0 G Mol M (CL) 35,5 G.mol M (Fe) 55,8 G MolBesmaPas encore d'évaluation
- DS1spe 1Document2 pagesDS1spe 1zaydscameurPas encore d'évaluation
- TP1 Electochimie 3émé AnnéeDocument10 pagesTP1 Electochimie 3émé AnnéeLïnâ ExØtîc DõlĽPas encore d'évaluation
- ch02 61 Exos SupDocument6 pagesch02 61 Exos SupskanderPas encore d'évaluation
- TP2 Coeff Partage I2 CyclohexaneDocument5 pagesTP2 Coeff Partage I2 Cyclohexanevdhg6xs2ssPas encore d'évaluation
- SERIE DE TD N1 GP 2022 L3 Pheno de Surf Et Catalyse HeterDocument3 pagesSERIE DE TD N1 GP 2022 L3 Pheno de Surf Et Catalyse HeterManel 123100% (2)
- TP 02. ConductimétrieDocument4 pagesTP 02. Conductimétriefafoulol100% (1)
- DS 7 790 2021-2022 25Document5 pagesDS 7 790 2021-2022 25Armel Marc KouchoewanouPas encore d'évaluation
- TP Dosage Par Conductimetrie Du Destop Correction Du TPDocument5 pagesTP Dosage Par Conductimetrie Du Destop Correction Du TPhhedfi100% (2)
- A8 - Agir - Dosage Conductimétrique Du Sérum PhysiologiqueDocument5 pagesA8 - Agir - Dosage Conductimétrique Du Sérum Physiologiqueliminey 12Pas encore d'évaluation
- Comment Réaliser Un Dosage Par Conductimétrie ?Document5 pagesComment Réaliser Un Dosage Par Conductimétrie ?Safa MakhloufPas encore d'évaluation
- ECC2Document8 pagesECC2bichette1711.bichaPas encore d'évaluation
- IntroductionDocument12 pagesIntroductionselmi nourelhoudaPas encore d'évaluation
- Chap N 6C ELEVE Exercices Conductimetrie Correction 0Document3 pagesChap N 6C ELEVE Exercices Conductimetrie Correction 0Samira ElAllaoui100% (2)
- tp15 Maiver PDFDocument19 pagestp15 Maiver PDFMessouaf FouadPas encore d'évaluation
- PH Acide Fort Ka. 2020-WahabDiopDocument3 pagesPH Acide Fort Ka. 2020-WahabDiopawa96213Pas encore d'évaluation
- td3 SurfaceDocument5 pagestd3 Surfacebouchra boudjPas encore d'évaluation
- CORRECTION EVALUATION SP 3e N°1 2022 2023 1Document2 pagesCORRECTION EVALUATION SP 3e N°1 2022 2023 1Boubacar MballoPas encore d'évaluation
- Exercice 1 (6 Points) Cinétique D'une Réaction D'estérificationDocument7 pagesExercice 1 (6 Points) Cinétique D'une Réaction D'estérificationAli RammalPas encore d'évaluation
- PC Gene Sujet 061 Exo1 Chi BetadinebeerDocument3 pagesPC Gene Sujet 061 Exo1 Chi BetadinebeerQuentin BlanchardPas encore d'évaluation
- TP ChromaioniqueDocument7 pagesTP ChromaioniqueDiafoukaPas encore d'évaluation
- Exercice 1: Connaître Les Constituants D'une SolutionDocument2 pagesExercice 1: Connaître Les Constituants D'une SolutionAyoub HmPas encore d'évaluation
- Fiche 1 Exercices Concentrations MoleDocument2 pagesFiche 1 Exercices Concentrations MoleLARIBIPas encore d'évaluation
- tp15 MaiverDocument19 pagestp15 MaiverhenryPas encore d'évaluation
- Caisse de Solidarite Du Groupe G3 Nioro Du RipDocument3 pagesCaisse de Solidarite Du Groupe G3 Nioro Du RipMohamed CoulibalyPas encore d'évaluation
- Chimie Exemple 3Document9 pagesChimie Exemple 3Serge DemirdjianPas encore d'évaluation
- 18-Devoir de Vacances - Chimie 1S - TSDocument4 pages18-Devoir de Vacances - Chimie 1S - TSHussein AbdallahPas encore d'évaluation
- TP Thermodynamique: Le Volume MolaireDocument7 pagesTP Thermodynamique: Le Volume MolaireAya DOGHMANEPas encore d'évaluation
- Exercices Sur L'échange D'eau Sérié N°2Document5 pagesExercices Sur L'échange D'eau Sérié N°2Nezha Nezha100% (1)
- TD CHIMIE N°5 Acide BaseDocument3 pagesTD CHIMIE N°5 Acide BaseJuste Landry OngoloPas encore d'évaluation
- Exercices Corriges Chimie en SolutionDocument157 pagesExercices Corriges Chimie en SolutionKhalid Zeg83% (23)
- Devoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)Document2 pagesDevoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)la physique selon le programme FrançaisPas encore d'évaluation
- S4 Conductance Et Conductivité 1BAC IntDocument5 pagesS4 Conductance Et Conductivité 1BAC Intwassimelagri39Pas encore d'évaluation
- 12 Chimie TSe 1Document5 pages12 Chimie TSe 1foud18Pas encore d'évaluation
- TP ElectrochimieDocument28 pagesTP ElectrochimieSoundous Tayssir100% (1)
- Compte Rendu TP Electro Chimie 2Document3 pagesCompte Rendu TP Electro Chimie 2yasserPas encore d'évaluation
- Compte Rendu TP Electro Chimie 2Document3 pagesCompte Rendu TP Electro Chimie 2yasserPas encore d'évaluation
- TD Dosages Directs 1Document1 pageTD Dosages Directs 1Youssef Arba100% (1)
- Terminale D PDFDocument75 pagesTerminale D PDFMohieddine Khaili100% (6)
- 9-Quantite MatiereDocument2 pages9-Quantite MatiereDriss EL FadilPas encore d'évaluation
- TP Du Turbomachines-PompesDocument12 pagesTP Du Turbomachines-PompesISMAIL EL KHADDARPas encore d'évaluation
- Dimensionnement Réseau EUDocument5 pagesDimensionnement Réseau EUlimmoud100% (1)
- WPC 10132Document16 pagesWPC 10132Murat SyzdykovPas encore d'évaluation
- Polycopié TP-MMCDocument23 pagesPolycopié TP-MMCOumaima El trachPas encore d'évaluation
- Cours MDFDocument65 pagesCours MDFgambitfluentPas encore d'évaluation
- Dynamique Des FluidesDocument12 pagesDynamique Des Fluidescyrine KhamiriPas encore d'évaluation
- Colebrook Ts 2 Cira RevisionsDocument3 pagesColebrook Ts 2 Cira RevisionsEchafaiPas encore d'évaluation
- Copie de Etude Comparative Corrigé InesDocument11 pagesCopie de Etude Comparative Corrigé InesDjamal MohammediPas encore d'évaluation
- Emd1 Hyd Gen 2010Document12 pagesEmd1 Hyd Gen 2010عبد العزيز مروىPas encore d'évaluation
- TP Couche Limite PDFDocument9 pagesTP Couche Limite PDFmerwa sefir100% (2)
- ch3 Aerodynamaique Theorie de L Element de Pale Naciri - CopieDocument86 pagesch3 Aerodynamaique Theorie de L Element de Pale Naciri - Copieachraf haikalPas encore d'évaluation
- MouillabilitéDocument3 pagesMouillabilitéHamza BEYADPas encore d'évaluation
- Le Petit Graisseur - N5 - Mai 2009 PDFDocument4 pagesLe Petit Graisseur - N5 - Mai 2009 PDFgreendayzarePas encore d'évaluation
- Viscosimètre Brookfield Notice Simplifiée (301118)Document8 pagesViscosimètre Brookfield Notice Simplifiée (301118)Irina MariePas encore d'évaluation
- Mémoire Master 2 ForageDocument65 pagesMémoire Master 2 ForagemtffechkeurPas encore d'évaluation
- THESE BienDocument217 pagesTHESE BienArabic TalentPas encore d'évaluation
- Mécanique de Fluide TDDocument7 pagesMécanique de Fluide TDNaifar OnsPas encore d'évaluation
- Debit Et Perte de ChargeDocument10 pagesDebit Et Perte de ChargetissierPas encore d'évaluation
- Cours PMC316 - Mecanique Des FluidesDocument94 pagesCours PMC316 - Mecanique Des FluidesMilley's Chacha100% (2)
- Siphon (Tuyau)Document3 pagesSiphon (Tuyau)donPas encore d'évaluation
- Notions de Base en RhéologieDocument43 pagesNotions de Base en RhéologieAya AlianiPas encore d'évaluation
- b5340Document49 pagesb5340SouadHadjadj100% (1)
- Cours de Mécanique Des Fluides Approfondie: Université Echahid Hamma Lakhdar El-Oued Faculté de TechnologieDocument33 pagesCours de Mécanique Des Fluides Approfondie: Université Echahid Hamma Lakhdar El-Oued Faculté de TechnologieAidaoui MohammedPas encore d'évaluation
- Fluide TP1Document8 pagesFluide TP1basssemPas encore d'évaluation
- Chap-1 Proprietes Des FluidesDocument15 pagesChap-1 Proprietes Des FluidesDamien Bouticourt100% (1)
- OuiqDocument39 pagesOuiqaminesd500Pas encore d'évaluation
- Hydrostatique Des Fluides PIC PDFDocument35 pagesHydrostatique Des Fluides PIC PDFBrahim ABAGHOUGHPas encore d'évaluation
- TP TribologieDocument9 pagesTP TribologieRabab RimPas encore d'évaluation
- Rapport de TP Mesures de DébitDocument8 pagesRapport de TP Mesures de DébitDjaha Emmanuel67% (6)
- MDF Chapi01Document16 pagesMDF Chapi01benhammaahmed70Pas encore d'évaluation