Académique Documents
Professionnel Documents
Culture Documents
Rappels de Thermodynamique
Transféré par
Mohamed El-amine BendjoudaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Rappels de Thermodynamique
Transféré par
Mohamed El-amine BendjoudaDroits d'auteur :
Formats disponibles
Conversion d'énergie
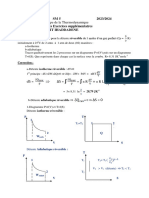
1. Rappels de thermodynamique
1.1. Equation d'état des gaz parfaits: P.V = n.R.T ou P.V=m.r.T
V= volume de gaz en m3
P= pression du gaz en Pa
n = nombre de moles dans le volume de gaz
T = température du gaz en K
R ≈ 8,314 J/mol.K (constante universelle des gaz parfaits)
m = masse de gaz en kg
R
r= en J/kg.K
M
1.2. Premier principe de la thermodynamique
a) Un gaz suit une transformation thermodynamique réversible qui le fait passer de l'état
1 jusqu'à l'état 2 pendant laquelle il n'échange que de la chaleur (Q) et du travail (W)
avec le milieu extérieur. La variation de l'énergie interne de ce gaz est donnée par la
relation:
ΔU12 = U2 – U1 = Q + W
b) Un gaz parcourt des transformations thermodynamiques qui démarrent d'un état
initial et qui le font retourner à son état initial en passant par des états intermédiaires:
le gaz parcourt un cycle thermodynamique.
La variation de l'énergie interne du gaz lors d'un cycle thermodynamique idéal
qui n'échange que de la chaleur (Q) et du travail (W) avec le milieu extérieur est
nulle et s'écrit :
ΔUcycle = Q + W = 0
1.3. Second principe
A tout système est associée une fonction d’état appelée entropie et notée S.
L’entropie est une grandeur additive.
Au cours d’une transformation d’un système fermé la variation d’entropie d’un état
initial à un état final est égale à:
ΔS12 = S2 – S1 = Sext + Sint
Sext est l’entropie échangée avec le milieu extérieur. Elle est comptée positivement si
elle est reçue par le système, négativement dans le cas contraire.
Sint est l’entropie créée au sein du système
Sint = 0 pour les transformations réversibles
Sint > 0 pour les transformations irréversibles
1.4. Transformations thermodynamiques usuelles
On suppose que:
Le fluide de travail est assimilé à un gaz parfait
Les transformations sont réversibles
Lors de la transformation, le fluide de travail n'échange que de la chaleur Q et du
travail W avec le milieu extérieur.
Le fluide de travail est composé d'une seule mole de gaz : n = 1 mole
a) Transformation isentropique (adiabatique réversible) 1-2 (S1 = S2)
pvγ = A (constante)
Q12 = 0
W12 = −∫ pdv=c v ( T 2−T 1 ) en J
c v = chaleur spécifique à volume constant en J/mol.K
ΔU12 = W12 = c v ( T 2−T 1 ) en J
ΔS12 = 0
b) Transformation isochore (à volume constant) 1-2 (V1 = V2)
T T1 T2
=cste= =
p p1 p2
Q12 = c v ( T 2−T 1 ) en J
W12 = 0
ΔU12 = Q12 = c v ( T 2−T 1 ) en J
2 2
dq dT T2
ΔS12 = ∫ =∫ c v =c v ln en J/K
1 T 1 T T1
c) Transformation isobare (à pression constante) 1-2 (P2 = P1)
T T T
=Constante = 1 = 2
V V1 V2
Q12 = c P ( T 2−T 1 ) en J
W12 = - P1(V2 – V1) = -R (T2 – T1) en J
ΔU12 = Q12 + W12 = c v ( T 2−T 1 ) en J car cp - cv = R
2 2
dq dT T2
ΔS12 = ∫ =∫ c p =c p ln en J/K
1 T 1 T T1
d) Transformation isotherme (à température constante) 1-2 (T2 = T1)
PV = constante = P1V1 = P2V2 = R T1 = R T2
ΔU12 = 0 (car dU =cvdT et on a dT =0)
2
dv V1 p2
W12 = −∫ pdv = −∫ R T 1 =R T 1 ln =¿ R T 1 ln ¿ en J
1 v V2 p1
V1
Q12 = - W12 = −R . T 1 ln en J
V2
Q12 V2
ΔS12 = ¿ R ln en J/K
T1 V1
Vous aimerez peut-être aussi
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2D'EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Pas encore d'évaluation
- TD 2 (Ex & Sol)Document17 pagesTD 2 (Ex & Sol)eto 03100% (4)
- Tableau de Formules ThermodynamiquesDocument2 pagesTableau de Formules Thermodynamiquesyoulmafia99100% (1)
- Corrige Td3 P&C Gcv2 IpsasDocument30 pagesCorrige Td3 P&C Gcv2 IpsasAmin Jamoussi50% (2)
- Exercices Premier Et Deuxieme PrincipeDocument4 pagesExercices Premier Et Deuxieme PrincipeTaoufikAghrisPas encore d'évaluation
- Mouvement de RotationDocument31 pagesMouvement de RotationYoussef LahbielPas encore d'évaluation
- CTRL VFSB S3 2016 TH2Document4 pagesCTRL VFSB S3 2016 TH2Aminos MaPas encore d'évaluation
- Corr Cours 5 PDFDocument4 pagesCorr Cours 5 PDFhenryPas encore d'évaluation
- Exos Sur Le TravailDocument9 pagesExos Sur Le TravailSeleno PhilePas encore d'évaluation
- CNC MP Physique1 2006c1Document8 pagesCNC MP Physique1 2006c1Mahboub SabirPas encore d'évaluation
- TD Thermodynamique - Corrigé Série N°2 - 2017-2018Document5 pagesTD Thermodynamique - Corrigé Série N°2 - 2017-2018Samiya CPas encore d'évaluation
- Correction SérieN3Document6 pagesCorrection SérieN3Mounir100% (1)
- Thermodynamique1 PDFDocument19 pagesThermodynamique1 PDFabdelmoumen.doudoPas encore d'évaluation
- Corrigé Série 3 Entropie EXO SUPPL SM5 2023-2024Document7 pagesCorrigé Série 3 Entropie EXO SUPPL SM5 2023-2024amerouanrPas encore d'évaluation
- Cours Second-Principe ThermoDocument13 pagesCours Second-Principe ThermohamzaPas encore d'évaluation
- Corrigé de La Série 1 - 2014Document8 pagesCorrigé de La Série 1 - 2014Riadh ChouaibiPas encore d'évaluation
- Thermodynamique Formules JournetDocument1 pageThermodynamique Formules JournetazzamPas encore d'évaluation
- Thermo10 07Document1 pageThermo10 07Bilal BelouedPas encore d'évaluation
- TD Corrigé Du Module MTHT222Document7 pagesTD Corrigé Du Module MTHT222224021Pas encore d'évaluation
- CTRL Rattr 2017 SB Th2 VF1Document4 pagesCTRL Rattr 2017 SB Th2 VF1Aminos MaPas encore d'évaluation
- Chapitre3 Conversion DenergieDocument31 pagesChapitre3 Conversion Denergiehacinemohamed451Pas encore d'évaluation
- TD CH1 18 2120190518 115415 1xvxuayDocument4 pagesTD CH1 18 2120190518 115415 1xvxuaygladys.ayengPas encore d'évaluation
- Partie 2 (Du Chap1)Document9 pagesPartie 2 (Du Chap1)Aøuiche InesPas encore d'évaluation
- TD1+Solution Thermodynamique Et Chimie Des SolutionsDocument4 pagesTD1+Solution Thermodynamique Et Chimie Des SolutionsDoudou AminePas encore d'évaluation
- 3-Premier Principe - 2Document17 pages3-Premier Principe - 2ik0302303Pas encore d'évaluation
- Thermo FormulesDocument1 pageThermo Formulesmoad4hatimPas encore d'évaluation
- Cours de La Thermodynamique 2APDocument152 pagesCours de La Thermodynamique 2APWissal SalimPas encore d'évaluation
- P Bts98 CorrDocument3 pagesP Bts98 CorrGueye OusmanePas encore d'évaluation
- Série de TD N°2 Avec Corrigé THERMO 2019-2020Document8 pagesSérie de TD N°2 Avec Corrigé THERMO 2019-2020amel100% (1)
- Devoir Surveillé de Physique N°8 - Correction Transformations Réversibles Et IrréversiblesDocument6 pagesDevoir Surveillé de Physique N°8 - Correction Transformations Réversibles Et IrréversiblesSaliou SENEPas encore d'évaluation
- Correction Exercices Chapitre 2Document12 pagesCorrection Exercices Chapitre 2Mohammed AmliehPas encore d'évaluation
- TD1-SOLUTIONS-Thermo Des Équilibres-2020-2021Document6 pagesTD1-SOLUTIONS-Thermo Des Équilibres-2020-2021Soudani SaraPas encore d'évaluation
- Cours L2P THERMO CHAP2 (Premier Principe)Document20 pagesCours L2P THERMO CHAP2 (Premier Principe)Lerrys ObiangPas encore d'évaluation
- COURS 1 Thermo Medecine 2016Document10 pagesCOURS 1 Thermo Medecine 2016Anonymous 7InwoqPas encore d'évaluation
- Thermo CorrectionDocument34 pagesThermo CorrectionLilia BennaceurPas encore d'évaluation
- Série 4 Thermo - Avec CorrigéDocument3 pagesSérie 4 Thermo - Avec CorrigéKhdija ChakriPas encore d'évaluation
- Chapitre-II, Le Premier Principe de La ThermodynamiqueDocument12 pagesChapitre-II, Le Premier Principe de La ThermodynamiqueSalima SouhilaPas encore d'évaluation
- Echangeurs de Chaleur-Chap 2Document10 pagesEchangeurs de Chaleur-Chap 2MechmedPas encore d'évaluation
- Cours de La ThermodynamiqueDocument143 pagesCours de La ThermodynamiqueelarifdouaaPas encore d'évaluation
- Micro + Corigé TypeDocument4 pagesMicro + Corigé TypeSabah AmrPas encore d'évaluation
- A. Applications Des Principes de La Thermodynamique: A. I. Étude Des Systèmes FermésDocument14 pagesA. Applications Des Principes de La Thermodynamique: A. I. Étude Des Systèmes FermésMihnea GamanPas encore d'évaluation
- Contrôle de Thermodynamique IIDocument2 pagesContrôle de Thermodynamique IIMomoBjPas encore d'évaluation
- Mines Ponts 2005 PDFDocument3 pagesMines Ponts 2005 PDFJean Donald BonyPas encore d'évaluation
- Corrigé Du TD N°2Document4 pagesCorrigé Du TD N°2saidihakima87Pas encore d'évaluation
- Thermodynamique II Serie N°2 SMP 3 2013-2014 FSR by ExosupDocument6 pagesThermodynamique II Serie N°2 SMP 3 2013-2014 FSR by Exosupzamora_1985Pas encore d'évaluation
- Thermodynamique Partie3Document18 pagesThermodynamique Partie3Youness Ait laasriPas encore d'évaluation
- ThermoDocument4 pagesThermoAntes de Partir, A.C.Pas encore d'évaluation
- Thermodynamique II Serie N°1 SMP 3 2013-2014 FSR by Exosup PDFDocument6 pagesThermodynamique II Serie N°1 SMP 3 2013-2014 FSR by Exosup PDFzamora_1985Pas encore d'évaluation
- Chap3 Thermo1 2007Document42 pagesChap3 Thermo1 2007Dana CapbunPas encore d'évaluation
- Cinet PDFDocument10 pagesCinet PDFLilMalcPas encore d'évaluation
- Support de Cours - chm106 - Semaine 3Document9 pagesSupport de Cours - chm106 - Semaine 3TILABE LAREPas encore d'évaluation
- Test Premier Principe-Esp Corrige PDFDocument10 pagesTest Premier Principe-Esp Corrige PDFmednourPas encore d'évaluation
- Test Premier Principe-Esp PDFDocument4 pagesTest Premier Principe-Esp PDFmednourPas encore d'évaluation
- Formules Thermodynamique MathcadDocument3 pagesFormules Thermodynamique MathcadTheCowSayMooPas encore d'évaluation
- Exos Thermodynamiques+SolutionsDocument80 pagesExos Thermodynamiques+SolutionsibrahimPas encore d'évaluation
- THMOPQ - 04 Travail de Compression Adiabatique Reversible PDFDocument2 pagesTHMOPQ - 04 Travail de Compression Adiabatique Reversible PDFBertin KamsipaPas encore d'évaluation
- Thermodynamique PDFDocument4 pagesThermodynamique PDFRedouane AmianPas encore d'évaluation
- Bouhaouss-S4-Cha.i - II Et III Et IV 2015-16Document58 pagesBouhaouss-S4-Cha.i - II Et III Et IV 2015-16Rihab khPas encore d'évaluation
- Pompes À ChaleurDocument15 pagesPompes À ChaleurMohamed El-amine BendjoudaPas encore d'évaluation
- DiagrammeDocument1 pageDiagrammeMohamed El-amine BendjoudaPas encore d'évaluation
- Composants Dune Machine FrigorifiqueDocument27 pagesComposants Dune Machine FrigorifiqueMohamed El-amine BendjoudaPas encore d'évaluation
- Conductivite ThermiqueDocument6 pagesConductivite ThermiqueMohamed El-amine BendjoudaPas encore d'évaluation
- Résumé SDMDocument11 pagesRésumé SDMMohamed El-amine BendjoudaPas encore d'évaluation
- Chapitre I PartieiDocument5 pagesChapitre I PartieiMohamed El-amine BendjoudaPas encore d'évaluation
- Fiche td4 Correction 5Document12 pagesFiche td4 Correction 5Mohamed El-amine BendjoudaPas encore d'évaluation
- Recmn NBDocument107 pagesRecmn NBMohamed El-amine BendjoudaPas encore d'évaluation
- chapitreIII CompositesDocument18 pageschapitreIII CompositesMohamed El-amine BendjoudaPas encore d'évaluation
- AilettesDocument8 pagesAilettesMohamed El-amine BendjoudaPas encore d'évaluation
- Chapitre II Les VerresDocument14 pagesChapitre II Les VerresMohamed El-amine BendjoudaPas encore d'évaluation
- Exercices - Corriges - Series - Entieres-3-9 mdf-1-6Document6 pagesExercices - Corriges - Series - Entieres-3-9 mdf-1-6Mohamed El-amine BendjoudaPas encore d'évaluation
- Emploi Du Temps 1ere ST Semetre 2Document2 pagesEmploi Du Temps 1ere ST Semetre 2Mohamed El-amine BendjoudaPas encore d'évaluation
- Corrige Ftd03p1Document3 pagesCorrige Ftd03p1Mohamed El-amine BendjoudaPas encore d'évaluation
- Création Dun CVDocument2 pagesCréation Dun CVMohamed El-amine BendjoudaPas encore d'évaluation
- Les Éléments de La CommunicationDocument9 pagesLes Éléments de La CommunicationMohamed El-amine BendjoudaPas encore d'évaluation
- Chapitre 2Document14 pagesChapitre 2Mohamed El-amine BendjoudaPas encore d'évaluation
- Corrige Ftd2maths4Document2 pagesCorrige Ftd2maths4Mohamed El-amine BendjoudaPas encore d'évaluation
- Chapitre 1Document34 pagesChapitre 1Mohamed El-amine BendjoudaPas encore d'évaluation
- FTD03 Maths4Document1 pageFTD03 Maths4Mohamed El-amine BendjoudaPas encore d'évaluation
- TD1 +correction Math2-2022Document4 pagesTD1 +correction Math2-2022Mohamed El-amine Bendjouda100% (1)
- TP N° 002 ThermodynamiqueDocument3 pagesTP N° 002 ThermodynamiqueMohamed El-amine BendjoudaPas encore d'évaluation
- Exposé de FrançaisDocument3 pagesExposé de FrançaisMohamed El-amine BendjoudaPas encore d'évaluation
- TP Physique n1 Les Mesures ElectriquesDocument18 pagesTP Physique n1 Les Mesures ElectriquesMohamed El-amine BendjoudaPas encore d'évaluation
- VZPX Model Operation Manual FTKK FTXK CP CompressedDocument22 pagesVZPX Model Operation Manual FTKK FTXK CP CompressedJUDITH CASILLASPas encore d'évaluation
- ATIA AbdelmalekDocument91 pagesATIA AbdelmalekRedouane Reda100% (1)
- Essai de TractionDocument6 pagesEssai de Tractionrbouzayen48Pas encore d'évaluation
- Table Thermodynamique R404ADocument4 pagesTable Thermodynamique R404ASoukaina Jirari100% (1)
- Exercice 1Document4 pagesExercice 1Omar GhPas encore d'évaluation
- Elementos de Précarregamento KistlerDocument2 pagesElementos de Précarregamento KistlerALEX_INSPETORPas encore d'évaluation
- Af 5052Document14 pagesAf 5052Verdi bobPas encore d'évaluation
- Chapitre 1 Hydraulique Des SolsDocument6 pagesChapitre 1 Hydraulique Des SolsMar WaPas encore d'évaluation
- Série 2 (PR Mahdade Allal)Document3 pagesSérie 2 (PR Mahdade Allal)Majed GharibPas encore d'évaluation
- Corrige Physique PC 2022Document4 pagesCorrige Physique PC 2022Lionel MonteiroPas encore d'évaluation
- Chapitre 3 Flexion Composée (ELU)Document12 pagesChapitre 3 Flexion Composée (ELU)Raouf MouyetPas encore d'évaluation
- B Oscillateurs Et OndesDocument33 pagesB Oscillateurs Et OndesjPas encore d'évaluation
- Note de Calcul PannesDocument12 pagesNote de Calcul PannesAbdelilah ElmahsaniPas encore d'évaluation
- Ondes Et Signaux - Chapitre 4-Circuits Lineaires Du Second OrdreDocument46 pagesOndes Et Signaux - Chapitre 4-Circuits Lineaires Du Second Ordrealphamamadoud330Pas encore d'évaluation
- 2010-11 Cours 03-Premier-Principe ThermoDocument16 pages2010-11 Cours 03-Premier-Principe ThermoSèíf KâdŕïPas encore d'évaluation
- Norme Essai OedométriqueDocument86 pagesNorme Essai Oedométriqueahmadomar8971% (7)
- TP1 C03Document15 pagesTP1 C03ToufikJalalEddinePas encore d'évaluation
- Cours Hydrostatique TC3 v2008Document91 pagesCours Hydrostatique TC3 v2008Sammer Malek100% (1)
- Hydraulique de Station de PompageDocument126 pagesHydraulique de Station de PompageZineb AssafianiPas encore d'évaluation
- Armatures TransversalesDocument4 pagesArmatures Transversalesfarid RezigPas encore d'évaluation
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Document5 pagesChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- Le Barycentre Dans Le Plan Serie D Exercices 1 3Document2 pagesLe Barycentre Dans Le Plan Serie D Exercices 1 3Sabori BabaPas encore d'évaluation
- Xercice: Td1 Mas - Plaque Et Bilan de PuissanceDocument6 pagesXercice: Td1 Mas - Plaque Et Bilan de Puissancetiaiba ramziPas encore d'évaluation
- Courschimietheorique M1Document103 pagesCourschimietheorique M1zgazgaPas encore d'évaluation
- Serie Dexercices N8 Lycee Pilote - Physique MOUVEMENT RECTILIGNE - 3eme Sciences Exp 2015-2016 MR MABROUKI SALAHDocument6 pagesSerie Dexercices N8 Lycee Pilote - Physique MOUVEMENT RECTILIGNE - 3eme Sciences Exp 2015-2016 MR MABROUKI SALAHRaslen Melki0% (1)
- P bts99Document2 pagesP bts99Gueye OusmanePas encore d'évaluation
- Chapitre17 - Forces CentralesDocument6 pagesChapitre17 - Forces CentralesYahya SahelPas encore d'évaluation