Académique Documents
Professionnel Documents
Culture Documents
Cours 03 Notions de Travail
Transféré par
Siham SmallTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Cours 03 Notions de Travail
Transféré par
Siham SmallDroits d'auteur :
Formats disponibles
Université d’Alger 1/ Faculté SC de la matière / L1
Cours avec applications de thermodynamique chimique
Notions de travail et de chaleur
L'énergie échangée entre un système et le milieu extérieur peut être mécanique,
thermique, électrique…etc. Nous allons nous intéresser par la suite à deux formes d’énergie :
l'énergie mécanique ou travail (W) et l'énergie thermique ou chaleur (Q).
Travail mécanique W
Le travail mécanique résulte d’une variation du volume due aux forces de pression qui
s’exercent sur le système.
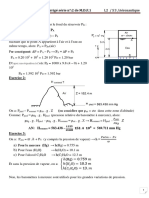
Un gaz enfermé dans un récipient par un piston, qui peut se déplacer sans frottement. Sous
l'effet de la pression (p) exercée par le gaz, le piston subit une force F qui le déplace d'une
position initiale (A) à une position finale (B) tout en parcourant une distance dl.
le travail élémentaire δw est donné par la relation 𝜕𝑊 = −𝐹 𝑑𝑙 … … (01)
𝐹
On sait que : 𝑃 =, d’où 𝐹 = 𝑃. 𝑆
𝑆
(01) devienent 𝜕𝑊 = −𝑃. 𝑆𝑑𝑙
Donc 𝜕𝑊 = −𝑃 𝑑𝑉 … … (02)
𝑾 = −𝑷 ∆𝑽
( Joule ou L.atm ) ( Pa ou atm ) ( m3 ou L )
Remarque :
Le signe (-) intervient pour se conforme à la convention de signe
- Compression : le gaz reçoit du travail ΔV ˂ 0
- Détente : le gaz fournit du travail ΔV ˃ 0
Le travail lors d’une transformation réversible :
Lors d’une transformation réversible la condition d’équilibre mécanique entre le
système et le milieu extérieur à chaque instant nous permet d’écrire :
Preparé par : M. Amaouche Hamza
Université d’Alger 1/ Faculté SC de la matière / L1
Cours avec applications de thermodynamique chimique
Pext = Pint = Pgaz
𝑉2
D’où l’expression du travail dans ce cas devient : 𝑊 = − ∫𝑉1 𝑃𝑔𝑎𝑧 𝑑𝑉
Transformation isotherme : ( T = constante )
𝑉2
𝑊 = − ∫ 𝑃 𝑑𝑉
𝑉1
𝑛𝑅𝑇
Comme gaz parfait ; 𝑃𝑉 = 𝑛𝑅𝑇 ↔ 𝑃 =
𝑉
𝑉2
𝑛𝑅𝑇
𝑊 = −∫ 𝑑𝑉
𝑉1 𝑉
𝑉2 𝑑𝑉
Et comme T = constante ; 𝑊 = −𝑛𝑅𝑇 ∫𝑉1
𝑉
𝑉2
𝑊 = −𝑛𝑅𝑇 ln
𝑉1
𝑉2 𝑃1
Et comme (P1 V1 = P2 V2 = nRT); nous avons =
𝑉1 𝑃2
𝑉2 𝑃1
on peut écrire 𝑊 = −𝑛𝑅𝑇 ln = −𝑛𝑅𝑇 ln
𝑉1 𝑃2
𝑉2 𝑃1
on peut aussi écrire 𝑊 = −𝑃𝑉 ln = −𝑃𝑉 ln
𝑉1 𝑃2
Transformation isobare : ( P = constante )
𝑉2
𝑊 = − ∫ 𝑃 𝑑𝑉
𝑉1
𝑉2
𝑊 = −𝑃 ∫ 𝑑𝑉 = −𝑃 (𝑉2 − 𝑉1 )
𝑉1
𝑉2 𝑇2
Et comme P = constante ; nous avons =
𝑉1 𝑇1
𝑊 = −𝑛𝑅 (𝑇2 − 𝑇1 )
Transformation isochore : ( V = constante )
𝑉2
𝑊 = − ∫ 𝑃 𝑑𝑉
𝑉1
Et comme P = constante ; nous avons ( ∆𝑉 = 0 )
𝑉1 𝑉2
𝑊 = − ∫ 𝑃 𝑑𝑉 = − ∫ 𝑃 𝑑𝑉 = 0
𝑉1 𝑉2
Le travail lors d’une transformation Irréversible :
Preparé par : M. Amaouche Hamza
Université d’Alger 1/ Faculté SC de la matière / L1
Cours avec applications de thermodynamique chimique
Pour les transformations irréversibles qui sont des transformations rapides et spontanées,
la pression du milieu extérieur est égale à la pression finale du système (gaz) 𝑃𝑒𝑥𝑡 = 𝑃𝑓
𝑉2
𝑊𝑖𝑟𝑟 = − ∫ 𝑃𝑓 𝑑𝑉
𝑉1
𝑉2
𝑊𝑖𝑟𝑟 = − 𝑃𝑓 ∫𝑉1 𝑑𝑉= − 𝑃𝑓 (𝑉2 − 𝑉1 )
1 1
𝑊𝑖𝑟𝑟 = − 𝑃𝑓 ( − ) 𝑛𝑅𝑇
𝑃2 𝑃1
Remarque :
le travail n’est pas une fonction d’état; il dépend du chemin suivi
|𝑊𝑟𝑒𝑣 | > |𝑊𝑖𝑟𝑟 |
Preparé par : M. Amaouche Hamza
Vous aimerez peut-être aussi
- Cours Thermodynamique-ConvertiDocument45 pagesCours Thermodynamique-ConvertiRedOne DerrouazinPas encore d'évaluation
- Cours Chimie Chap III Principe2 ThermodynamiqueDocument5 pagesCours Chimie Chap III Principe2 ThermodynamiqueDoudou AminePas encore d'évaluation
- Chapitre IV Les Potentiels ThermodynamiqueDocument4 pagesChapitre IV Les Potentiels ThermodynamiqueDoudou AminePas encore d'évaluation
- Cours 1Document11 pagesCours 1Himer IlyesPas encore d'évaluation
- ENGI Test 2 FormulaireDocument2 pagesENGI Test 2 Formulaireanthony duboisPas encore d'évaluation
- MDF - TD1 CorrigéDocument5 pagesMDF - TD1 CorrigéBenjamin Édouard YargaPas encore d'évaluation
- Exercice 1:: Tapez Une Équation IciDocument8 pagesExercice 1:: Tapez Une Équation IcizeblaouarPas encore d'évaluation
- Chapitre 3 (Partie 1) - ThermodynamiqueDocument18 pagesChapitre 3 (Partie 1) - ThermodynamiquemaryembenhettalPas encore d'évaluation
- Rend Poly LongDocument52 pagesRend Poly Longspartacus.avoukarouillePas encore d'évaluation
- Chapitre 2 Thermodynamique PhysiqueDocument11 pagesChapitre 2 Thermodynamique PhysiqueChaka TraorePas encore d'évaluation
- (Chapitre III) Le Premier Principe de La Thermodynamique PDFDocument21 pages(Chapitre III) Le Premier Principe de La Thermodynamique PDFRamzi OunisPas encore d'évaluation
- Cours 1 Mouvement de Chute Verticale D'un SolideDocument4 pagesCours 1 Mouvement de Chute Verticale D'un Solideyassin bhPas encore d'évaluation
- Chapitre 6 LET52Document8 pagesChapitre 6 LET52Lionel ThiombianoPas encore d'évaluation
- Chapitre 1, Corde Vibrante Partie 1Document5 pagesChapitre 1, Corde Vibrante Partie 1Macoc YoutubePas encore d'évaluation
- SynthèseDocument5 pagesSynthèseJean Luc NgouafongPas encore d'évaluation
- Chapitre 3Document4 pagesChapitre 3slamaPas encore d'évaluation
- Cours Thermod Appliquée FDocument12 pagesCours Thermod Appliquée Fbouzidi hamzaPas encore d'évaluation
- DDC - Outils Mathématiques Fev 2021Document47 pagesDDC - Outils Mathématiques Fev 2021abdessamad taoualPas encore d'évaluation
- Chapitre 3 PDFDocument6 pagesChapitre 3 PDFFatima zahra BouhaliPas encore d'évaluation
- L2 Physique MAGRI-STELLA Protocole de TP 1Document3 pagesL2 Physique MAGRI-STELLA Protocole de TP 1Laurent MagriPas encore d'évaluation
- Cours MQ 2016-2017 Definitive - PR BENABICHA PDFDocument83 pagesCours MQ 2016-2017 Definitive - PR BENABICHA PDFSoukainaPas encore d'évaluation
- LoisCons 23Document38 pagesLoisCons 23spartacus.avoukarouillePas encore d'évaluation
- Chapitre - Transformée en ZDocument26 pagesChapitre - Transformée en ZMusic LyricsPas encore d'évaluation
- Statique Du Solide - EssongDocument8 pagesStatique Du Solide - EssongPaul EssongPas encore d'évaluation
- Chap2 CorpsPurDocument22 pagesChap2 CorpsPurJilali EL HAJRIPas encore d'évaluation
- Corrigé TD 3 MarakechDocument5 pagesCorrigé TD 3 MarakechIsmail SalamaPas encore d'évaluation
- Chapitre 8 LET52Document6 pagesChapitre 8 LET52MassoudreguigPas encore d'évaluation
- Cours Thermodynamique 1er PrincipeDocument13 pagesCours Thermodynamique 1er Principemariecurie.academy19Pas encore d'évaluation
- O1.2-Exp2-Thermodynamique Part 1Document24 pagesO1.2-Exp2-Thermodynamique Part 1Lise Maelle NGAMALEU NOUBISSIEPas encore d'évaluation
- RL RempliDocument8 pagesRL Rempliyoussra123elbasriPas encore d'évaluation
- Exercices Corrigés Série 1Document13 pagesExercices Corrigés Série 1hafsayahya2002Pas encore d'évaluation
- TD, GP, L2, Thermodinamique Chimique, Thermodynamique Des Substances Pures - TextMarkDocument5 pagesTD, GP, L2, Thermodinamique Chimique, Thermodynamique Des Substances Pures - TextMarkMä NëlPas encore d'évaluation
- MDF1 StatiqueDocument7 pagesMDF1 StatiqueKadiro OJPas encore d'évaluation
- Chapitre 2: Transformée en Z (USTHB)Document5 pagesChapitre 2: Transformée en Z (USTHB)MohammedPas encore d'évaluation
- Chapitre 3Document12 pagesChapitre 3Wissem BejaouiPas encore d'évaluation
- MecaFluChap34 CorrDocument6 pagesMecaFluChap34 CorrChristian AmadouPas encore d'évaluation
- Chapitre I MDF2 (Parie 2)Document33 pagesChapitre I MDF2 (Parie 2)abdousetif39Pas encore d'évaluation
- Correction TD2 PDFDocument4 pagesCorrection TD2 PDFSamiya CPas encore d'évaluation
- Chap 3Document35 pagesChap 3OMAR ENNAJIPas encore d'évaluation
- Chapitre 1Document9 pagesChapitre 1pfx82574Pas encore d'évaluation
- Dynamique Des Fluides ParfaitsDocument21 pagesDynamique Des Fluides ParfaitsAyoubPas encore d'évaluation
- Chapitre 2 Methode Operationnelle - CopieDocument12 pagesChapitre 2 Methode Operationnelle - Copiecheikh tidiane diopPas encore d'évaluation
- Chapitre 2 Methode OperationnelleDocument12 pagesChapitre 2 Methode Operationnellecheikh tidiane diopPas encore d'évaluation
- Cycle de BraytonDocument6 pagesCycle de BraytonŒūb Æÿ KęVįn0% (1)
- Mecanique Du Point - Chapitre 3-Puissance Et Energie en Referentiel GalileenDocument60 pagesMecanique Du Point - Chapitre 3-Puissance Et Energie en Referentiel GalileenJean AnanPas encore d'évaluation
- Corrigé Exercice 9 TD Thermodynamique 2023Document3 pagesCorrigé Exercice 9 TD Thermodynamique 2023Ouédraogo Youssouf Ibn OusseniPas encore d'évaluation
- cours-2èmeLMD-Thermo-chim-3ème SemaineDocument3 pagescours-2èmeLMD-Thermo-chim-3ème SemaineWaliD MerabeTPas encore d'évaluation
- Compte RenduDocument7 pagesCompte Rendunizarbu29Pas encore d'évaluation
- Résumé Chapitre 2 MDFDocument3 pagesRésumé Chapitre 2 MDFWafaa HmPas encore d'évaluation
- Chap I 01Document6 pagesChap I 01Chanbi ChanbiPas encore d'évaluation
- TleC - PHY - L4 - Mouvement Dans Les Champs G Et E UniformesDocument12 pagesTleC - PHY - L4 - Mouvement Dans Les Champs G Et E UniformesBahi GraceemmaPas encore d'évaluation
- Suite de La Correction Des TD2 - MF6 PDFDocument5 pagesSuite de La Correction Des TD2 - MF6 PDFĶhadija KhadijaPas encore d'évaluation
- CH2Document4 pagesCH2drissboum1bacPas encore d'évaluation
- MecaFlu2014 8aDocument120 pagesMecaFlu2014 8aSilvia JaimesPas encore d'évaluation
- Chapitre2 Le Potentiel ElectriqueDocument14 pagesChapitre2 Le Potentiel ElectriqueHamza BoutlihPas encore d'évaluation
- DS10 CorrigéDocument10 pagesDS10 Corrigétomy.colinPas encore d'évaluation
- 2 Fonction de Transfert Et Opérations Sur Les Schémas BlocsDocument7 pages2 Fonction de Transfert Et Opérations Sur Les Schémas BlocsAnderson NAZAIREPas encore d'évaluation
- Exercices Corrigés Série 1 ElectromagnetismeDocument13 pagesExercices Corrigés Série 1 ElectromagnetismeChelsy LaPas encore d'évaluation
- Exercices d'intégrales et d'équations intégro-différentiellesD'EverandExercices d'intégrales et d'équations intégro-différentiellesPas encore d'évaluation
- Techno Topo 2020Document2 pagesTechno Topo 2020abeyapapsPas encore d'évaluation
- Présentation PFE AMDEC FMEADocument36 pagesPrésentation PFE AMDEC FMEAMSK1989100% (1)
- TD Algorithmes Recherche Nombre Occurrence ListeDocument7 pagesTD Algorithmes Recherche Nombre Occurrence Listemulk omarPas encore d'évaluation
- Développer en Back-End - 10 MigrationDocument17 pagesDévelopper en Back-End - 10 Migrationkhadija kharifPas encore d'évaluation
- Technologie de L'amenagement PDFDocument196 pagesTechnologie de L'amenagement PDFSylv Grz100% (1)
- Alzheimer PDFDocument50 pagesAlzheimer PDFBIENESTAR ORIENTALPas encore d'évaluation
- Piano Kawai FactureDocument1 pagePiano Kawai FactureschweyermatthieuPas encore d'évaluation
- Prévention Et Lutte Contre L'incendie: Combustible ComburantDocument7 pagesPrévention Et Lutte Contre L'incendie: Combustible Comburantطارق بوشنينPas encore d'évaluation
- Commentaires 15 Janv 24Document3 pagesCommentaires 15 Janv 24namasteph78Pas encore d'évaluation
- Apprendre La Prise de NotesDocument4 pagesApprendre La Prise de NotesEnzoPas encore d'évaluation
- A Portee de Maths Livre Maitre 2019Document192 pagesA Portee de Maths Livre Maitre 2019cuq100% (1)
- Nadia MOHYA - La Fête Des KabytchousDocument110 pagesNadia MOHYA - La Fête Des Kabytchousbdjioua1916Pas encore d'évaluation
- Programme AIPR OpérateurDocument3 pagesProgramme AIPR OpérateurBoite PoubellePas encore d'évaluation
- Fiche Technique CrossDocument2 pagesFiche Technique CrossAleksandre MarkovicPas encore d'évaluation
- Jusqu'Au Bout Des Fantasmes (PDFDrive)Document276 pagesJusqu'Au Bout Des Fantasmes (PDFDrive)Levieux BarroPas encore d'évaluation
- Fiche HaricotDocument2 pagesFiche Haricotnuit100% (1)
- Facteur Damplification DynamiqueDocument3 pagesFacteur Damplification DynamiqueMoulay ZoubirPas encore d'évaluation
- Colloïde - WikipédiaDocument9 pagesColloïde - WikipédiaTahafanMaggedonPas encore d'évaluation
- Presentation SYSOCO PDFDocument15 pagesPresentation SYSOCO PDFsalim sadekPas encore d'évaluation
- FocométrieDocument7 pagesFocométrieSaidi AdemPas encore d'évaluation
- Cartographie Des Outils Et Des Acteurs Mobilisables Pour Le MaintienDocument1 pageCartographie Des Outils Et Des Acteurs Mobilisables Pour Le MaintienTor La sagesse0% (1)
- PDF Renover - Rehabiliter - Agrandir Sa Maison PDFDocument72 pagesPDF Renover - Rehabiliter - Agrandir Sa Maison PDFlaunayrPas encore d'évaluation
- Activites Pour Le Cecr - B2 by Eliane Grandet, Martine Corsain, Elettra Mineni, Mariella RainoldiDocument193 pagesActivites Pour Le Cecr - B2 by Eliane Grandet, Martine Corsain, Elettra Mineni, Mariella RainoldiFouad HechaichiPas encore d'évaluation
- Assurance AutomobileDocument8 pagesAssurance AutomobileMagie Douda HindPas encore d'évaluation
- Etude D'un Groupe Electrogene - BOUCHRI Yousra - 2669 PDFDocument35 pagesEtude D'un Groupe Electrogene - BOUCHRI Yousra - 2669 PDFAZIZ50% (2)
- QCM Tspecc81 BrassagesDocument6 pagesQCM Tspecc81 Brassagesmanon HERVE0% (1)
- TD1GL4Document3 pagesTD1GL4Marwen GuesmiPas encore d'évaluation
- Devoir-L Importance Des VoyagerDocument2 pagesDevoir-L Importance Des VoyagermaraPas encore d'évaluation
- Exo Nombre RationDocument8 pagesExo Nombre RationmemtolombernaPas encore d'évaluation
- Les Ancres de CarrièreDocument12 pagesLes Ancres de CarrièreKerstin Dupont100% (1)