Académique Documents
Professionnel Documents
Culture Documents
TP2 Compte Rendu
Transféré par
chachakacemiCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TP2 Compte Rendu
Transféré par
chachakacemiDroits d'auteur :
Formats disponibles
UFR SCIENCES ET TECHNOLOGIES
TRAVAUX PRATIQUES DE
CHIMIE EXPERIMENTALE 2
S2CH424
L2 Chimie
NOM Kacemi Prénoms Chahinez N° 40006837
S Etudiant
Grondin Theo 41003131
Fiche compte rendu TP N°1
1. Détermination du coefficient d’extinction molaire 𝜀 de I2
dans le cyclohexane Valeur de λ max
λ max= 521nm
Tableau de mesure :
Solution 1 2 3 4 5
[ I2](mol . L−1) 10-4 3*10-4 5*10-4 7*10-4 10-3
Absorbance 0.034 0.118 0.201 0.293 0.455
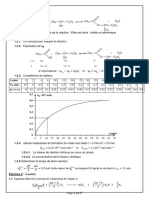
Détermination graphique de 𝜀 :
DETERMINATION GRAPHIQUE DE 𝜀
0.5
0.45
0.4 f(x) = 0.1017 x − 0.0848999999999999
0.35 R² = 0.976529248037101
0.3
absorbance
0.25
0.2
0.15
0.1
0.05
0
0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5
Concentration en mol/L
Valeur de 𝜀 : 0.1017 L⋅mol−1⋅cm−1
2. Étude de l’équilibre de partage en l’absence de KI
Mesures : A0 =0.455
Absrbance de la solution de diode dans le cyclohexane avant partage
A1 =0.362
Absrbance de la solution de diode dans le cyclohexane après partage
Résultats des calculs
Phase cyclohexane avant partage [ I2]org,0 n I2,org,0
Année 2021-20124 X. Chasseray
10-3M 1.5*10-5mol
[ I2]org n I2,org
Phase cyclohexane après partage
3.56M 0.0534mol
n I2,aq [ I2]aq
Phase aqueuse après partage
0.0534mol 3.56M
Valeur de la constante de partage de l’équilibre I 2 (org) ↔ I2 (aq) Conclusion :
La constante d’équilibre est égale à 1 ce qui signifie que la réaction est à l’équilibre.
3. Étude de l’équilibre de partage en présence de KI Mesures :
Absrbance de la solution de diode dans le cyclohexane avant partage
Absrbance de la solution de diode dans le cyclohexane après partage Résultats des calculs :
K=1
A0 = 0,455
A1 = 0,201
[ I2]org,0 n I2,org,0
Phase cyclohexane avant partage
10-3M 1.5*10-5mol
[ I2]org n I2,org
Phase cyclohexane après partage
1.98M 0.03mol
n I2,aq [ I2]aq n I3−,aq [ I3−]aq n I−,aq [ I−]aq
Phase aqueuse après partage
0.03mol 1.98M 0.03mol 0.26M 0.26mol 2.60M
Valeur de la constnted’équilibre de I 2 (aq) + I−(aq) ↔ I3−(aq) K1=0.05
Conclusion :
La constante d’équilibre est égale à 0.05 ce qui signifie que la réaction est à l’équilibre.
4.Equilibre de solubilité de l’acide oxalique
Concentration exacte de la solution de soude
Année 2021-20124 X. Chasseray
[NaOH]=m*2/M*V NaOH
Relation utilisée pour le calcul
Valeur de la concentration [NaOH]=0.99M
Solubilité aux différentes températures
T (°C) 1.1 14.7 24.7 36 50
Veq (mL) 10.1 13.3 16.7 22 38.8
S 0.49 0.65 0.82 1.089 1.19
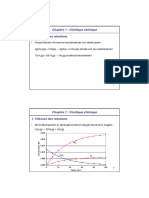
Courbe de variation de s en fonction de T
Courbe de variation de s en fonction de T
1.4
1.2
f(x) = 0.0153241176718625 x + 0.460099822901879
1 R² = 0.973630823685602
0.8
solubilité
0.6
0.4
0.2
0
0 10 20 30 40 50 60
température en C°
CONCLUSION :
Nous observons qu’en augmentant la température la solubilité augmente. Cette augmentation peut être dû
à des changements d'enthalpie et d'entropie de dissolution. La solubilité a tendance à augmenter avec
l'augmentation de la température. Cela est dû à l'augmentation de l'enthalpie de solution à des
températures plus élevées, ce qui favorise la dissociation des ions et la dissolution du soluté.
5.Commentaires et conclusion
Ce TP montre que le diiode se répartit entre l'eau et le cyclohexane, avec une influence importante des ions
iodure. L'étalonnage des solutions de diiode dans le cyclohexane nous a permis d'établir une courbe
d'étalonnage précise. Cette étude permet d’expliquer les mécanismes de dissolution et de répartition des
substances entre des phases non miscibles.
Pour la dernière partie, nous avons étudié la variation de la solubilité de l'acide oxalique en fonction de la
température. Nous avons observé que la solubilité de l'acide oxalique augmente avec l'augmentation de la
température, ce qui montre un processus de dissolution influencé par des facteurs thermodynamiques.
Année 2021-20124 X. Chasseray
KACEMI Chahinez 40006837
NOMS Prénoms N° Etudiant
GRONDIN Théo 41003131
Fiche compte rendu TP N°2
1.Conductivité des solutions de KCl
Tableau de résultats
Solution 1 2 3 4 5
[ KCl] 0.1 0.05 0.01 0.005 0.001
C 0.31 0.22 0.1 0.070 0.031
χ () en S.m-1 1.162 0.605 0.1324 0.0616 0.01301
Λ = Λ°-K(C)1/2 0.82131 0 .36322 0.0225 -0.01533 - 0.021059
Avec Λ°= χ
K =1,099 S.m-1
Représentation graphique
Conductivité des solutions de KCl
1.4
1.2
1 f(x) = 4.16302194104186 x − 0.21383180778032
Conductivité
0.8
0.6
0.4
0.2
0
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35
Racine carrée de la concentration
Conclusion :
Cette étude de la conductivité des solutions de KCl nous permet de mieux comprendre les
propriétés électrolytiques de cette substance et la relation entre sa concentration et sa
conductivité. La courbe est quasi linéaire.
2.Conductivité des solutions de CH3CO2H
Tableau de résultats
Solution 1 2 3 4 5
[ CH3COOH ] 0,1 0,05 0 ,01 0,005 0,001
χ () en S.m-1 0.0455 0.0321 0.01413 0.00985 0.00559
Année 2021-20124 X. Chasseray
Λ = Λ°-K(C)1/2 -0.29519 -0.20968 -0.108487 -0.06708 -0.028479
Avec Λ°= χ
K =1,099 S.m-1
ΛC 0.0455 0.0321 0.01413 0.00985 0.00559
1/Λ -3.39 -4.77 -9.22 -14.9 -35.11
Représentation graphique
pKa de l’acide acétique:
Mode de détermination et calcul :
Nous déterminons le point de changement de pente qui correspond à l’équivalence, et à l’équivalence pH=pKa.
Valeur expérimentale du pKa de l’acide acétique
conclusion
3.Dosage de l’acide oxalique
Dosage pHmétrique :
pH en fonction du volume de soude ajouté
14
12
10
8
pH
0
0 5 10 15 20 25 30
Volume de soude ajouté (mL)
Dosage conductimétrique :
Année 2021-20124 X. Chasseray
Conductivité en fonction du volume de soude
ajouté
6
4
Conductivité
0
0 5 10 15 20 25 30
Volume de soude ajouté (mL)
Commentaire sur les courbes de dosage
Année 2021-20124 X. Chasseray
Mode de détermination et calcul de la concentration en acide oxalique :
[ C2H2O4] =
4.Dosage du mélange acide chlorhydrique glycine
Dosage pHmétrique
Année 2021-20124 X. Chasseray
Commentaire sur les courbes. (on précisera notamment les espèces qui sont dosées entre
chaque volume équivalent)
Année 2021-20124 X. Chasseray
Mode de détermination et calcul de la concentration en glycine
[ C2H5NO2] =
Mode de détermination et calcul de la concentration en acide chlorhydrique
[ HCl] =
5.Commentaires et conclusion générale du TP
Commentaires et conclusion général du TP
Année 2021-20124 X. Chasseray
NOMS Prénoms N° Etudiant
Fiche compte rendu TP N°3
1.Diagramme potentiel- pH du Fer
Tracé du diagramme expérimental et du diagramme théorique (référencé à ESH)
Commentaire : (accord avec le diagramme théorique, pente des frontières entre espèces de degré d’oxydation 2 et
3…)
Exploitation du diagramme
Détermination expérimentale des produits de solubilité de F e (OH)2 et Fe (OH)3
Espèce F e (OH )2 F e (OH )2
pH de précipitation
Ks
pKs
Commentaire :
Année 2021-20124 X. Chasseray
+
Détermination expérimentale des potentiels standards des couples F e2 /Fe3+ , F e
(OH)3/Fe2+ et F e (OH)3/Fe (OH)2
Mode de détermination
Couple F e2+/Fe3+ F e (OH)3/Fe2+ F e (OH)3/Fe (OH)2
Potentiel standard E°
Commentaire :
2.Etude de la corosion du fer
Observations
Système etudié Observation Commentaire et interprétation
Fe seul
Fe/Cu
Année 2021-20124 X. Chasseray
Fe/Zn
Fe/air
3.Commentaires et conclusion générale du TP
Commentaires et conclusion général du TP
Année 2021-20124 X. Chasseray
NOMS Prénoms N° Etudiant
Fiche compte rendu TP N°4
1.Concentration en ethanol dans l’alcool de bois rouge
Volume équivalent du dosage réalisé Veq=
Mode de détermination et calcul de la concentration en éthanol dans l’alcool de bois rouge:
[ C2H50H] =
2.Validation de la méthode de suivie de la concentration en permanganate au cours
du temps
Système etudié Observation Conclusion
Expérience 1
Expérienc 2
Fe/Zn
3.détermination de l’ordre de la réaction par rapport à l’ion permanganate
Tableau de résultats
Temps
(min)
Année 2021-20124 X. Chasseray
V(Na2SO3
(mL)
[MnO4-]
mol.L-1
l n[MnO4−]
Détermination graphique de l’ordre de la réaction
Année 2021-20124 X. Chasseray
Année 2021-20124 X. Chasseray
Conclusion :
Valeur de la constente de vitesse apparente : k app =
4.détermination de l’ordre de la réaction par rapport à l’éthanol
Préparation des solution d’alcool de bois rouge
facteur de dilution 2 5 10 50
Fiole utilisée 20 20 20 50
volume d’alcool de bois rouge
[ C2H5OH]
Suivi cinétique des réactions pour les différentes concentration en ethanol
facteur de dilution 2 [C2H5OH]=
t(min) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
[ MnO4−]
l n[MnO4−]
t(min) 5,5 6 6,5 7 7,5 8 8,5 9 9,5 10
[ MnO4−]
l n[MnO4−]
facteur de dilution 5 [C2H5OH]=
t(min) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
[ MnO4−]
l n[MnO4−]
t(min) 5,5 6 6,5 7 7,5 8 8,5 9 9,5 10
[ MnO4−]
l n[MnO4−]
Année 2021-20124 X. Chasseray
facteur de dilution 10 [C2H5OH]=
t(min) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
[ MnO4−]
l n[MnO4−]
t(min) 5,5 6 6,5 7 7,5 8 8,5 9 9,5 10
[ MnO4−]
l n[MnO4−]
facteur de dilution 20 [C2H5OH]=
t(min) 0,5 1 1,5 2 2,5 3 3,5 4 4,5 5
[ MnO4−]
l n[MnO4−]
t(min) 5,5 6 6,5 7 7,5 8 8,5 9 9,5 10
[ MnO4−]
l n[MnO4−]
Détermination graphique des constantes de vitesse apparantes
Facteur de dilution 2
0 5 10 15 20 25 30 35 40 45 50 55 60
Facteur de dilution 5
Année 2021-20124 X. Chasseray
0 5 10 15 20 25 30 35 40 45 50 55 60
0 5 10 15 20 25 30 35 40 45 50 55 60
10 Facteur de dilution 20
0 5 10 15 20 25 30 35 40 45 50 55 60
facteur de dilution 2 5 10 50
Année 2021-20124 X. Chasseray
[ C2H5OH] 20 20 20 50
Constante de vitesse apparente kapp
l n[C2H5OH]
l nkapp
Détermination graphique de l’ordre par rapport à l’éthanol
0 5 10 15 20 25 30 35 40 45 50 55 60
Mode de détermination de l’ordre par rapport à l’éthanol:
Valeur de l’ordre par rapport à l’éthanol : n C2H5OH =
5.Commentaires et conclusion générale du TP
Commentaires et conclusion général du TP
NOMS Prénoms N° Etudiant
Fiche compte rendu TP N°5
1.détermination du pouvoir rotatoire spécifique du glucose du fructose et du
saccharose
Détermination graphique du pouvoir rotatoire spécifique du glucose :
Solution 1 2 3 4 5 6 7
Concentration (g.L-1) 10 20 30 40 60 80 100
Année 2021-20124 X. Chasseray
α (degré)
[ α]TD = Unité
Détermination graphique du pouvoir rotatoire spécifique du fructose :
Solution 1 2 3 4 5 6 7
Concentration (g.L-1) 10 20 30 40 60 80 100
α (degré)
[ α]TD = Unité
Détermination graphique du pouvoir rotatoire spécifique du saccharose :
Solution 1 2 3 4 5 6 7
Concentration (g.L-1) 10 20 30 40 60 80 100
α (degré)
Année 2021-20124 X. Chasseray
[ α]TD = Unité
2.Vérification de la loi d’additivité
Mélange 1 2 3 4
α theorique (degré)
α mesure (degré)
Conclusion :
3.Etude cinétique de l’inversion du saccharose
Détermination détermination des pouvoirs rotatoires initial et final
α 0= α ∞=
Suivie cinétique de l’inversion à [HCl]=0,2M
t(min
3 6 9 12 15 20 25 30 35 40 55 50
)
Y = ln
Année 2021-20124 X. Chasseray
100
90
80
70
60
50
40
30
20
10
0
0 5 10 15 20 25 30 35 40 45 50
Constante de vitesse apparente kapp= Unité
Suivie cinétique de l’inversion à [HCl]=0,5M
t(min 3 6 9 12 15 20 25 30 35 40 55 50
)
α
Y
100
90
80
70
60
50
40
30
20
10
0
0 5 10 15 20 25 30 35 40 45 50
Constante de vitesse apparente kapp= Unité
Année 2021-20124 X. Chasseray
Suivie cinétique de l’inversion à [HCl]=1M
t(min
3 6 9 12 15 20 25 30 35 40 55 50
)
100
90
80
70
60
50
40
30
20
10
0
0 5 10 15 20 25 30 35 40 45 50
Constante de vitesse apparente kapp= Unité
k1
Détermination graphique de la constante de vitesse k = k2
k−1
100
90
80
70
60
50
40
30
20
10
0
0 5 10 15 20 25 30 35 40 45 50
Année 2021-20124 X. Chasseray
Valeur de k= Unité
4.Commentaires et conclusion générale du TP
Commentaires et conclusion général du TP
Année 2021-20124 X. Chasseray
NOMS Prénoms N° Etudiant
Fiche compte rendu TP N°6
Suivi cinétique
Températur T=. 25
e N°1 °C
T( 1 2 3 4 5 6 7 8 9 1
mi 0
n)
σ 9. 8 8 7 7. 7. 7 6 6 6
(S. 14 . . . 4 22 . . . .
m-
5 0 7 5 0 8 7 6
1)
3 8 3 4 8 5 4
T( 12 1 1 1 20 22 2 2 2 3
mi 4 6 8 4 6 8 0
n)
σ 6. 6 6 6 6. 6. 5 5 5 5
(S. 46 . . . 0 02 . . . .
m-
3 2 1 8 9 9 9 8
1)
3 3 5 8 4 1 9
T( 32 3 3 3 40 42 4
mi 4 6 8 5
n)
σ 5. 5 5 5 5. 5. 5
(S. 86 . . . 8 80 .
m-
8 8 8 1 7
1)
5 3 2 9
σ 11.80(S.m-1) σ 3.90(S.m-1)
0 ∞
= =
Températur T=. 45
e N°2 °C
T(
1
mi 1 2 3 4 5 6 7 8 9
0
n)
σ 8. 6 6 6 5. 5. 5 5 5 5
(S. 01 . . . 9 87 . . . .
m- 8 3 1 7 8 7 7 7
1) 4 6 2 0 5 2 0
T(
1 1 1 2 2 2 3
mi 12 20 22
4 6 8 4 6 8 0
n)
σ 5. 5 5 5 5. 5. 5 5 5 5
(S. 66 . . . 6 60 . . . .
m- 6 6 6 1 6 5 5 5
1) 4 3 1 0 9 9 8
T(
3 3 3 4
mi 32 40 42
4 6 8 5
n)
Année 2021-20124 X. Chasseray
σ 5. 5 5 5 5. 5. 5
(S. 58 . . . 5 56 .
m- 5 5 5 7 5
1) 8 7 7 6
σ 11.03(S.m-1) σ 3.84(S.m-1)
0 ∞
= =
Températur T=. 60
e N°3 °C
T( 1 2 3 4 5 6 7 8 9 1
mi 0
n)
σ 8. 7 7 7 7. 7. 7 7 7 7
(S. 92 . . . 4 43 . . . .
m-
8 5 4 4 4 4 4 4
1)
7 9 9 2 2 2 2
T( 12 1 1 1 20 22 2 2 2 3
mi 4 6 8 4 6 8 0
n)
σ 7. 7 7 7 7. 7. 7 7 7 7
(S. 42 . . . 4 42 . . . .
m-
4 4 4 2 4 4 4 4
1)
2 2 2 1 1 0 0
T( 32 3 3 3 40 42 4
mi 4 6 8 5
n)
σ 7. 7 7 7 7. 7. 7
(S. 40 . . . 3 38 .
m-
3 3 3 8 3
1)
9 9 8 8
σ 10.27(S.m-1) σ 3.95(S.m-1)
0 ∞
= =
Montrer par une méthode graphique que la réaction est d’ordre global égal à 2
Température N° T=. 25 °C
Suivi cinétique à 25°
2.5
f(x) = 0.0589456077549339 x + 0.57856356321475
R² = 0.908304070142687
2
conductivité
1.5
0.5
0
0 5 10 15 20 25 30 35 40
temps en minutes
Année 2021-20124 X. Chasseray
Constante de vitesse k1= 0.0589 Unité L .mol-1.min-1
Température N° T=. 45 °C
Suivi cinétique à 45°
3
f(x) = 0.124486842105263 x + 1.22482894736842
R² = 0.733717860677377
2.5
2
conductivité
1.5
0.5
0
0 2 4 6 8 10 12 14 16 18
Temps en minutes
Constante de vitesse k2= 0.1245 Unité L .mol-1.min-1
Température N°3 T=. 60 °C
Suivi cinétique à 60°
0.9
f(x) = 0.0504666666666667 x + 0.469111111111111
0.8 R² = 0.575250291113996
0.7
0.6
conductivité
0.5
0.4
0.3
0.2
0.1
0
0 1 2 3 4 5 6 7 8 9 10
Temps en minutes
Constante de vitesse k3= 0.0505 Unité L .mol-1.min-1
Année 2021-20124 X. Chasseray
Détermination de lénergie d’activation et du facteur préexponentiel
données utilisées
Grandeurs Valeur
Ln(K) -2.83 -2.08 -2.98
1/Températures en 1/298 1/318 1/333
kelvin
Méthode de détermination utilisée
méthode de détermination de Ea
0
0.00 0.00 0.00
-0.5
-1
-1.5
ln(k)
-2
f(x) = 2589.28571428571 x − 10.4914285714286
R² = 0.576173887497972
-2.5
-3
-3.5
1/T en kelvin
Energie d’activation 21 514.59 Unité J.mol-1
Facteur préexponentiel 2.77*10-5 Unité L .mol-1.min-1
Commentaires et conclusion générale du TP
Commentaires et conclusion général du TP
Année 2021-20124 X. Chasseray
Vous aimerez peut-être aussi
- Etude de La Réaction de Saponification de LDocument11 pagesEtude de La Réaction de Saponification de Lselmi nourelhouda100% (2)
- Electrochimie - Compte Rendu TP - Titrages Conductimétrique 6565Document7 pagesElectrochimie - Compte Rendu TP - Titrages Conductimétrique 6565Khezazna Seif89% (9)
- Listes Des Industriel de Cote D'ivoireDocument19 pagesListes Des Industriel de Cote D'ivoiresoumtrustpower100% (2)
- Exem PCDocument6 pagesExem PCwfwgPas encore d'évaluation
- SVT 2nd C - L11 - Labsorption de Leau Par La PlanteDocument14 pagesSVT 2nd C - L11 - Labsorption de Leau Par La PlanteBilal DiarraPas encore d'évaluation
- TD de CinétiqueDocument14 pagesTD de CinétiqueDieu-donné Akin100% (2)
- Sodium Et PotassiumDocument3 pagesSodium Et PotassiumlakhzoumnesrinePas encore d'évaluation
- Compte Rendu Cinitique 2Document4 pagesCompte Rendu Cinitique 2Rahmanov DzPas encore d'évaluation
- TD DésinfectionDocument2 pagesTD DésinfectionwalidPas encore d'évaluation
- tp2 Chimie de CoordinationDocument6 pagestp2 Chimie de CoordinationNour DriaPas encore d'évaluation
- C Ex09 Cin CaDocument3 pagesC Ex09 Cin CaKhadija BiallachPas encore d'évaluation
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- Vitesse de MigrationDocument5 pagesVitesse de MigrationNada Merzoug0% (1)
- Exercices de Révision C132Document18 pagesExercices de Révision C132abraham LincolnPas encore d'évaluation
- TP GR 1 Trinome N°7Document14 pagesTP GR 1 Trinome N°7Mohamed TaanePas encore d'évaluation
- TD Revision CinetiqueDocument9 pagesTD Revision CinetiqueMy ProofPas encore d'évaluation
- Gabarit de Rapport-2013Document6 pagesGabarit de Rapport-2013KyuriPas encore d'évaluation
- tp15 Maiver PDFDocument19 pagestp15 Maiver PDFMessouaf FouadPas encore d'évaluation
- TP2 RéacteurDocument9 pagesTP2 RéacteurÄyyoüb El-BchiriPas encore d'évaluation
- Exercices Revisions Physiques Chimie 1Document13 pagesExercices Revisions Physiques Chimie 1Loup Jouandet-DahlenPas encore d'évaluation
- Exercices de Re Visions - PC - Ts-2Document16 pagesExercices de Re Visions - PC - Ts-2baatout oumaymaPas encore d'évaluation
- D.C1 4M 09.01 Hemmemi - LotfiDocument3 pagesD.C1 4M 09.01 Hemmemi - LotfiMohamed SaidiPas encore d'évaluation
- ch9 Hydrolyse Basique EsterDocument2 pagesch9 Hydrolyse Basique EstermohamedPas encore d'évaluation
- TD Chapitre3 Corrige1Document34 pagesTD Chapitre3 Corrige1Niwir NikabouPas encore d'évaluation
- TPS 11 2009 Extraction Quantitative CompletDocument2 pagesTPS 11 2009 Extraction Quantitative CompletAabed omairPas encore d'évaluation
- C2Chim Suivi Cinetique ExercicesDocument8 pagesC2Chim Suivi Cinetique ExercicesMohamed El OuahdaniPas encore d'évaluation
- Membrane LiquideDocument5 pagesMembrane LiquideBichou Derres100% (1)
- Dev de Con1 4sc Exp 2018 2019Document5 pagesDev de Con1 4sc Exp 2018 2019Barhoumi Mourad100% (1)
- Séparation 2Document7 pagesSéparation 2ABDERRAHMANE ARTPas encore d'évaluation
- Chimie TP2 Dosage CorrDocument3 pagesChimie TP2 Dosage CorrChartier JulienPas encore d'évaluation
- TP Thermodynamique: Réfractions MolaireDocument8 pagesTP Thermodynamique: Réfractions MolaireAya DOGHMANEPas encore d'évaluation
- 03 Suivi Spectro CorDocument5 pages03 Suivi Spectro CorChartier JulienPas encore d'évaluation
- TP 2Document5 pagesTP 2Zz BbPas encore d'évaluation
- Ex TDDocument4 pagesEx TDDjihane RamdaniPas encore d'évaluation
- 1cm3usujd 504803Document4 pages1cm3usujd 504803sowpapagora444Pas encore d'évaluation
- TP 15 CF 2009Document10 pagesTP 15 CF 2009sidi mohamed el amine nekkalPas encore d'évaluation
- Corrige Bac PC Serie s1 2013 PDFDocument6 pagesCorrige Bac PC Serie s1 2013 PDFngariPas encore d'évaluation
- Ads TPDocument6 pagesAds TPcélia ferPas encore d'évaluation
- Examens Rsolusde Chimiedes Matriaux Tayssir HamiehDocument31 pagesExamens Rsolusde Chimiedes Matriaux Tayssir HamiehRami OmriPas encore d'évaluation
- Bac S Physique Chimie Specialite Asie 2011 SujetDocument10 pagesBac S Physique Chimie Specialite Asie 2011 SujetMoad BarbariPas encore d'évaluation
- Série 2Document2 pagesSérie 2Farouk OmarPas encore d'évaluation
- Cinétique Chimie Chap 1Document28 pagesCinétique Chimie Chap 1Sebastien HerdiesPas encore d'évaluation
- TP Chimie Des Surfaces Adsorption Dun SolideDocument9 pagesTP Chimie Des Surfaces Adsorption Dun SolideAnis Sellam100% (1)
- GEE TD SAA CDocument12 pagesGEE TD SAA CKawtar DAIMIPas encore d'évaluation
- TP ConductiemetrieDocument7 pagesTP ConductiemetrieSellam AnisPas encore d'évaluation
- C03 Cinetique ReactionDocument2 pagesC03 Cinetique ReactionmohPas encore d'évaluation
- Cinétique Chimique Exercices 04.TextMarkDocument16 pagesCinétique Chimique Exercices 04.TextMarkAbedPas encore d'évaluation
- Rapport TP 01Document4 pagesRapport TP 01Ahmed SaciPas encore d'évaluation
- Extraction Liquide-Liquide de L'iode: 3 Année LicenceDocument5 pagesExtraction Liquide-Liquide de L'iode: 3 Année LicenceÖyku SonuPas encore d'évaluation
- v3 Diagramme de Lair HumideDocument32 pagesv3 Diagramme de Lair HumideAbdo settiPas encore d'évaluation
- TDcinét Chim.17-18 Fiche2Document2 pagesTDcinét Chim.17-18 Fiche2Joseph AmondPas encore d'évaluation
- Convert Thermo Compte Rendu 1704130437243Document15 pagesConvert Thermo Compte Rendu 1704130437243Ouu SsaamaPas encore d'évaluation
- Ion Chromato 09Document15 pagesIon Chromato 09Tojo RandrianomananaPas encore d'évaluation
- Corrigé Épreuve 2 Compo 1sem TS2 IEASNDocument5 pagesCorrigé Épreuve 2 Compo 1sem TS2 IEASNt87d4jyrqkPas encore d'évaluation
- Exercice Corrigé CinétiqueDocument13 pagesExercice Corrigé Cinétiquejakobslimani02Pas encore d'évaluation
- Syllabus de Chimie 2Document143 pagesSyllabus de Chimie 2LucasPas encore d'évaluation
- td6 Cinetique ChimiqueDocument2 pagestd6 Cinetique ChimiqueAdri LebPas encore d'évaluation
- (C2) TDDocument4 pages(C2) TDMenePas encore d'évaluation
- Glucides SVT - L2Document151 pagesGlucides SVT - L2Yayi KontaoPas encore d'évaluation
- 2017 AmNord Exo3 Sujet BanansChimieVerte 5ptsDocument5 pages2017 AmNord Exo3 Sujet BanansChimieVerte 5ptsAya El kotbiPas encore d'évaluation
- Am 081523Document35 pagesAm 081523hktfsdrdwnPas encore d'évaluation
- TPN-1 Réalisation Dun Pile Éléctrochimie GPDocument3 pagesTPN-1 Réalisation Dun Pile Éléctrochimie GPعبدالسلام ارفيس75% (4)
- Les Cours de Chimie Phusique de Cilicium - 4Document17 pagesLes Cours de Chimie Phusique de Cilicium - 4amina mezouagh100% (1)
- Solution de La Fiche de TD02OPUDocument3 pagesSolution de La Fiche de TD02OPUperfectgiftsstor2023Pas encore d'évaluation
- Fichetechnique TBDocument5 pagesFichetechnique TBdjantoine16Pas encore d'évaluation
- Lecon Chim 5Document5 pagesLecon Chim 5mohamed HAFIDIPas encore d'évaluation
- Devoir ExtractionDocument5 pagesDevoir ExtractionMalika BENHAMADAPas encore d'évaluation
- Polycarbonate - WikipédiaDocument4 pagesPolycarbonate - WikipédiaGuérin ThomasPas encore d'évaluation
- Cours Liaisons Chimiques 20-20Document57 pagesCours Liaisons Chimiques 20-20ussamautshihaPas encore d'évaluation
- Epreuve ENSA 2012Document7 pagesEpreuve ENSA 2012ndiayePas encore d'évaluation
- Serie c1 Generalites Sur La Chimie OrganiqueDocument2 pagesSerie c1 Generalites Sur La Chimie OrganiqueMamadou saliou Ba100% (1)
- Comment Fabriquer Son Savon Solide Naturel Soi-MêmeDocument6 pagesComment Fabriquer Son Savon Solide Naturel Soi-MêmeManuella wattsPas encore d'évaluation
- Habilitation Securite Niveau N1 PDFDocument106 pagesHabilitation Securite Niveau N1 PDFMokhtari Med Ilyas Chikh100% (1)
- No Fri XDocument7 pagesNo Fri XDavid ALVESPas encore d'évaluation
- 2 1 AE BarbecueDocument1 page2 1 AE BarbecuekalibrouillePas encore d'évaluation
- Corrigé TD FCCDocument4 pagesCorrigé TD FCCYasmine HasnaouiPas encore d'évaluation
- 3.alcalinoterreux (Réparé)Document11 pages3.alcalinoterreux (Réparé)rachaghalloussi194Pas encore d'évaluation
- Dev 8Document2 pagesDev 8LahcenEs-samlaliPas encore d'évaluation
- La CorrosionDocument35 pagesLa Corrosionimad haouiPas encore d'évaluation
- Séries ThermochimieDocument7 pagesSéries ThermochimieHiba AmalouPas encore d'évaluation
- PP Aaa PP1 106 FRDocument40 pagesPP Aaa PP1 106 FRRabah AmidiPas encore d'évaluation
- ANTHOTYPE Mémoire PhotographieDocument102 pagesANTHOTYPE Mémoire PhotographieNoam NorkhatPas encore d'évaluation
- Composé AromatiquesDocument6 pagesComposé AromatiquesGANDEMAPas encore d'évaluation
- Correction Controle 1 - 1 S1 3ACDocument1 pageCorrection Controle 1 - 1 S1 3ACAssia AchhabePas encore d'évaluation
- Souley Honnoré 2. Propane, Propylène Et PolypropylèneDocument12 pagesSouley Honnoré 2. Propane, Propylène Et PolypropylèneHonnoré christian souleyPas encore d'évaluation
- Fascicule de TP IACC-2023-24Document41 pagesFascicule de TP IACC-2023-24Koffi thierry KouakouPas encore d'évaluation