Académique Documents
Professionnel Documents
Culture Documents
8 Dosage Directe
8 Dosage Directe
Transféré par
Med Amine HattakiCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
8 Dosage Directe
8 Dosage Directe
Transféré par
Med Amine HattakiDroits d'auteur :
Formats disponibles
Execice 1:
Pour déterminer la concentration 𝐶0 en acide chlorhydrique, 𝐻3𝑂+ + 𝐶𝑙− , d’un détartrant, on
(𝑎𝑞) (𝑎𝑞)
dilue celui-ci 200 fois. On dose un volume 𝑉𝐴 = 100,0 𝑚𝐿 de la solution diluée 𝑆𝐴 obtenue par une
solution 𝑆 d’hydroxyde de sodium, 𝑁𝑎+ (𝑎𝑞) + 𝐻𝑂−(𝑎𝑞), de concentration 𝐶𝐵 = 9,6 × 10−2 𝑚𝑜𝑙. 𝐿−1. On
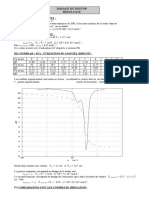
obtient le graphe 𝜎 = (𝑉𝐵), ci contre.
L’équation support de la réaction de titrage est :
𝐻3𝑂+(𝑎𝑞) + 𝐻𝑂−(𝑎𝑞) ⟶ 2𝐻2𝑂(𝑙)
1- Déterminer le volume équivalent 𝑉𝐸.
2- Déterminer l’expression de la concentration 𝐶𝐴 en acide chlorhydrique de la solution 𝑆𝐴.
3- Calculer la concentration 𝐶𝐴. En déduire la valeur de 𝐶0.
Solution
1- Détermination du volume équivalent 𝑉𝐸 :
On linéarise le graphe 𝜎 = (𝑉𝐵) avant et après le changement de pente.
Le point équivalent E est situé à l’intersection des deux segments de droites.
En utilisant le graphe on lit, le volume équivalent : 𝑉𝐸 = 12,2 𝑚𝐿.
2- Détermination de l’expression de la concentration 𝐶𝐴 :
A l’équivalence du titrage, réactif titrant et réactif titré ont été totalement consommés et ont réagi dans
les proportions stœchiométriques de l’équation de la réaction.
𝐻3𝑂+(𝑎𝑞) + 𝐻𝑂−(𝑎𝑞) ⟶ 2𝐻2𝑂(𝑙)
𝑛(𝐻3𝑂+)𝑐𝑜𝑛𝑡𝑒𝑛𝑢 𝑑𝑎𝑛𝑠 𝑙𝑒 𝑏é𝑐ℎ𝑒𝑟 = 𝑛𝐸(𝐻𝑂−)𝑣𝑒𝑟𝑠é𝑒 à 𝑙′é𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑐𝑒
.𝑉
𝐶𝐵 𝐸
Soit : 𝐶𝐴. 𝑉𝐴 = 𝐶𝐵. 𝑉𝐸 d’où : 𝐶=
𝑉𝐴
3- Calculons de concentration 𝐶𝐴
9,6 × 10−2 × 12,2
−2 −1 −2 −1
𝐶𝐴 = = 1,17 × 10 𝑚𝑜𝑙. ≈ 1,2. 10 𝑚𝑜𝑙. 𝐿
100,0 𝐿
La solution de détartrant ayant été 200 fois : 𝐶0 = 200𝐶𝐴.
𝐶0 = 200 × 1,2 × 10−2 = 2,4 𝑚𝑜𝑙. 𝐿−1
Remarque :
La concentration 𝐶0 est exprimée avec deux chiffres significatifs, car la concentration 𝐶𝐵 est exprimée
avec deux chiffres significatifs.
Execice 2 :
Une solution 𝑆𝐴 d’aspirine 𝐶9𝐻8𝑂4(𝑠) est préparée en dissolvant un comprimé dans de l’eau distillée.
Le titrage conductimétrique d’un volume 𝑉𝐴 = 100 𝑚𝐿 de la solution 𝑆𝐴 par une solution 𝑆𝐵
d’hydroxyde de sodium, 𝑁𝑎+ (𝑎𝑞) + 𝐻𝑂 −(𝑎𝑞), de concentration 𝐶𝐵 = 1,0 × 10−1𝑚𝑜𝑙. 𝐿−1 , permet de
tracer la courbe 𝜎 = 𝑓(𝑉𝐵), ci contre.
L’équation support de la réaction de titrage est :
𝐶9𝐻8𝑂4(𝑎𝑞) + 𝐻𝑂−(𝑎𝑞) ⟶ 𝐶9𝐻7𝑂4−(𝑎𝑞) + 𝐻2𝑂(𝑙)
1- Déterminer le volume équivalent 𝑉𝐸.
2- Donner l’expression de la concentration 𝐶𝐴en acide chlorhydrique de la solution 𝑆𝐴 puis la calculer.
3- Déduire la masse 𝑚𝐴 d’aspirine dans le comprimé.
Solution
1- Détermination du volume équivalent 𝑉𝐸 :
Le point équivalent E est situé à l’intersection des deux segments de droites.
Par lecture sur le graphe, le volume équivalent : 𝑉𝐸 = 6,8 𝑚𝐿.
2- l’expression de la concentration 𝐶𝐴 :
A l’équivalence du titrage, réactif titrant et réactif titré ont été totalement consommés et ont réagi
dans les proportions stœchiométriques de l’équation de la réaction.
𝐶9𝐻8𝑂4(𝑎𝑞) + 𝐻𝑂−(𝑎𝑞) ⟶ 𝐶9𝐻7𝑂4−(𝑎𝑞) + 𝐻2𝑂(𝑙)
𝑛(𝐶9𝐻8𝑂4)𝑐𝑜𝑛𝑡𝑒𝑛𝑢 𝑑𝑎𝑛𝑠 𝑙𝑒 𝑏é𝑐ℎ𝑒𝑟 𝑛(𝐻𝑂−)𝑣𝑒𝑟𝑠é𝑒 à 𝑙′é𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑐𝑒 1
1 =
𝑛(𝐶9𝐻8𝑂4) = 𝑛𝐸(𝐻𝑂−)
.𝑉
𝐶𝐵 𝐸
Soit : 𝐶𝐴. 𝑉𝐴 = 𝐶𝐵. 𝑉𝐸 d’où 𝐶=
𝑉𝐴
1,0 × 10−1 × 6,8 −3 −1
3- Masse 𝑚𝐴 d’aspirine dans le comprimé :
= 𝑀(𝐶9𝐻8𝑂4) = 180𝑔. 𝑚𝑜𝑙−1
𝑚𝐴 = 𝑛𝐴. 𝑀
⟹𝑚 =𝐶 .𝑉.𝑀
{
𝑛 𝐴 = 𝐶𝐴 . 𝑉 𝐴 𝐴 𝐴 𝐴
𝑚𝐴 = 6,8 × 10−3 × 0,100 × 180 = 0,12𝑔
Execice 3 :
Pour doser une solution de diiode 𝐼2(𝑎𝑞), on place 20,0 𝑚𝐿 de cette solution dans un bécher avec de
l’empois d’amidon on obtient alors une solution bleu foncé (l’amidon est un indicateur coloré permet
de visualiser le point d’équivalence : après l’équivalence la solution est bleue ; après l’équivalence la
solution est incolore).
Dans une burette graduée, on introduit une solution de thiosulfate de sodium 𝑁𝑎2𝑆2𝑂3 où la
−1
concentration thiosulfate 𝑆2𝑂2−
3 (𝑎𝑞) est 0,20 𝑚𝑜𝑙. 𝐿 .
On fait couler cette solution dans le bécher jusqu’à disparition de la couleur bleu foncé ; on a alors
versé 24,2 𝑚𝐿 de solution titrante. La disparition de la couleur bleue foncée démontre la disparition
totale du diiode 𝐼2 (𝑎𝑞).
1- Ecrire l’équation de la réaction de dosage sachant que les couples d’oxydoréduction mis en œuvre
sont 𝐼2(𝑎𝑞)⁄𝐼− 𝑆4𝑂 62−(𝑎𝑞) ⁄𝑆2𝑂 3(𝑎𝑞)
2−
(𝑎𝑞) et Préciser lors de cette réaction chimique quelle est l’espèce
oxydant et l’espèce réductrice ?
2- Définir l’équivalence d’un dosage.
3- A l’aide d’un tableau d’avancement ou par une autre méthode déterminer la réaction que l’on
peut écrire à l’équivalence.
4- Calculer la concentration de diiode 𝐼2 dans la solution dosée.
En déduire la masse de diiode 𝐼2 dissoute dans un volume 𝑉 = 200 𝑚𝐿 de solution.
Donnée : masse molaire du diiode 𝐼2 : (𝐼2) = 253,8 𝑔. 𝑚𝑜𝑙−1
Solution
1- L’équation de la réaction de dosage :
−
𝐼2(𝑎𝑞) + 2𝑒− ⇄ 2𝐼(𝑎𝑞)
2𝑆2𝑂2− ⇄ 𝑆4𝑂2− + 2𝑒 −
3(𝑎𝑞) 6 (𝑎𝑞)
𝐼2(𝑎𝑞) + 2𝑆2𝑂2− ⇄ 2𝐼 −
+ 𝑆4𝑂2−
3(𝑎𝑞) (𝑎𝑞) 6 (𝑎𝑞)
𝐼2 est l’espèce oxydant.
𝑆2𝑂2−
3 est l’espèce réductrice.
2- L’équivalence est atteinte lorsque les réactifs sont totalement disparus.
3- A l’équivalence du titrage, réactif titrant et réactif titré ont été totalement consommés et ont réagi
dans les proportions stœchiométriques de l’équation de la réaction.
𝑛(𝐼2)𝑐𝑜𝑛𝑡𝑒𝑛𝑢 𝑑𝑎𝑛𝑠 𝑙𝑒 𝑏é𝑐ℎ𝑒𝑟 𝑛 (𝑆2𝑂32−)𝑣𝑒𝑟𝑠é𝑒 à 𝑙′é𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑐𝑒
1 =
2
2−
𝑛(𝑆2𝑂 3 ) = 2𝑛𝑖(𝐼2)
4- Calculons la concentration de diiode 𝐼2 dans la solution dosée :
𝐶𝑟𝑒𝑑.𝑉𝑟𝑒𝑑
𝐶𝑟𝑒𝑑. 𝑉𝑟𝑒𝑑 = 2𝐶𝑜𝑥. 𝑉𝑜𝑥 d’où 𝐶𝑜𝑥 =
2 𝑜𝑥
0,2 × 24,2
𝐶𝐴 = = 0,12 𝑚𝑜𝑙. 𝐿−1
2 × 20
(𝐼2) = 𝐶𝑜𝑥. 𝑉 = 0,12 × 0,2 = 2,4 × 10−2 𝑚𝑜𝑙
(𝐼2) = 𝑚(𝐼2). (𝐼2) = 2,4 × 10−2 × 253,8 = 6,14 𝑔
Vous aimerez peut-être aussi
- Bac 2023 - Corrigé Maths Jour 2Document7 pagesBac 2023 - Corrigé Maths Jour 2LETUDIANT100% (1)
- Acide Et Base - DosageDocument33 pagesAcide Et Base - Dosagemohamed saidi67% (3)
- 9 Exercice Transfert D'énergie Dans Un Circuit Électrique Puissance ÉlectriqueDocument1 page9 Exercice Transfert D'énergie Dans Un Circuit Électrique Puissance Électriquemasasa100% (5)
- Les Reactions D Oxydo Reduction Exercices Corriges 1 3Document8 pagesLes Reactions D Oxydo Reduction Exercices Corriges 1 3chayma rebai100% (1)
- Prép Titanium StruersDocument6 pagesPrép Titanium StruersElly PegPas encore d'évaluation
- Reactions Equilibrees 2022Document33 pagesReactions Equilibrees 2022Mira MslPas encore d'évaluation
- Allyl Chloride ProductionDocument102 pagesAllyl Chloride ProductionTcg FxgPas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Corriges 1 3Document6 pagesLes Dosages Ou Titrages Directs Exercices Corriges 1 3rihabPas encore d'évaluation
- Documento Senza Titolo-1Document8 pagesDocumento Senza Titolo-1sfvsfvPas encore d'évaluation
- Dosage DirectDocument7 pagesDosage DirectNouhad KaisPas encore d'évaluation
- Spe Physique Chimie 2022 Metropole 1 Corrige PDFDocument10 pagesSpe Physique Chimie 2022 Metropole 1 Corrige PDFRim MawadiaPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2018 Normale CorrigeDocument9 pagesExamen National Physique Chimie 2 Bac SVT 2018 Normale CorrigeMohamed SaidiPas encore d'évaluation
- Examen National Physique Chimie SPC 2019 Rattrapage CorrigeDocument7 pagesExamen National Physique Chimie SPC 2019 Rattrapage Corrigehicham lahdissouPas encore d'évaluation
- Série 7 (Le Dosage Direct 1)Document1 pageSérie 7 (Le Dosage Direct 1)Ahmed BennaghmouchPas encore d'évaluation
- ECE 23 PC 30 2812cf4993Document8 pagesECE 23 PC 30 2812cf4993Isma IsmaPas encore d'évaluation
- Série DosageDocument2 pagesSérie DosageNouhad KaisPas encore d'évaluation
- 2022 Examen 1 Chimie Solutions Corrigé LDDocument10 pages2022 Examen 1 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- Série 2 - ConcentrationDocument12 pagesSérie 2 - ConcentrationHamza Faraji100% (1)
- Exercice DiiodeDocument2 pagesExercice Diioderodrigue n'gazaPas encore d'évaluation
- 2023 Examen 2 Chimie Solutions Corrigé LDDocument11 pages2023 Examen 2 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- Devoir 2024Document3 pagesDevoir 2024أمين حسونيPas encore d'évaluation
- 2022 Examen 2 Chimie Solutions Corrigé LDDocument7 pages2022 Examen 2 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- AE2 Titragep Hmétrique Vinaigre Correction EleveDocument6 pagesAE2 Titragep Hmétrique Vinaigre Correction ElevekandedianissyPas encore d'évaluation
- 02 Cours Solution DilutionDocument11 pages02 Cours Solution Dilutionbirav81881Pas encore d'évaluation
- NarutoDocument10 pagesNarutosmkskyrozPas encore d'évaluation
- 2 Bac SM Correction Contrôle de Chimie N02 2023Document2 pages2 Bac SM Correction Contrôle de Chimie N02 2023sabrinePas encore d'évaluation
- CP TP1 ChimieDocument6 pagesCP TP1 ChimieBossalhPas encore d'évaluation
- CONTROLE Geotechnique 2012-2013 (Corrigé)Document3 pagesCONTROLE Geotechnique 2012-2013 (Corrigé)Brahim ElouahidiPas encore d'évaluation
- Série 01Document3 pagesSérie 01Nouhad KaisPas encore d'évaluation
- cc2 Cor 2020Document4 pagescc2 Cor 2020Houssein EL GHARSPas encore d'évaluation
- 04 Titrage Colorimetrique ExosDocument3 pages04 Titrage Colorimetrique Exosamehri.linaPas encore d'évaluation
- Métrologie - Correction ExosDocument6 pagesMétrologie - Correction ExosHichem HouidechePas encore d'évaluation
- TP1 ChimieDocument8 pagesTP1 ChimieHalima ZighPas encore d'évaluation
- Exercice Courrigé CH - SOLDocument53 pagesExercice Courrigé CH - SOLossamaelallouli213Pas encore d'évaluation
- Dénombrement: 1. Principe AdditifDocument18 pagesDénombrement: 1. Principe Additifthe ninjaPas encore d'évaluation
- Cours DosageDocument5 pagesCours DosageTEST - TESTPas encore d'évaluation
- TD N°4 CorrigéDocument4 pagesTD N°4 Corrigéعبدالغني السوسيPas encore d'évaluation
- Cedyna CHM 3Document17 pagesCedyna CHM 3Jonah LJDPas encore d'évaluation
- 9 - État D'équilibre D'un Système 2Document8 pages9 - État D'équilibre D'un Système 2pro alixPas encore d'évaluation
- Introduction A La Methode Des Elements FinisDocument71 pagesIntroduction A La Methode Des Elements FinisWilfried FaboPas encore d'évaluation
- La Concentration Molaire Cours 1Document4 pagesLa Concentration Molaire Cours 1abdelouahab fartalPas encore d'évaluation
- Les Solutions: Concentration D'une Solution-SolubilitéDocument2 pagesLes Solutions: Concentration D'une Solution-SolubilitéaliPas encore d'évaluation
- Chime Solution Chapitre 1 2Document4 pagesChime Solution Chapitre 1 2Alexandre NT0% (1)
- Extraction Ionique Exposé Final BonDocument26 pagesExtraction Ionique Exposé Final BonSurbroPas encore d'évaluation
- Potentiel - PHDocument3 pagesPotentiel - PHKahil LaibPas encore d'évaluation
- Dosages Directs: Exercice 1Document2 pagesDosages Directs: Exercice 1HasnaPas encore d'évaluation
- Anneau Des PolynômesDocument8 pagesAnneau Des Polynômessarah tifouPas encore d'évaluation
- 51 EX DONT 26 CORR CONCENTRATION MOLAIRE MR R JALLOULI 34 PAGESDocument34 pages51 EX DONT 26 CORR CONCENTRATION MOLAIRE MR R JALLOULI 34 PAGESmechergui mariemPas encore d'évaluation
- Dosage 2024Document2 pagesDosage 2024funwolf2020Pas encore d'évaluation
- Projet 1Document8 pagesProjet 1Mario StiflerPas encore d'évaluation
- Série Des Couples 03 CorrectionDocument23 pagesSérie Des Couples 03 CorrectionmiracletoangelPas encore d'évaluation
- Mathématiques - Lycée Classique D'edéa - Classe 1ère C - 2020 CamerounDocument5 pagesMathématiques - Lycée Classique D'edéa - Classe 1ère C - 2020 CamerounChantal MariamaPas encore d'évaluation
- Poly TD Ci450 AqDocument19 pagesPoly TD Ci450 Aqcyriejhhvhjvlle19Pas encore d'évaluation
- Correction Examen 2016-2020Document68 pagesCorrection Examen 2016-2020Mohamed SaidiPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeDocument10 pagesExamen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeMohamed Saidi100% (1)
- Loi Student Et FisherDocument5 pagesLoi Student Et FisherRayhane OUANANI100% (1)
- Problemes ClassiquesDocument13 pagesProblemes Classiquesbarryhamadounallaye1Pas encore d'évaluation
- 7 Réactions Acido-BasiquesDocument8 pages7 Réactions Acido-BasiquesMed yahyaPas encore d'évaluation
- Equilibre D'un Système ChimiqueDocument8 pagesEquilibre D'un Système ChimiqueNouhad KaisPas encore d'évaluation
- Pompe 2STEDocument10 pagesPompe 2STEmasasaPas encore d'évaluation
- PlanDocument2 pagesPlanmasasaPas encore d'évaluation
- Lexi Que Du ThéâtreDocument1 pageLexi Que Du ThéâtremasasaPas encore d'évaluation
- تصحيح الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية الدورة العادية 2012 جهة مكناس تافيلالتDocument1 pageتصحيح الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية الدورة العادية 2012 جهة مكناس تافيلالتmasasa100% (1)
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2009 جهة الدار البيضاء الكبرىDocument4 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2009 جهة الدار البيضاء الكبرىmasasaPas encore d'évaluation
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2011 جهة الشاوية ورديغةDocument4 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2011 جهة الشاوية ورديغةmasasa100% (1)
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية الدورة العادية 2012 جهة سوس ماسة درعةDocument2 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية الدورة العادية 2012 جهة سوس ماسة درعةmasasaPas encore d'évaluation
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2009 جهة الدار البيضاء الكبرىDocument4 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2009 جهة الدار البيضاء الكبرىmasasaPas encore d'évaluation
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2011 جهة مكناس تافيلالتDocument3 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2011 جهة مكناس تافيلالتmasasaPas encore d'évaluation
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2008 جهة مراكش تانسيفت الحوزDocument2 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2008 جهة مراكش تانسيفت الحوزmasasaPas encore d'évaluation
- الامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2009 جهة الرباط سلا زمور زعيرDocument4 pagesالامتحان الجهوي السنة الأولى باكالوريا جميع الشعب مادة اللغة الفرنسية 2009 جهة الرباط سلا زمور زعيرmasasaPas encore d'évaluation
- Dossier 712413013Document16 pagesDossier 712413013masasaPas encore d'évaluation
- 1bex 09 Dérivabilité Sr2Fr AmmariDocument2 pages1bex 09 Dérivabilité Sr2Fr AmmarimasasaPas encore d'évaluation
- Essais de Mises Au Point de Formulation de Cremes Et Laits Corporels A Base Du Beurre de Karite Du Burkina FasoDocument109 pagesEssais de Mises Au Point de Formulation de Cremes Et Laits Corporels A Base Du Beurre de Karite Du Burkina FasoSurbroPas encore d'évaluation
- Corection 3 Partie ADocument4 pagesCorection 3 Partie Ahassan.antar2023Pas encore d'évaluation
- Les Liants2Document7 pagesLes Liants2Franck BitaPas encore d'évaluation
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- Série 2 Chimie Solutions 2022-2023Document2 pagesSérie 2 Chimie Solutions 2022-2023hamzaelm802Pas encore d'évaluation
- SAJIB5 - 1703373836101 - Série D'exercices 5 Test D'identificationDocument4 pagesSAJIB5 - 1703373836101 - Série D'exercices 5 Test D'identificationwijdanellyryyPas encore d'évaluation
- VitaminesDocument1 pageVitaminesJamal WacPas encore d'évaluation
- Solution 1Document24 pagesSolution 1Mohammed Mammar KouadriPas encore d'évaluation
- Il Était Une Fois Le Sel Et Les Roches SalinesDocument21 pagesIl Était Une Fois Le Sel Et Les Roches SalinesJeremia MotsePas encore d'évaluation
- tp1 PhotoDocument6 pagestp1 Photoemanhdf904Pas encore d'évaluation
- AlcènesDocument1 pageAlcènesOusmane KonePas encore d'évaluation
- LES LIPIDES Sructure Et Métabolque 2010Document162 pagesLES LIPIDES Sructure Et Métabolque 2010Lyes DahmaniPas encore d'évaluation
- Destop ResultatsDocument2 pagesDestop ResultatspiminkPas encore d'évaluation
- Chimie Minéral Cours PDFDocument67 pagesChimie Minéral Cours PDFMerveille NsumbuPas encore d'évaluation
- UntitledDocument6 pagesUntitledTristan RollandPas encore d'évaluation
- Le Plâtre PDFDocument4 pagesLe Plâtre PDFFeriel Kh100% (1)
- I. PH D Une Solution AqueuseDocument5 pagesI. PH D Une Solution AqueuseJean-Loïc BauchetPas encore d'évaluation
- 2009 Pondichery Exo1 Sujet Ester Pheromone 6 5ptsDocument3 pages2009 Pondichery Exo1 Sujet Ester Pheromone 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- Exercices C9: Les Complexes: + 4 NH ZN (NH)Document4 pagesExercices C9: Les Complexes: + 4 NH ZN (NH)Silento SwordPas encore d'évaluation
- Cours Chimie 1BAC-BIOF BouchraDocument9 pagesCours Chimie 1BAC-BIOF BouchraMarwa NajiPas encore d'évaluation
- TP Synthèse de L'indigotine-2Document7 pagesTP Synthèse de L'indigotine-2dimpondyPas encore d'évaluation
- Classification Des Acides Et Des BasesDocument3 pagesClassification Des Acides Et Des BasesMohamed A S Doumbia100% (1)
- Chromatographie Sur Colonne Echangeuse D PDFDocument5 pagesChromatographie Sur Colonne Echangeuse D PDFمحمد دودو100% (4)
- Le Zinc ChimiqueDocument2 pagesLe Zinc ChimiqueKeniel EldorPas encore d'évaluation
- كتاب السنة أولى هندسة الطرائقDocument31 pagesكتاب السنة أولى هندسة الطرائقعبد الكريم ملوحPas encore d'évaluation
- Chapitre 5 Les Alcools Aliphatiques SaturésDocument18 pagesChapitre 5 Les Alcools Aliphatiques SaturésZAHONNON DAOPas encore d'évaluation
- Chimie OrganiqueDocument25 pagesChimie OrganiqueHeeb APas encore d'évaluation
- Echange D IonsDocument19 pagesEchange D IonsJhdiod JhdhvrbdPas encore d'évaluation