Académique Documents
Professionnel Documents
Culture Documents
Physiologie Des Membranes - Étudiants-2013
Transféré par
asma2490Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Physiologie Des Membranes - Étudiants-2013
Transféré par
asma2490Droits d'auteur :
Formats disponibles
06/02/2013
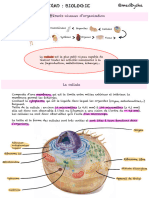
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion de l’eau: osmose
– Diffusion ionique (plus détaillé dans prochain cours)
3. Les
3 L trois
t i types
t de
d transport
t t
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6. Transports secondairements actifs
7 Autres
7. A t t
types de
d transport
t t : Endocytose
E d t ett exocytose
t
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial
9. Approches expérimentales pour l’étude des transports ioniques
LA STRUCTURE DES MEMBRANES BIOLOGIQUES
J. Teulon, transport LV207 AHA, 2013 1
06/02/2013
Ethanolamine
Inositol
Sérine
choline
Figure 2-
2-1 Phospholipids.
Groupement phosphatidyl
Downloaded from: StudentConsult (on 4 August 2006 12:53 PM)
© 2005 Elsevier
Figure 2-
2-2 Structures of some common membrane lipids.
Downloaded from: StudentConsult (on 4 August 2006 12:53 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 2
06/02/2013
Résumé de propriétés de la membrane cellulaire
• Les membranes biologiques sont composées d’une
bicouche lipidique de composition variée.
• Les phospholipides peuvent se déplacer latéralement.
• Le cholestérol rigidifie la membrane et peut se déplacer
d’une couche à l’autre (flip-flop).
• Elle comporte de nombreuses protéines ayant des
fonctions de transport, de signalisation, d’ancrage ou de
catalyse.
• Modèle mosaïque fluide (Singer & Nicolson, Science.
1972,175:720–731).
• Elle sépare deux milieux de compositions très différentes.
• Un grand nombre de protéines de transport permettent le
flux de substances variées à travers la membrane.
Milieu extracellulaire Milieu intracellulaire
mM mM
Na+ 140 Na+ 10
K+ 5 K+ 135
Cl- 11
Cl- 110 HCO3- 15
HCO3- 24 Charges négatives
fixes (protéines)
protéines
• Iso
Iso-osmolarité
osmolarité
• Électroneutralité
• Les charges négatives des protéines intracellulaires équilibrent les charges
positives.
• grosses différences de répartition des ions dans la cellule et à l’extérieur de la
cellule.
J. Teulon, transport LV207 AHA, 2013 3
06/02/2013
Transport de substances
• La membrane est imperméable aux
particules chargées
chargées, aux grosses
molécules non chargées solubles dans
l’eau (protéines, glucose, etc..).
• Des protéines spécialisées sont donc
responsables du transport de substances
à travers les membranes cellulaires
cellulaires.
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion ionique (plus détaillé dans prochain cours)
– Diffusion de l’eau: osmose
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
J. Teulon, transport LV207 AHA, 2013 4
06/02/2013
Diffusion simple
• La diffusion simple est un transport
passif s’effectuant à travers la membrane
plasmique sans la participation de
transporteurs protéiques.
• Les molécules perméables diffusent en
suivant le gradient électrochimique.
• La membrane plasmique est perméable
aux molécules hydrophobes (les gaz en
particulier : O2, CO2) et aux petites
molécules
lé l non chargées
h é ttelles
ll que l’l’eau,
l’urée et le glycérol.
Démarqué de FK Winkler
Winkler,, Zurich
Diffusion simple : loi de Fick
Coefficient de diffusion
Surface d’échange
d échange
Flux net
dC
(Nbre particules / s)
J = -D*S
dx
Gradient de concentration selon l’axe x
Le signe – est là pour rappeler que le flux est en sens contraire de la variation de la
concentration
J. Teulon, transport LV207 AHA, 2013 5
06/02/2013
Diffusion passive d’une particule non chargée à travers une membrane
On considère une membrane homogène (bicouche lipidique)
L On prend A = 1
C2 – C1 J = P*ΔC Avec P = D /L
j = - D*
L
J (moles ss--1 cm-
cm-2) ; P (cm ss--1) ; C (moles cm
cm--3)
Flux par unité de surface
Un cas particulier de la diffusion simple :
• La diffusion de l’eau ou osmose
Pression osmotique :
ΔΠ = RT
RT*ΔCosm
RT*Δ
ΔΠ = ρgh
Flux osmotique :
Jv= Lp
Lp**ΔΠ
Solutés plus concentrés
La membrane est perméable à l’eau mais imperméable aux solutés.
Le déplacement d’eau se fait du compartiment le moins concentré en solutés
vers le compartiment le plus concentré.
J. Teulon, transport LV207 AHA, 2013 6
06/02/2013
Æ Concept de tonicité : les molécules ayant un pouvoir osmotique
sont celles qui ne sont pas perméables.
Le déplacement d’eau n’aurait pas lieu si la membrane était perméable aux solutés
Quels sont les composés osmotiquement
actifs ?
– Les ions sodium et potassium sont
Solutés plus des particules osmotiquement actives
à travers la membrane plasmique.
concentrés
– Le glucose également
– Et bien sûr les protéines
– Mais pas l’urée.
Lorsqu’on compare deux solutions :
• La plus concentrée en solutés non
perméables est hypertonique.
• La moins concentrée en solutés
solutés non perméables est hypotonique.
• Deux solutions avec la même
concentration sont isotoniques.
L’osmose est une diffusion :
Les molécules d’eau suivent leur gradient de concentration.
J. Teulon, transport LV207 AHA, 2013 7
06/02/2013
Cours de vigny
Diffusion ionique
Les particules chargées se déplacent sous l’effet d’une
différence de concentration et d’une différence de
potentiel
dC dV
J = -D* + uzFC*
dx dx
Fick Composante électrique
C’est le point de départ pour la détermination des
courants trans membranaires dans la théorie de
Goldman-Hodgkin-Katz.
J. Teulon, transport LV207 AHA, 2013 8
06/02/2013
Plutôt que les équations de Goldman-
Goldman-Hodgkin
Hodgkin--
Katz, on utilise souvent une analogie avec les
circuits électriques qui est plus facile.
• Paramètres : conductance et gradient
électrochimique.
• Le circuit est soumis à une différence de potentiel
et comprend une « batterie » pour chaque ion
(potentiel de Nernst) qui représente l’effet de la
différence de concentration.
[Xe]
Ex = (58/Z) Log
[Xi]
Analogie avec les circuits électriques
i
rx Ex
i e
V = Vi - Ve
V
V = Ex +ri soit : i = (V-Ex)/r
ou encore : i = g*(V
g*(V-E
Ex)
ddp Pot de Nernst
Gradient électrochimique
J. Teulon, transport LV207 AHA, 2013 9
06/02/2013
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion de l’eau: osmose
– Diffusion ionique (plus détaillé dans prochain cours)
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
Transport passif / transport actif
• Transport passif : un transport de substance qui
s’effectue selon le g
gradient électrochimique.
q
• Transport actif : un transport qui s’effectue contre le
gradient électrochimique.
– Il est primairement actif s’il y a consommation d’énergie sous
forme d’ATP.
– Il est secondairement actif si l’ion transporté utilise l’énergie
libérée par un autre ion pendant son transfert
transfert.
J. Teulon, transport LV207 AHA, 2013 10
06/02/2013
Types de transport
ATP
Sodium, potassium ATPase, calcium
2 K+ ATPase, etc…
3 Na+
P
Pompe
Na+
Échangeur sodium / proton
H+
Cotransporteur sodium
sodium--glucose, etc…
Transport
secondairement
actif
K+ Transport Canaux ioniques
facilité Transporteur de glucose,
Claudines de la jonction serrée, etc…
Diffusion Transport à travers les phospholipides de la
simple membrane
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion ionique (plus détaillé dans prochain cours)
– Diffusion de l’eau: osmose
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
J. Teulon, transport LV207 AHA, 2013 11
06/02/2013
Diffusion facilitée
• La diffusion facilitée est également un transport
passif.
• Elle
Ell estt la
l seule
l significative
i ifi ti mêmeê pour
certaines molécules capables de franchir les
bicouches lipidiques (eau, urée…)
• Elle est médiée par des protéines de transport
appelées uniports, porines ou canaux.
• On
O peut, t sous certaines
t i conditions,
diti appliquer
li lles
équations précédentes (loi de Fick, Goldman-
Hodgkin-Katz).
A suivre, quelques exemples disparates puis on insistera sur les
canaux ioniques
Cours de vigny
J. Teulon, transport LV207 AHA, 2013 12
06/02/2013
Un exemple « exotique »
Porine
Figure 3-4 Structure of the PhoE porin of Escherichia coli. A, Top view of a porin trimer that shows
the backbones of the polypeptide chains. Each of the three identical monomers, which are shown
in different colors, contains 330 amino acids. cross sectin (internal diameter, 0.7 nm).
(Reproduced from Jap BK, Walian PJ: Structure and functional mechanisms of porins. Physiol
Rev 76:1073-1088, 1996.)
© 2005 Elsevier
Aquaporines
Asparagine (N), proline (P), alanine (A)
Nielsen et al, Physiol Rev, Jan 2002; 82: 205 - 244.
J. Teulon, transport LV207 AHA, 2013 13
06/02/2013
Aquaporines
Pores pour l’eau
La perméabilité de l’eau à travers une bicouche lipidique est de l’ordre de 5 10-3 cm/s.
Dans le tube proximal du rein de mammifère, elle est de l’ordre de 0,15 cm/s ; Débit = 3
109 molécules /seconde. Downloaded from: StudentConsult (on 2 August 2006 09:28 AM)
© 2005 Elsevier
Uniports
• Transporteurs du glucose (glut1, etc…)
• Transporteurs de l’urée (UT, etc…)
• Transporteurs du phosphate
J. Teulon, transport LV207 AHA, 2013 14
06/02/2013
Canaux ioniques
Support d’un transport ionique passif
• A structure de pore
Protéines membranaires: • A sélectivité ionique
• Régulables
Pore (conductance)
Filtre de sélectivité
Contrôle / Modulation Porte (« gate »)
de l ’activité
Courant porté par un canal ionique
ouvert
i
fermé
t1 t2 t3 t4 t5 t6
Σ ti
Probabilité d’ouverture : Po =
T
Courant moyen :
N = nombre de canaux
< I >temps = courant
macroscopique
< I >temps = NPo. i
moyen dû à ce type
de canal
J. Teulon, transport LV207 AHA, 2013 15
06/02/2013
Diversité des canaux ioniques :
Exemple des canaux K+
¾ Trois familles
Capteur
de voltage P P P1 P2
NH3+ NH3+
NH3+ CO2- CO2 - CO2-
6 segments transmembranaires 2 segments transmembranaires 2 domaines P
(à rectification entrante)
¾ Quatre (familles 1 et 2) ou deux (famille 3) sous-unités conductrices
s’assemblent pour former un canal K+ : elles peuvent être identiques ou différentes
¾ Il y peut y avoir également des sous-unités de régulation (qui ne participent
pas à la formation du pore mais sont impliqués soit dans l’adressage à la
membrane soit dans la régulation de l’activité).
Canal maxi K+ (slo 1)
Salkoff et al, Nat Rev Neurosci,
Neurosci, 2006, 7:921-
7:921-931
J. Teulon, transport LV207 AHA, 2013 16
06/02/2013
Figure 7-11 Structure of the Streptomyces K+ channel (KcsA). A, KcsA is a homotetramer. Each monomer is
represented in a different color and contains only two membrane-spanning elements, which is analogous to the
S5-P-S6 portion of Shaker-type K+ channels. B, This view more clearly shows the P region, which is very similar
to the P region of the Shaker K+ channel. The P region appears to form the selectivity filter of the channel. C, This
is a cut-away view of the pore that shows three K+ ions. The top two K+ ions are bound in a tight cage that is
formed by the peptide backbones of the P regions of each of the four channel subunits. (Data from Doyle DA,
Morais Cabral J, Pfuetzner RA, et al: The structure of the potassium channel: Molecular basis of K+ conduction
and selectivity. Science 280:69-77, 1998.)
Downloaded from: StudentConsult (on 3 August 2006 03:31 PM)
© 2005 Elsevier
Figure 7-11 Structure of the Streptomyces K+ channel (KcsA). A, KcsA is a homotetramer. Each monomer is represented in a different color and contains only two
membrane-spanning elements, which is analogous to the S5-P-S6 portion of Shaker-type K+ channels. B, This view more clearly shows the P region, which is very
similar to the P region of the Shaker K+ channel. The P region appears to form the selectivity filter of the channel. C, This is a cut-away view of the pore that shows three
K+ ions. The top two K+ ions are bound in a tight cage that is formed by the peptide backbones of the P regions of each of the four channel subunits. (Data from Doyle
DA, Morais Cabral J, Pfuetzner RA, et al: The structure of the potassium channel: Molecular basis of K+ conduction and selectivity. Science 280:69-77, 1998.)
Downloaded from: StudentConsult (on 3 August 2006 03:31 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 17
06/02/2013
Canal jonctionnel (connexines
connexines))
Figure 6-18 Gap-junction channels. In C, left panel shows the preparation of the two cells, each of which is voltage clamped
by means of a patch pipette in the whole-cell configuration (see Fig. 6-14). Because Cell 1 is clamped to -40 mV and Cell 2 is
clamped to -80 mV, current flows through the gap junctions from Cell 1 to Cell 2. The right panel shows that the current
recorded by the electrode in Cell 1 is the mirror image of the current recorded in Cell 2. The fluctuating current transitions
represent the openings and closings of individual gap-junction channels. (Data from Veenstra RD, DeHaan RL: Measurement
of single channel currents from cardiac gap junctions. Science 233:972-974, 1986.)
Downloaded from: StudentConsult (on 3 August 2006 03:31 PM)
© 2005 Elsevier
Régulation des canaux ioniques
• Par synthèse de nouvelles protéines (N)
• Par recrutement à la membrane d’unités
de transport pré-existantes (N)
• Par contrôle (gating) ou modulation de
l’activité du canal (Po)
J. Teulon, transport LV207 AHA, 2013 18
06/02/2013
Diversité de régulation des canaux ioniques
A- Facteur physique
B- Facteurs intracellulaires
H+
Potentiel électrique
ou Ca2+
Tension membranaire
C- Phosphorylation/ déphosphorylation D- Protéine G
PKA E- Canal
Canal--récepteur
phosphatase
P P
Canal voltage-dépendant
Capteur de voltage
+
+
Illustrations de Rettig ett coll., EMBO J. 1992, 11:2473-22486
+
+
+
Sans inactivation
Capteur de voltage
+
+ vec inactivation
Avec c v o
+
+
+
Boule et chaîne
Réponses à des sauts de potentiels d ’environ
-60 mV à 80 mV ;
les séries de stimulations sont superposées
J. Teulon, transport LV207 AHA, 2013 19
06/02/2013
Canal à ligand : récepteur nicotinique
Figure 8-7 Structure of the nicotinic acetylcholine (ACh) receptor. The nicotinic ACh receptor is a heteropentamer with the subunit composition of
α2βγδ. These subunits are homologous to one another, and each has four membrane-spanning segments (M1-M4).
Downloaded from: StudentConsult (on 3 August 2006 03:31 PM)
© 2005 Elsevier
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion ionique (plus détaillé dans prochain cours)
– Diffusion de l’eau: osmose
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
J. Teulon, transport LV207 AHA, 2013 20
06/02/2013
Na,K-ATPase
Exérieur
α : activité catalytique
transport
~ 42 kDa pharmacologie
β
~ 110 kDa
γ β : adressage
stabilisation
~ 6,5 kDa
α modulation affinité
γ : modulation affinité
Intérieur
K+
E1 Ouabaïne Na +
Forte affinité pour Na et ATP
Faible affinité pour K
E2
Sites cationiques intracellulaires
E2
P
Faible affinité pour Na
Forte affinité pour K P
P
Sites cationiques extracellulaire ADP
Na+
E1 → E2
ATP
Phosphorylation P
(induite par fixation du Na) K+
E2 → E1
Déphosphorylation E1
(induite par fixation du K)
Diapo d’Alain Doucet
J. Teulon, transport LV207 AHA, 2013 21
06/02/2013
Autres exemples de pompes
• Pompes Ca2+
• Pompes H+
• Pompes H+ / K+
• Certains types de pompes Ca2+ et H+ sont
situées sur les membranes des organites
intracellulaires.
Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 22
06/02/2013
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion ionique (plus détaillé dans prochain cours)
– Diffusion de l’eau: osmose
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
Accès alternatif (modèle flip
flip--flop) pour un co-
co-transporteur
1. Accès sur un seul
côté de la
membrane à la fois 2. occlusion
3. Libération
3. Retour à des ions
l’état de départ
Weyand S., Science, 2008; Synchrotron Radiat. 2011; Boudker O., Trends Pharmacol Sci., 2010
J. Teulon, transport LV207 AHA, 2013 23
06/02/2013
Une infinité de transports couplés
Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion ionique (plus détaillé dans prochain cours)
– Diffusion de l’eau: osmose
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
J. Teulon, transport LV207 AHA, 2013 24
06/02/2013
Exocytose
Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
endocytose
Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 25
06/02/2013
Physiologie des membranes
1. Membranes cellulaires
2. Principe de la diffusion simple (à travers une membrane homogène)
– Diffusion simple d’une substance non chargée
– Diffusion ionique (plus détaillé dans prochain cours)
– Diffusion de l’eau: osmose
3. Les trois types de transport
4. Transports passifs
– Diffusion facilitée (par l’intermédiaire de protéines de transport)
– Cas de l’eau : aquaporines
– Canaux ioniques
5. Transports actifs
– Exemple de la Na+ K+ ATPase.
6 Transports secondairements actifs
6.
7. Autres types de transport : Endocytose et exocytose
8. Epithéliums
– Propriétés
– Modèles classiques de transport transépithélial :
9. Approches expérimentales pour l’étude des transports
ioniques
Jonction serrée
Jonction adhérente complexe jonctionnel
desmosome
J. Teulon, transport LV207 AHA, 2013 26
06/02/2013
Voies de passage à travers l’épithélium
Voie transcellulaire
1 2
Voie paracellulaire
lumière
interstitium
Système ouvert : Transport net de solutés chargés d’un côté
à l’autre de l’épithélium (état stationnaire mais pas
équilibre).
La Na+, K+ ATPase est le moteur de l’absorption
ionique dans la plupart des épithéliums
Na+
K+
Na+
K+
lumière interstitium
Il y a 500 à 1000 fois plus de pompe sodium dans les
épithéliums par rapport aux autres cellules
J. Teulon, transport LV207 AHA, 2013 27
06/02/2013
voie paracellulaire
• On distingue épithéliums lâches (vésicule
biliaire)) ou serrés (vessie).
( )
• La sélectivité ionique des voies
paracellulaires est variable
• Les épithéliums serrés ont un transport
paracellulaire faible.
• Le transport à travers la voie paracellulaire
est passif (selon le gradient
électrochimique)
Les claudines forment la voie de
passage paracellulaire des ions
J. Teulon, transport LV207 AHA, 2013 28
06/02/2013
Transport à travers les épithéliums
Les épithéliums effectuent un transport net de solutés
Propriétés notables :
• Deux voies de transport transépithéliales sont possibles
• La voie transcellulaire comporte deux étapes
• C’est la répartition asymétrique des transporteurs sur les deux
membranes qui est à l’origine d’un transport net orienté vers la
sécrétion ou vers l’absorption.
• On distingue épithéliums serrés et lâches en fonction de la
perméabilité des jonctions serrées
• L’
L’eau suitit passivement
i t lle ttransportt d
des solutés
l té (à
condition qu’une perméabilité à l’eau soit présente et sauf cas
particuliers).
Premier exemple : absorption de glucose
Intestin
Tube proximal du rein Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 29
06/02/2013
second exemple : absorption de NaCl
Peau de grenouille
Vessie de crapaud
Canal collecteur dans le rein
Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
3ième exemple : sécrétion de NaCl
Acinus des glandes salivaires
Acinus pancréatique
Glande à sel
Downloaded from: StudentConsult (on 27 March 2008 02:03 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 30
06/02/2013
Dernier exemple : sécrétion d’acide chlorhydrique dans l’estomac
Cellule pariétale
Downloaded from: StudentConsult (on 17 December 2008 12:53 PM)
© 2005 Elsevier
J. Teulon, transport LV207 AHA, 2013 31
Vous aimerez peut-être aussi
- Membranes cellulaires: Les Grands Articles d'UniversalisD'EverandMembranes cellulaires: Les Grands Articles d'UniversalisPas encore d'évaluation
- Echanges Et Fonctions Mbs - MSE-SVT-S1 - 21-22 PDFDocument11 pagesEchanges Et Fonctions Mbs - MSE-SVT-S1 - 21-22 PDFSana ElPas encore d'évaluation
- Photosynthèse: Les Grands Articles d'UniversalisD'EverandPhotosynthèse: Les Grands Articles d'UniversalisPas encore d'évaluation
- 03-Transport MembranaireDocument30 pages03-Transport Membranairehafsagundouz682Pas encore d'évaluation
- Exposé 55Document14 pagesExposé 55clevickossoko28Pas encore d'évaluation
- BIO 111 - CHAP - II - Suite - 003Document7 pagesBIO 111 - CHAP - II - Suite - 003Berthe Aristide Ngue NkongoPas encore d'évaluation
- Chapitre III Membrane Plasmique - Copie (2) NE-1Document34 pagesChapitre III Membrane Plasmique - Copie (2) NE-1khalid BOUBKRIPas encore d'évaluation
- Le Transport MembranaireDocument17 pagesLe Transport MembranaireKoukiza TalebPas encore d'évaluation
- 1111cours Biologie Cellulaire CompletDocument117 pages1111cours Biologie Cellulaire Completrabab ouerdighiPas encore d'évaluation
- Biologie Cellulaire Généralités: Membrane - PlasmiqueDocument29 pagesBiologie Cellulaire Généralités: Membrane - Plasmiquetinameriem9Pas encore d'évaluation
- Problèmes-Liés-À-La-Compartimentation (+ACC) + EncadréDocument24 pagesProblèmes-Liés-À-La-Compartimentation (+ACC) + Encadrésun-nee-chan9Pas encore d'évaluation
- Transport MembranaireDocument10 pagesTransport MembranaireHaitam El OuahabiPas encore d'évaluation
- Membrane Feuilles Etudiants 2Document8 pagesMembrane Feuilles Etudiants 2Idrissou FmsbPas encore d'évaluation
- BIO 304 - ELECTROPHORESE - Cours 2022Document30 pagesBIO 304 - ELECTROPHORESE - Cours 2022mistic JayPas encore d'évaluation
- Permeabilite de La Membrane Cellulaire: ObjectifsDocument8 pagesPermeabilite de La Membrane Cellulaire: ObjectifsSylvain SalifouPas encore d'évaluation
- 3-Membrane PlasmiqueDocument11 pages3-Membrane Plasmiquekhoualdia marwaPas encore d'évaluation
- CHAPITRE 2 Cour2Document8 pagesCHAPITRE 2 Cour2Joie De VivrePas encore d'évaluation
- Bio Cel 5Document10 pagesBio Cel 5Malake KhouribachePas encore d'évaluation
- CH2 - Membrane Plasmique - B.BDocument40 pagesCH2 - Membrane Plasmique - B.Bone asslanPas encore d'évaluation
- Introduction Biomemm 2021Document37 pagesIntroduction Biomemm 2021chaimaa baghdadPas encore d'évaluation
- Membrane-Plasmique CompressedDocument23 pagesMembrane-Plasmique Compressedmarie dominique patricia kouassiPas encore d'évaluation
- Bio Cell 1Document20 pagesBio Cell 1zynewsPas encore d'évaluation
- Biologie FondamentaleDocument18 pagesBiologie Fondamentaleقادة قنايةPas encore d'évaluation
- 3eme Cour PhysiologieDocument10 pages3eme Cour Physiologiederdiri imènePas encore d'évaluation
- 1-Structure Et Archirecture de La Membrane Plasmique NeuronaleDocument8 pages1-Structure Et Archirecture de La Membrane Plasmique NeuronalebayaPas encore d'évaluation
- Cours CelluleDocument13 pagesCours CellulesonyPas encore d'évaluation
- Chapitre II Membrane Plasmique 1Document7 pagesChapitre II Membrane Plasmique 1faresgettasPas encore d'évaluation
- La Membrane PlasmiqueDocument51 pagesLa Membrane PlasmiquembenguemalayePas encore d'évaluation
- Coagulation - Floculation - PPTX 2020 2ème PartieDocument53 pagesCoagulation - Floculation - PPTX 2020 2ème Partiepc takouachet100% (1)
- 03-Transport MembranaireDocument6 pages03-Transport MembranaireMartin BtbxPas encore d'évaluation
- Purification Des ProtéinesDocument25 pagesPurification Des Protéinessalma maroufPas encore d'évaluation
- BiomembraneDocument10 pagesBiomembraneSido SidosidoPas encore d'évaluation
- Chapitre D'introduction: Armelle - Cabin@Document35 pagesChapitre D'introduction: Armelle - Cabin@atha45Pas encore d'évaluation
- Résumé GCDocument6 pagesRésumé GCLilia TlbPas encore d'évaluation
- CelluleDocument56 pagesCelluleamine100% (3)
- Chapitre 2 Dernière Version Biologie Cellulaire DR LAMDA 2021-2022Document108 pagesChapitre 2 Dernière Version Biologie Cellulaire DR LAMDA 2021-2022Zakaria BbaPas encore d'évaluation
- Cours 03. BC (Membrane Plasmique)Document31 pagesCours 03. BC (Membrane Plasmique)KIKOPas encore d'évaluation
- Physiologie SyllabusDocument40 pagesPhysiologie SyllabusDimitry ZikemboPas encore d'évaluation
- CM #1 CM #2 CM #4: 3.1. La Cellule 3.2. Interactions de La Cellule Et de Son MilieuDocument11 pagesCM #1 CM #2 CM #4: 3.1. La Cellule 3.2. Interactions de La Cellule Et de Son Milieuambre.nurdinPas encore d'évaluation
- Chapitre 3 La Membrane Plasmique MedDocument6 pagesChapitre 3 La Membrane Plasmique MedDear tynaPas encore d'évaluation
- Physiologie Digestive PDFDocument22 pagesPhysiologie Digestive PDFInes ZinsouPas encore d'évaluation
- Rogan Brown: ArtisteDocument26 pagesRogan Brown: Artistepsp12369420Pas encore d'évaluation
- Electrophysiologie Membranaire 2020Document11 pagesElectrophysiologie Membranaire 2020Lina AmiraPas encore d'évaluation
- Grenoble Bio CellDocument29 pagesGrenoble Bio CellHugo FPas encore d'évaluation
- Physiologie de La Cellule Et de La MembraneDocument14 pagesPhysiologie de La Cellule Et de La MembraneKhaoula SahtouriPas encore d'évaluation
- Exmd Fiches Bio 9 - RearrangedDocument91 pagesExmd Fiches Bio 9 - RearrangedBillel BenchihaPas encore d'évaluation
- Chapitre V La Membrane PlasmiqueDocument7 pagesChapitre V La Membrane PlasmiqueHatim Aitlaama100% (1)
- Biologie CellulaireDocument31 pagesBiologie CellulaireNora NoraPas encore d'évaluation
- 4 - 1 Membrane PlasmiqueDocument43 pages4 - 1 Membrane PlasmiqueCelia Andreu AliagaPas encore d'évaluation
- Composition Chimique de La CelluleDocument215 pagesComposition Chimique de La CelluleKhalid Jbilou100% (1)
- Physio1an-Membrane Plasmique2016Document44 pagesPhysio1an-Membrane Plasmique2016Amina MnPas encore d'évaluation
- Bloc 1-Structures Et Fonctions Des Membranes - E - H24Document22 pagesBloc 1-Structures Et Fonctions Des Membranes - E - H24meriemaminaskouPas encore d'évaluation
- 02-La Membrane Plasmique NeuronaleDocument27 pages02-La Membrane Plasmique NeuronaleBook HunterPas encore d'évaluation
- 1.4. Le Transport MembranaireDocument13 pages1.4. Le Transport MembranaireAstrid Gentelle Ngatchou TchuisseuPas encore d'évaluation
- BiophysiqueDocument7 pagesBiophysiquealmnaouarPas encore d'évaluation
- Les Membranes Biologiques - RéparationDocument112 pagesLes Membranes Biologiques - RéparationDina NdiayePas encore d'évaluation
- 2021 - Cours La Cellule Version ComplèteDocument10 pages2021 - Cours La Cellule Version Complèteagathe surusPas encore d'évaluation
- Cyto1an-Systeme EndomembranaireDocument82 pagesCyto1an-Systeme EndomembranaireAdam FellousPas encore d'évaluation
- Échange MembranaireDocument27 pagesÉchange MembranaireFatïma ZohraPas encore d'évaluation
- PCM NaDocument172 pagesPCM NaSamia MiledPas encore d'évaluation
- SomesthesiepptDocument29 pagesSomesthesiepptasma2490Pas encore d'évaluation
- Somesthesie Generale (Paul Sauleau)Document9 pagesSomesthesie Generale (Paul Sauleau)asma2490Pas encore d'évaluation
- Les Médicaments Psychiatriques Démystifiés (PDFDrive)Document331 pagesLes Médicaments Psychiatriques Démystifiés (PDFDrive)Songuigama Coulibaly100% (2)
- Maladie Dalzheimer Et Troubles de La Communicat... (Z-Library) PDFDocument149 pagesMaladie Dalzheimer Et Troubles de La Communicat... (Z-Library) PDFLudovicPas encore d'évaluation
- Chapitre 1 - Le Système SomesthésiqueDocument61 pagesChapitre 1 - Le Système Somesthésiqueasma2490Pas encore d'évaluation
- 100questions Leem Fiche-59Document1 page100questions Leem Fiche-59asma2490Pas encore d'évaluation
- Sujets D'exposé Por MasterDocument1 pageSujets D'exposé Por Masterasma2490Pas encore d'évaluation
- Anato1an09-10vx MB SupDocument27 pagesAnato1an09-10vx MB SupChaafi RoufaidaPas encore d'évaluation
- 4SV51DVWB0023D04 DevoirSVT-U04Document4 pages4SV51DVWB0023D04 DevoirSVT-U04w9269905100% (1)
- 2-Histologie de L'Appareil RespiratoireDocument61 pages2-Histologie de L'Appareil RespiratoireImene Imene100% (1)
- 4-Le Tissu ConjonctifDocument60 pages4-Le Tissu ConjonctifAy ManPas encore d'évaluation
- Eudicot ArchaiquesDocument3 pagesEudicot ArchaiquesMar OuaPas encore d'évaluation
- SignedDocument1 pageSignedRania GhezaliPas encore d'évaluation
- Résumé SC Biologiques-1Document3 pagesRésumé SC Biologiques-1hamza malloukPas encore d'évaluation
- ARTICULATION DU COUDE-convertiDocument3 pagesARTICULATION DU COUDE-convertiChelli YoucefPas encore d'évaluation
- Récepteur de La Superfamille TNF AlphaDocument28 pagesRécepteur de La Superfamille TNF AlphaFatima ZahraPas encore d'évaluation
- DR Mahdaoui Sources PDFDocument1 pageDR Mahdaoui Sources PDFKatia Hareb-Cherfaoui67% (3)
- Qu'advient-Il de Ces Milliards de Nanoparticules Dont Vous Eì Tes Devenu L'hoì Te ?Document11 pagesQu'advient-Il de Ces Milliards de Nanoparticules Dont Vous Eì Tes Devenu L'hoì Te ?GCo GroupPas encore d'évaluation
- Appareil de GolgiDocument4 pagesAppareil de GolgiGericault IfoaratianaPas encore d'évaluation
- Cours V La Réaction InflammatoireDocument14 pagesCours V La Réaction InflammatoiretinaPas encore d'évaluation
- Epreuves de Résidanat Pharmacologie 2011 2016Document46 pagesEpreuves de Résidanat Pharmacologie 2011 2016Guzel MuzPas encore d'évaluation
- Cours RCPG-M1-2016-PCMDocument26 pagesCours RCPG-M1-2016-PCMIbrahimPas encore d'évaluation
- Synthèse Motifs D'hospitDocument3 pagesSynthèse Motifs D'hospitEnzo PiniPas encore d'évaluation
- BiocellulaireDocument4 pagesBiocellulairecarlio12Pas encore d'évaluation
- Cours Anatomie App Respiratoire, 2017Document66 pagesCours Anatomie App Respiratoire, 2017walid ouPas encore d'évaluation
- La Posture de L Arbre PDFDocument61 pagesLa Posture de L Arbre PDFkoubyPas encore d'évaluation
- Les Trois CerveauxDocument5 pagesLes Trois CerveauxJean Claude EnriquePas encore d'évaluation
- Stock LesPdf Examens BAC Comores Sujet 2011 Comores Sujet D Science (SVT) Bac 2011Document4 pagesStock LesPdf Examens BAC Comores Sujet 2011 Comores Sujet D Science (SVT) Bac 2011Ahmed100% (1)
- Les TaninsDocument2 pagesLes TaninsYuliya RomanteevaPas encore d'évaluation
- Diagnostic Biochimique Des Maladies Hereditaires Du Metabolisme Profils Metaboliques Et Difficultes de Validation de Methode-Benyoussef-UDocument2 pagesDiagnostic Biochimique Des Maladies Hereditaires Du Metabolisme Profils Metaboliques Et Difficultes de Validation de Methode-Benyoussef-UshafikPas encore d'évaluation
- 8 HomingDocument50 pages8 HomingFarah SalhiPas encore d'évaluation
- 6 Pathologie Vasculaire Et Troubles CirculatoiresDocument22 pages6 Pathologie Vasculaire Et Troubles CirculatoiresDerrar DjamelPas encore d'évaluation
- Anti InflammatoiresDocument6 pagesAnti InflammatoiresBENCHABANE OUSSAMAPas encore d'évaluation
- Circulation Sanguine LDocument4 pagesCirculation Sanguine LDel FinePas encore d'évaluation
- RyktjlDocument2 pagesRyktjlbrucePas encore d'évaluation
- AnalyseDocument5 pagesAnalysegescomPas encore d'évaluation
- Peixoto AngélinaDocument112 pagesPeixoto Angélinacc epitaPas encore d'évaluation
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- La thérapie libre: La Thérapie de LIBération et Résilience EmotionnelleD'EverandLa thérapie libre: La Thérapie de LIBération et Résilience EmotionnelleÉvaluation : 5 sur 5 étoiles5/5 (1)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Cahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesD'EverandCahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesPas encore d'évaluation
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Microbiologie médicale I: agents pathogènes et microbiome humainD'EverandMicrobiologie médicale I: agents pathogènes et microbiome humainÉvaluation : 5 sur 5 étoiles5/5 (1)
- Le CODE DE DIEU: Le secret de notre passé, la promesse de notre avenirD'EverandLe CODE DE DIEU: Le secret de notre passé, la promesse de notre avenirÉvaluation : 4 sur 5 étoiles4/5 (23)
- Connaître ses réactions émotionnelles, pour maîtriser ses émotionsD'EverandConnaître ses réactions émotionnelles, pour maîtriser ses émotionsPas encore d'évaluation
- La Conscience Et L'Univers Existent Sans Commencement Ni FinD'EverandLa Conscience Et L'Univers Existent Sans Commencement Ni FinPas encore d'évaluation
- Les Graines d'Abricot - Remède de Cancer avec de la Vitamine B17 ?: La Médecine Antique Que l'Industrie Pharmaceutique Moderne CacheD'EverandLes Graines d'Abricot - Remède de Cancer avec de la Vitamine B17 ?: La Médecine Antique Que l'Industrie Pharmaceutique Moderne CachePas encore d'évaluation
- Pourquoi suis-je différent?: Accepter et découvrir la puissance de l'hypersensibilitéD'EverandPourquoi suis-je différent?: Accepter et découvrir la puissance de l'hypersensibilitéPas encore d'évaluation
- Qu'arrive t'il a la terre arable ?: Le problème de l'érosion du sol.D'EverandQu'arrive t'il a la terre arable ?: Le problème de l'érosion du sol.Évaluation : 5 sur 5 étoiles5/5 (1)
- Atlas permanent de l'Union européenne: 5e édition revue et augmentéeD'EverandAtlas permanent de l'Union européenne: 5e édition revue et augmentéePas encore d'évaluation
- Les 10 Secrets pour une Vie Plus Heureuse avec la Maladie de ParkinsonD'EverandLes 10 Secrets pour une Vie Plus Heureuse avec la Maladie de ParkinsonPas encore d'évaluation
- Transition énergétique ET Changement climatique: Développements et Perspectives d'AvenirD'EverandTransition énergétique ET Changement climatique: Développements et Perspectives d'AvenirPas encore d'évaluation
- Encyclopédie de la magie des cristaux, des pierres précieuses et des métauxD'EverandEncyclopédie de la magie des cristaux, des pierres précieuses et des métauxÉvaluation : 4 sur 5 étoiles4/5 (116)
- Membranes cellulaires: Les Grands Articles d'UniversalisD'EverandMembranes cellulaires: Les Grands Articles d'UniversalisPas encore d'évaluation