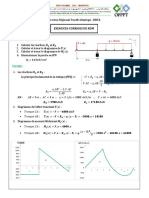
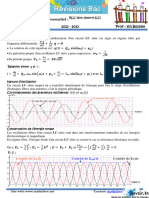
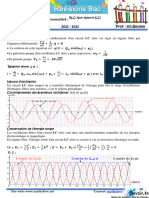
Académique Documents
Professionnel Documents
Culture Documents
Resume Defaut
Transféré par
Taouil MohamedTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Resume Defaut
Transféré par
Taouil MohamedDroits d'auteur :
Formats disponibles
- la conduction ionique ne peuvent s'expliquer que par la présence de défauts intrinsèques et extrinsèques
- que la conductivité électronique peut varier dans de larges mesures en fonction des défauts extrinsèques crées par dopage.
3.1. Concentration des lacunes :
À chaque T, il existe une concentration d’équilibre :
𝒇
−𝚫𝑮𝒍
- Concentration atomique 𝑵𝒍 = 𝐞𝐱𝐩( ) (loi d’Arrhenius)
𝒌𝑻
𝒇
−𝚫𝑮𝒍
- Concentration molaires 𝑿𝒍 = 𝐞𝐱𝐩 𝑹𝑻
3.2. Thermodynamique des lacunes :
𝒇 𝒇
- 𝚫𝑮𝒍 = 𝚫𝑯𝒍 + 𝑻𝚫𝑺𝒍
- l’incorporation :
𝑵𝒂𝑪𝑳
- centre F : 𝐍𝒂 𝒗𝒂𝒑𝒆𝒖𝒓 𝑿
𝑵𝒂𝑵𝒂 + 𝑽𝑪𝒍𝑿
𝑴𝒈𝑶 ,
- centre 𝑭𝑨 : 𝑳𝒊 𝒗𝒂𝒑𝒆𝒖𝒓 𝑳𝒊𝑴𝒈 + 𝑽𝑶∗
1. Défauts intrinsèques
1.1. Lacunes
.
: Formation des lacunes anioniques et cationiques simultanément.(augmentation du nombre des sites cristallins)
,
- 0՜ 𝑽𝑵𝒂 + 𝑽𝑪𝒍∗
1.2. Interstitiels : Désordre.
de Frenkel : pas création de sites, changement d′occupation de sites
-A T élevé : 𝑵𝒂𝑵𝒂 𝑿
+ 𝑽𝒊 𝑿 ՜ 𝑵𝒂𝒊∗, + 𝑽𝑵𝒂
,
1.4. Défauts électroniques :
• 𝑳𝒆 𝒈𝒂𝒑: 𝑬𝒈 = 𝑬𝑩.𝑪 − 𝑬𝑩.𝑽
.
- A T élevée : 0՜ 𝒆. , + 𝒉. ∗ dans un cristal ionique les électrons de valence sont localisés sur les anions
- La transition d’un électron de B.V. vers B.C. peut alors s’interpréter comme un transfert de charge de l’anion vers le cation.
3. Règles pour écrire les réactions de défauts
3.1. Conservation des sites
𝒏
rapport stœchiométrique : 𝒎 𝑴𝒎 𝑵𝒏 ,
4. La thermodynamique et équilibre de défauts
- 𝑮 = 𝑮∗ + 𝚫𝐇 + 𝑻𝚫𝑺 ⇒ 𝚫𝑮 = 𝑮∗ + 𝒏𝑫 𝚫𝐇 + 𝑻(𝒏𝑫 𝚫𝑺𝑽 + 𝚫𝑺𝒄 )
• Concentration d'équilibre thermodynamique :
𝒏 𝟐𝚫𝑺𝑽 −𝚫𝑯𝑽 𝒏
- loi d′action des masses ⇒ (𝒏+𝑵)𝟐 = 𝒆𝒙𝒑 𝒆𝒙𝒑 , 𝐟𝐫𝐚𝐜𝐭𝐢𝐨𝐧 𝐦𝐨𝐥𝐚𝐢𝐫𝐞 𝐝𝐞 𝐜𝐡𝐚𝐪𝐮𝒆 𝒔𝒊𝒕𝒆 ⇒
𝒌 𝒌𝑻 𝒏+𝑵
, 𝟐𝚫𝑺 −𝚫𝑯𝑽 −𝚫𝑮𝑽
- La constante de Schottky : 𝑲𝑺 = [𝑽𝑵𝒂 ][𝑽𝑪𝒍∗ ] = 𝒆𝒙𝒑 𝒌 𝑽 𝒆𝒙𝒑 = 𝒆𝒙𝒑
𝒌𝑻 𝒌𝑻
5. La loi d’action des masses
,
[𝑵𝒂𝒊∗ ][𝑽𝑵𝒂 ] 𝚫𝑮𝟎𝒊 ,
• Désordre de Frenkel : 𝑲𝑭 = 𝑿 ][𝑽 𝑿 ] = 𝒆𝒙𝒑 − = [𝑵𝒂𝒊∗ ] 𝑽𝑵𝒂 = [𝑵𝒊 ]𝟐 𝟏𝒄𝒂𝒍 = 𝟒, 𝟏𝟖𝟒 𝑱
[𝑵𝒂𝑵𝒂 𝒊 𝒌𝑻
6. Concentration intrinsèque des électrons
- l'ionisation intrinsèque : excitation des électrons de la B.V vers la B.C
𝒏 𝐍𝐦𝐛𝐫.𝐝′ 𝒆 , 𝒍𝒊𝒃𝒓𝒆 𝒅𝒂𝒏𝒔 𝑩.𝑪
- potentiel chimique des électrons : =𝝁𝒆. + 𝝁𝒆𝟎 𝒌𝑻𝒍𝒏 𝑵
= 𝐍𝐦𝐛𝐫.𝐝′ 𝐞𝐭𝐚𝐭𝐬 𝐝′ 𝐞𝐧𝐞𝐫𝐠𝐢𝐞 𝐝𝐚𝐧𝐬 𝐥𝐚 𝑩.𝑪
𝑪
𝑬 −𝑬 𝒏 𝑬 −𝑬
𝒏 = 𝑵𝑪 𝐞𝐱𝐩 − 𝑪𝒌𝑻 𝑭 ⇒ 𝑬𝑭 = 𝑬𝑪 + 𝒌𝑻𝒍𝒏 𝑵 , 𝒑 = 𝑵𝑽 𝐞𝐱𝐩 − 𝑭𝒌𝑻 𝑽
𝑪
. 𝑬 −𝑬 𝑬𝒈
- Cste d’ionisation intrinsèque: ,0՜ 𝒆. , + 𝒉. ∗ , 𝑲𝒊 = [𝒆. , ] 𝒉. ∗ = 𝒏. 𝒑 = 𝒏𝟐 = 𝑵𝑪 𝟐 − 𝑪𝒌𝑻 𝑽 = 𝑵𝑪 𝟐 − 𝒌𝑻
2. Caractère semi-conducteur des oxydes métalliques : écart à la stœchiométrie :
• semi-conducteur de type n : 𝑴𝑴𝟐∗ , 𝑽𝑶𝟐∗ .
• semi-conducteur de type p : 𝑶𝑶𝟐∗ , 𝑽𝑴𝟐, .
3. Préparation d’un composé non-stœchiométrique :
𝟏
𝟏 𝟐𝚫𝑮𝟎𝑻 𝑷.𝑯 𝑶
- 𝑯𝟐 𝑶 = + 𝑶 , 𝐊= 𝑷−`𝟏 𝟐
𝑯𝟐 𝑶 𝑷𝑯𝟐 𝑷𝑶𝟐 , 𝐥𝐧 𝑷.𝑶𝟐 = − 𝑹𝑻 + 𝟐𝐥𝐧 𝟐
𝟐 𝟐 𝑷 𝑯𝟐
• Lacunes anioniques prépondérantes:
𝟏
. 𝟏
- 𝑶𝑶𝑿 ՜ + 𝑽𝑶𝒙 , 𝑲𝑽𝑶 = 𝑷𝑶 [𝑽𝑶𝒙 ]
𝑶 𝟐
𝟐 𝟐 𝟐
• Condition d'électroneutralité :
−𝟏
- 𝒏= 𝑽𝑶∗ +𝟐 𝑽𝑶𝟐∗ , 𝒏𝟑 = 𝑲𝑽𝑶 𝑲𝒂 (𝐧 + 𝟐𝑲𝒃 ) 𝑷 𝟐
𝑶𝟐 , 𝐱 = 𝑽𝑶𝒙 + 𝑽𝑶∗ + 𝑽𝑶𝟐∗
−𝟏 −𝟏
𝒏
- Faible écart à la stœchiométrie : 𝒏 ≪ 𝑲𝒃 : 𝒏𝟑 𝟐
= 𝑲𝑽𝑶 𝑲𝒂 (𝟐𝑲𝒃 ) 𝑷 , ⇒ 𝒏 =α 𝑷
𝑶𝟐
𝟔
𝑶𝟐 ; 𝑽𝑶𝟐∗ ≫ 𝑽𝑶∗ ; 𝑽𝑶𝟐∗ = 𝐱 = 𝟐
−𝟏 −𝟏
- Fort écart à la stœchiométrie : 𝒏 ≫ 𝑲𝒃 : 𝒏𝟐 = 𝑲𝑽𝑶 𝑲𝒂 𝑷 , ⇒ 𝒏 =α 𝑷 𝟐
𝑶𝟐
𝟒
𝑶𝟐 ; 𝑽𝑶𝟐∗ ≪ 𝑽𝑶∗ ; 𝑽𝑶∗ = 𝐱 = 𝐧
- 𝐥𝐨𝐠 𝐱 = 𝐟 𝐥𝐨𝐠 𝑷𝒐𝟐 ⇒ 𝐩𝐞𝐧𝐭 𝐭𝐲𝐩𝐞 𝐝𝐞𝐬 𝐥𝐚𝐜𝐮𝐧𝐞𝐬
• Interstitiels cationiques prépondérants (cas d'un oxyde MO) :
𝟏
. 𝟏
- 𝑴𝑴𝑿 +𝑶𝑶𝑿 ՜ 𝑴𝒊 𝑿 + 𝟐 𝑶𝟐 , 𝑲𝑴𝑰 𝟐
= 𝑷𝑶 𝑴𝒊 𝑿 ; 𝒅𝒊𝒔𝒑𝒂𝒓𝒊𝒕𝒐𝒏 𝒅𝒆𝒔 𝒔𝒊𝒕𝒆𝒔 𝒔𝒊𝒎𝒖𝒍𝒕𝒂𝒏𝒆𝒎𝒆𝒏𝒕, 𝐱 = 𝑴𝒊 𝑿 + 𝑴𝒊 ∗ + 𝑴𝒊 ∗∗
𝟐
−𝟏
- 𝒏 = 𝑴𝒊 ∗ + 𝟐 𝑴𝒊 ∗∗ , 𝒏𝟑 = 𝑲𝑴𝑰 𝑲𝒄 (𝐧 + 𝟐𝑲𝒅 ) 𝑷 𝟐
𝑶𝟐
−𝟏 −𝟏 −𝟏 −𝟏
- 𝒏 ≪∶ 𝒏𝟑 = 𝑲𝑴𝑰 𝑲𝒄 𝟐𝑲𝒅 𝑷 𝟐
𝑶𝟐
(α 𝑷 ) 𝟔
𝑶𝟐
| 𝒏 ≫: 𝒏𝟐 = 𝑲𝑴𝑰 𝑲𝒄 𝑷 (α 𝑷 )𝟐
𝑶𝟐
𝟒
𝑶𝟐
• Composés déficitaires en cations 𝑴𝟏−𝒚 𝑶
𝟏
𝟏 𝑴𝑶 −
- les oxydes MO : 𝟐 𝑶𝟐 𝑶𝑶𝒙 + 𝑽𝑴𝒙 , 𝑲𝑽𝑴 = 𝑷𝑶𝟐 𝑽𝑴𝒙 ,
𝟐
𝟏 𝑴𝑶 .
- 𝑶 + 𝑶 𝑿
+ 𝟐𝒉 ∗ + 𝑽 𝟐, , 𝟐𝒉∗ + 𝟐𝑴 𝒙 ՜ 𝟐𝑴 ∗
𝟐 𝟐 𝑶 𝑴 𝑴 𝑴
- => deux trous se localisant sur deux cations
- y= 𝑽𝑴𝑿 + 𝑽𝑴∗ + 𝑽𝑴𝟐∗ , 𝒑 = 𝑽𝑴∗ + 𝟐 𝑽𝑴𝟐∗
𝟏 𝟏
- 𝑽𝑴𝟐∗ : p α 𝑷𝑶 , 𝑽𝑴∗ : p α 𝑷𝑶
𝟔 𝟒
𝟐 𝟐
a) Fraction de sites :M 𝑨𝟐−𝐱
𝒏 𝒏 𝑵 −𝒏
- 𝑽𝑨. = 𝑵𝑽𝑨 , 𝟐 − 𝐱 = 𝒏 𝑨 = 𝑵 𝑨−𝒏𝑽𝑽𝑨
𝑨 𝑴 𝑴 𝑴
.
- Localisation des trous sur les cation métalliques, Le défaut ponctuel s’écrit : 𝟐𝑴𝑴𝒙 + 𝟐𝒉 ՜ 𝟐𝑴𝑴∗
∗
𝟏 𝑴𝑶
- Le Bilan global est : 𝑳𝒊𝟐 𝑶 + 𝟐 𝑶𝟐 + 𝟐𝑴𝑴𝒙 𝟐𝑳𝒊𝑴, + 𝟐𝑶𝑶𝑿 + 𝟐𝑴𝑴∗ ⇒ Conducteur électronique par trous : Doage.
b) Pérovskites :
𝟑 𝑴𝒏𝟐 𝑶𝟑 𝟑,
𝒙 𝑿 ∗
- LaMnO3 excédentaire en oxygène: 𝑶 𝟐 + 𝟔𝑴𝒏 𝑴𝒏 𝟑𝑶 𝑶 + 𝟐𝑽𝑴𝒏 + 𝟔𝑴𝒏 𝑴𝒏 (+),
. 𝟐 .
𝒙 ∗ 𝟒+
- (𝟔𝑴𝒏𝑴𝒏 + 𝟔𝒉∗ ՜ 𝟔𝑴𝒏𝑴𝒏 ); (𝑴𝒏. 𝟑+ ՜ 𝑴𝒏𝑴𝒏 + 𝒆.− )
𝟏 𝑳𝒂𝟐 𝑶𝟑 ,
- 2𝑺𝒓𝑶 + 𝟐 𝑶𝟐 𝟐𝑺𝒓𝑳𝒂 + 𝟑𝑶𝑶𝒙 + 𝟐𝒉∗ ( 𝒄𝒐𝒏𝒇. 𝒗𝒂 (𝑳𝒂𝟑+ ): 𝟓𝒅𝟎 𝟒𝒔𝟎 )
𝑳𝒂𝟐 𝑶𝟑 ,
- 2𝑺𝒓𝑶 𝟐𝑺𝒓𝑳𝒂 + 𝟐𝑶𝑶𝒙 + 𝑽𝑶𝟐∗ (-)
𝟏 𝑳𝒂𝟐 𝑶𝟑 ,
𝒙
- 𝒓𝒆𝒂𝒄𝒕𝒊𝒐𝒏 𝒈𝒍𝒐𝒃𝒂𝒍𝒆 ⇒ 2𝑺𝒓𝑶 + 𝟐 𝑶𝟐 + 𝟐𝑴𝒏𝑴𝒏 𝟐𝑺𝒓𝑳𝒂 + 𝟑𝑶𝑶𝒙 + 𝟐𝑴𝒏𝑴𝒏 ∗
(0)
∗ ,
- stœchiométrique en oxygène(0) : [𝑴𝒏𝑴𝒏 ]𝒆𝒙𝒕𝒓𝒂 = [𝑺𝒓𝑳𝒂 ] = 𝐩, compensation de charge des ions Sr2+ par des ions Mn4+
,
- sous-stœchiométrie en oxygène (-) : [𝑺𝒓𝑳𝒂 ] = 2[𝑽𝑶𝟐∗ ] création de [𝑽𝑶𝟐∗ ] créées par dopage par un élément de D.O inférieur
- sous-stœchiométrie en oxygène(+): [𝑴𝒏𝑴𝒏 ∗
]𝑰𝒏𝒕𝒓𝒂 = 𝟑[𝑽𝟑𝑳𝒂, ] Mn4+ neutralisant les ions oxygène de sur-stœchiométrie,
2. Substitution par un cation de valence supérieure
𝑆𝑖
- 𝑃 ՜ 𝑃𝑆𝑖∗ + 𝑒 ,
2.1. Le cation du réseau hôte a une valence fixe
a) Influence sur la concentration en lacunes cationiques
𝑴𝑶
- réaction d’insertion:
- réaction chimique : (1-x)
- excès électronique dans le réseau, la bande de valence est plein + l’excès des électrons vont occuper la bande de conduction
- ⇒ semi-conducteur de type n
𝑴𝑨 , ,
𝑴𝒆𝑨𝟐 𝑴𝒆𝑴∗ + 𝟐 𝑨𝑨𝒙 + 𝑽𝑴 ⇒ 𝐜𝐨𝐧𝐝𝐢𝐭𝐢𝐨𝐧 𝐝′ 𝐞𝐥𝐞𝐜𝐭𝐫𝐨𝐧𝐞𝐮𝐭𝐫𝐚𝐥𝐢𝐭𝐞(𝐜𝐨𝐦𝐩𝐨𝐬𝐞 𝐝𝐨𝐩𝐞): [𝑴𝒆𝑴∗ ] + [𝑽𝑨∗ ] = [𝑽𝑴 ]
. , 𝟐
, , , 𝟐 [𝑽𝑴 ]𝟎
𝟎՜ 𝑽𝑨∗ + 𝑽𝑴 ⇒ 𝐜𝐨𝐦𝐩𝐨𝐬𝐞 𝐬𝐭𝐞𝐨𝐜𝐡𝐢𝐨𝐦𝐞𝐭𝐫𝐢𝐪𝐮𝐞 𝐩𝐮𝐫𝐞 ∶ 𝑲𝒔 = 𝑽𝑨∗ 𝑽𝑴 = [𝑽𝑴 ]𝟎 ⇒ 𝑽𝑨∗ = ,
𝑽𝑴
, 𝟐
, [𝑽𝑴 ]𝟎 , , 𝟏 , 𝟐
- ⇒ 𝑽𝑴 = , + [𝑴𝒆𝑴∗ ]: 𝐫𝐞𝐬𝐨𝐥𝐮𝐭𝐢𝐨𝐧 𝐝′ 𝐞𝐪. ⇒ 𝑽𝑴 = 𝑽𝑴 = [𝑴𝒆𝑴∗ + ([𝑴𝒆𝑴∗ ]𝟐 + 𝟒 𝑽𝑴 ]𝟎
𝑽𝑴 𝟐
𝟏
, , ,
- Cas [𝑴𝒆𝑴∗ ] ≪ [𝑽𝑴 ]𝟎 : 𝑽𝑴 = [𝑽𝑴 𝟐
]𝟎 = 𝑲𝒔 ⇒ 𝐃𝐨𝐦𝐚𝐢𝐧𝐞 𝐢𝐧𝐭𝐫𝐢𝐧𝐬𝐞𝐪𝐮𝐞
, ,
- Cas [𝑴𝒆𝑴∗ ] ≫ [𝑽𝑴 ]𝟎 : 𝑽𝑴 = [𝑴𝒆𝑴∗ ] ⇒ 𝐃𝐨𝐦𝐚𝐢𝐧𝐞 𝐞𝐱𝐭𝐫𝐢𝐧𝐬𝐞𝐪𝐮𝐞
,
- ⇒ 𝐥𝐚 𝑽𝑴 𝐞𝐬𝐭 𝐢𝐦𝐩𝐨𝐬𝐞 𝐩𝐚𝐫 𝐥𝐚 𝐜𝐨𝐧𝐜𝐞𝐧𝐭𝐫𝐚𝐭𝐢𝐨𝐧 𝐝𝐞𝐬 𝐢𝐦𝐩𝐮𝐫𝐭𝐞𝐬
• Création de lacunes cationiques
• Création d’interstitiels anioniques: les anions excédentaires vont se localiser sur les sites interstitiels vides
2.2. Le cation du réseau hôte a une valence variable
a) Dioxyde de titane dopé avec Nb2O5 : Dopage par électrons
𝒙 .
réaction chimique : 𝟏 − 𝒙 𝑻𝒊𝑶𝟐 + 𝟐 𝑵𝒃𝟐 𝑶𝟓 ՜ 𝑵𝒃𝑿 𝑻𝒊𝟏−𝑿 𝑶 𝑿 (𝑽𝑻𝒊𝟒∗, )𝑿 ⇒conducteur ionique par lacunes cationiques
𝟐+ 𝟒
𝟐
𝑻𝒊𝑶𝟐
sous-stœchiométrie en oxygène(+): 𝟐𝑵𝒃𝟐 𝑶𝟓 ∗
𝟒𝑵𝒃𝑻𝒊 + 𝟏𝟎𝑶𝑶𝒙 + 𝑽𝑻𝒊𝟒,
. 𝟏
- stœchiométrique en oxygène(0) : 𝑽𝑻𝒊𝟒, + 𝑶𝑶𝒙 ՜ 𝟐 𝑶𝟐 + 𝟒𝒆, , 𝟒[𝑽𝑻𝒊𝟒, ] = [𝒆 , ] = [𝑵𝒃𝑻𝒊
∗
] ⇒ conducteur 𝐞𝐥𝐞𝐜𝐭𝐫𝐨𝐧ique
- les lacunes cationiques aient disparu (vers pO2 = 10−5) ⇒ 𝟒[𝑽𝑻𝒊𝟒, ] = [𝒆 , ] = [𝑵𝒃𝑻𝒊
∗
]
. 𝟏
- sous-stœchiométrie en oxygène (-) : 𝑶𝑶𝑿 ՜ 𝑶𝟐 + 𝑽𝑶𝟐∗ + 𝟐𝒆 , ⇒ conducteur 𝐦𝐢𝐱𝐭𝐞(destruction des sites anioniques et
𝟐
cationiques)
Vous aimerez peut-être aussi
- Exercices Corrigé de RDMDocument2 pagesExercices Corrigé de RDMAit Messaoud Abdlatif93% (15)
- SDH (Système Du Design Humain) - 4typesDocument15 pagesSDH (Système Du Design Humain) - 4typesExperience Electrique100% (12)
- Calcul de PORTIQUESDocument7 pagesCalcul de PORTIQUESCyrine Messai100% (1)
- Bioinformatique ExamenDocument24 pagesBioinformatique ExamenSôümïã Tôu100% (1)
- Resume DefautDocument6 pagesResume DefautTaouil MohamedPas encore d'évaluation
- Cours Sur Le Spectrographe de Masse (Résumé)Document13 pagesCours Sur Le Spectrographe de Masse (Résumé)Mohamed Soibaha Chaambane100% (2)
- CHAP 7 ConducteurDocument14 pagesCHAP 7 ConducteurMaram DhahriPas encore d'évaluation
- Conductuion Electrique Dans Les SolidesDocument32 pagesConductuion Electrique Dans Les SolidesCHAIMA DEHBIPas encore d'évaluation
- Correction SÃrie Nâ3 2022 2023Document14 pagesCorrection SÃrie Nâ3 2022 2023rebaiahmed244Pas encore d'évaluation
- Examen1 Théorie Du ChampDocument3 pagesExamen1 Théorie Du ChampGACEM KARIMPas encore d'évaluation
- Méthode Des Éléments Finis-Avancée (CD)Document64 pagesMéthode Des Éléments Finis-Avancée (CD)Hassine TarekPas encore d'évaluation
- Cours Des Sciernces PhysiquesDocument184 pagesCours Des Sciernces PhysiquesDalchy MakossoPas encore d'évaluation
- LoisDocument2 pagesLoisthegsaad2Pas encore d'évaluation
- Exercice 7 Etude de La Dé Charge Du Condensateur À Travers La BobineDocument9 pagesExercice 7 Etude de La Dé Charge Du Condensateur À Travers La BobineSerigne saliou GayePas encore d'évaluation
- Correction TD5 CHAMP MAGNETOSTATIQUEDocument6 pagesCorrection TD5 CHAMP MAGNETOSTATIQUEnadinerjaibi15Pas encore d'évaluation
- É Lect Rosta TiqueDocument14 pagesÉ Lect Rosta TiqueRamanou Do REGOPas encore d'évaluation
- Exercice 1 (Circuit RLC)Document6 pagesExercice 1 (Circuit RLC)Mohamed Soibaha Chaambane0% (1)
- Exercices DelectrostatiqueDocument16 pagesExercices Delectrostatiqueadjidavibruno7Pas encore d'évaluation
- Chapitre 6 LET52Document8 pagesChapitre 6 LET52Lionel ThiombianoPas encore d'évaluation
- Serie Exo PC 1ere S Force Et ChampDocument14 pagesSerie Exo PC 1ere S Force Et ChampAly NdaoPas encore d'évaluation
- CNC MP 2017 Chimie Corrige PDFDocument21 pagesCNC MP 2017 Chimie Corrige PDFYassir Sadiq ElfilaliPas encore d'évaluation
- Bousehaba Td1avec SolutionDocument4 pagesBousehaba Td1avec SolutionMeryeme M'HouhPas encore d'évaluation
- Champ-Force ElectrostatiqueDocument8 pagesChamp-Force ElectrostatiqueayoubPas encore d'évaluation
- TD4 Electrocinétique 2021-2022 CorrigéDocument9 pagesTD4 Electrocinétique 2021-2022 CorrigéLAHCEN OUTALBPas encore d'évaluation
- Compte Rendu tp3Document6 pagesCompte Rendu tp3Ilyass HajriPas encore d'évaluation
- TD N°3 MDF SolDocument5 pagesTD N°3 MDF SolAhmed Ayoub Osmani100% (1)
- Correction de La Série N°3 - EX456Document13 pagesCorrection de La Série N°3 - EX456KhPas encore d'évaluation
- L2 Physique MAGRI-STELLA Protocole de TP 1Document3 pagesL2 Physique MAGRI-STELLA Protocole de TP 1Laurent MagriPas encore d'évaluation
- កំណែរ វិញ្ញាសាប្រឡងបញ្ចប់ឆមាសទី១មេកានិច២Document9 pagesកំណែរ វិញ្ញាសាប្រឡងបញ្ចប់ឆមាសទី១មេកានិច២Dim Lify100% (2)
- EM6 TD MaxwellDocument4 pagesEM6 TD MaxwellAbdelwahed EL BATOULPas encore d'évaluation
- La Geometrie de Quelques Molecules Cours 1 1Document4 pagesLa Geometrie de Quelques Molecules Cours 1 1zakariae100% (1)
- Etude Des BosonsDocument17 pagesEtude Des BosonsMouna FgPas encore d'évaluation
- Onde GuidéeDocument10 pagesOnde GuidéeMaha CherifPas encore d'évaluation
- Vibrations Et Ondes Chapitre Ii 2021 2022Document10 pagesVibrations Et Ondes Chapitre Ii 2021 2022hadil medPas encore d'évaluation
- Poly Complet 08 Circuits Linéaires D'ordre 2 en Régime TransitoireDocument13 pagesPoly Complet 08 Circuits Linéaires D'ordre 2 en Régime TransitoireSélène Chausson100% (1)
- 6 Solution TD 6Document6 pages6 Solution TD 6Mohamed HaddadPas encore d'évaluation
- Exercice 2 (Circuit RLC)Document6 pagesExercice 2 (Circuit RLC)souleymane zeyePas encore d'évaluation
- Chapitre 6 EM22019Document20 pagesChapitre 6 EM22019Said Soilihi ZayadPas encore d'évaluation
- Universite Sultan Moulay SlimaneDocument16 pagesUniversite Sultan Moulay SlimaneNadia ElbouaazzaouiPas encore d'évaluation
- RlccoursDocument8 pagesRlccoursKamal KamalPas encore d'évaluation
- Cours 1Document4 pagesCours 1ghadaPas encore d'évaluation
- TD N1 2023 2024 Classification Des EDP 231019 0911 231118 153144Document2 pagesTD N1 2023 2024 Classification Des EDP 231019 0911 231118 153144travelsos98Pas encore d'évaluation
- CHAPITRE IV Ondes ElectromagnetiquesDocument13 pagesCHAPITRE IV Ondes ElectromagnetiquesM'pounguiPas encore d'évaluation
- RLC Non AmortiDocument1 pageRLC Non Amortiazizbenromdhane51Pas encore d'évaluation
- Analyse de Mouvement1Document29 pagesAnalyse de Mouvement1moboom18Pas encore d'évaluation
- RLC Non AmortiDocument1 pageRLC Non AmortiAmsou gangPas encore d'évaluation
- Corrigé TD 2Document9 pagesCorrigé TD 2Xeel OoxPas encore d'évaluation
- Slides SolidesDocument86 pagesSlides SolidesYouness BenaarifPas encore d'évaluation
- Exercice Corrige SuperpositionDocument2 pagesExercice Corrige Superpositionpikalapikala000Pas encore d'évaluation
- La Géométrie de Quelques MoléculesDocument4 pagesLa Géométrie de Quelques Moléculesicer350Pas encore d'évaluation
- Corrigé TD 1 RDM2 - El - Amine-ConvertiDocument52 pagesCorrigé TD 1 RDM2 - El - Amine-ConvertiIkram El JamaiPas encore d'évaluation
- TD1 CorrectionDocument8 pagesTD1 CorrectionDaoud ElalouanyPas encore d'évaluation
- 12 0 OscillateursDocument3 pages12 0 Oscillateursمهدي محمدPas encore d'évaluation
- 13 Exo Elect Solution Cours PHY104 2020 2021Document29 pages13 Exo Elect Solution Cours PHY104 2020 2021Isaacar Moye la SouzaPas encore d'évaluation
- Ensemble Grand CanoniqueDocument11 pagesEnsemble Grand CanoniqueMouna FgPas encore d'évaluation
- Corrige de l' Interrogation de Physique Fevrier 2024Document6 pagesCorrige de l' Interrogation de Physique Fevrier 2024edouardanicet28Pas encore d'évaluation
- Chapitre 5Document4 pagesChapitre 5OnésimePas encore d'évaluation
- Vibrations LongitudinalesDocument19 pagesVibrations LongitudinalesSami BaouPas encore d'évaluation
- Revision Thermique G1 G2Document22 pagesRevision Thermique G1 G2Mohemed DahrPas encore d'évaluation
- Examen Normal Solide 2018-2019Document2 pagesExamen Normal Solide 2018-2019Taouil MohamedPas encore d'évaluation
- Chimie Organique - Les Cours de Paul Arnaud - 20e Édition (Brigitte Jamart, Jacques Bodiguel Etc.)Document697 pagesChimie Organique - Les Cours de Paul Arnaud - 20e Édition (Brigitte Jamart, Jacques Bodiguel Etc.)Taouil Mohamed100% (2)
- Contrôle Solide 20-21Document2 pagesContrôle Solide 20-21Taouil MohamedPas encore d'évaluation
- Magnetostatique 6Document149 pagesMagnetostatique 6Taouil MohamedPas encore d'évaluation
- Dipole Magnetique ElectriqueDocument32 pagesDipole Magnetique ElectriqueTaouil MohamedPas encore d'évaluation
- ChEM3 DipôlesDocument12 pagesChEM3 DipôlesTaouil MohamedPas encore d'évaluation
- Dipole MagnetiqueDocument3 pagesDipole MagnetiqueTaouil MohamedPas encore d'évaluation
- Dopage 1Document5 pagesDopage 1Taouil MohamedPas encore d'évaluation
- Polycopié de TP de Transfert de Matière Et de Chaleur & Calcul Des Réacteurs Master Ch. Des Matériaux FPNDocument34 pagesPolycopié de TP de Transfert de Matière Et de Chaleur & Calcul Des Réacteurs Master Ch. Des Matériaux FPNTaouil MohamedPas encore d'évaluation
- Présentation 100Document6 pagesPrésentation 100Taouil MohamedPas encore d'évaluation
- Dopage 1Document5 pagesDopage 1Taouil MohamedPas encore d'évaluation
- Viscosite &transfertsDocument36 pagesViscosite &transfertsTaouil MohamedPas encore d'évaluation
- Dopage 1Document6 pagesDopage 1Taouil MohamedPas encore d'évaluation
- Resume Transfert de Chaleur Et de MatierDocument4 pagesResume Transfert de Chaleur Et de MatierTaouil MohamedPas encore d'évaluation
- I.A.1. Bilan Thermique I.A.2. Bilan de Matière Pour A (Réactif)Document2 pagesI.A.1. Bilan Thermique I.A.2. Bilan de Matière Pour A (Réactif)Taouil MohamedPas encore d'évaluation
- Cours Calcul Des Réacteurs Chimique. Master Chimie Des Matériaux FPN-convertiDocument43 pagesCours Calcul Des Réacteurs Chimique. Master Chimie Des Matériaux FPN-convertiTaouil MohamedPas encore d'évaluation
- Physico-Chimie Des Surfaces Et Catalyse HétérogèneDocument93 pagesPhysico-Chimie Des Surfaces Et Catalyse HétérogèneMàâçhë ĶămęłPas encore d'évaluation
- Cours Gestion de ProjetDocument101 pagesCours Gestion de Projetelectronaruto100% (7)
- PROSEHA Version Finale Nov 2016Document108 pagesPROSEHA Version Finale Nov 2016OUSMANPas encore d'évaluation
- NF en 12591Document29 pagesNF en 12591AMENZOU OMARPas encore d'évaluation
- Les Echangeurs PDFDocument58 pagesLes Echangeurs PDFMohamed Rjeb100% (10)
- Peda2 630 PDFDocument87 pagesPeda2 630 PDFsalvateur2012Pas encore d'évaluation
- Béton Armee AymenDocument47 pagesBéton Armee AymenbensofienPas encore d'évaluation
- Glance 76Document48 pagesGlance 76Cayo YandjuePas encore d'évaluation
- Equilibres Doxydo-RéductionDocument42 pagesEquilibres Doxydo-Réductionlahcen essPas encore d'évaluation
- SSFR2009 03Document48 pagesSSFR2009 03Walid OzPas encore d'évaluation
- Devis ARCHIDESIGN - 230531 - 3Document1 pageDevis ARCHIDESIGN - 230531 - 3yaaninvestPas encore d'évaluation
- Les Moments de La Séance D - OralDocument2 pagesLes Moments de La Séance D - OralHicham30Pas encore d'évaluation
- TDR Cadre de Dialogue-1-1Document2 pagesTDR Cadre de Dialogue-1-1Bienvenu Hyacinthe SawadogoPas encore d'évaluation
- Le Secret de La Richesse - Recherche Google 3Document1 pageLe Secret de La Richesse - Recherche Google 3Hamed SaidPas encore d'évaluation
- M04 Technologie D-Entretien FGT-TSCG.865Document83 pagesM04 Technologie D-Entretien FGT-TSCG.865Khalil Lasfer100% (1)
- Rapport D'activites EDST 2011Document24 pagesRapport D'activites EDST 2011Samir2020Pas encore d'évaluation
- Liste Des Eleves Du Centre de Football Makaye Ma NgomeDocument1 pageListe Des Eleves Du Centre de Football Makaye Ma NgomeWillyPas encore d'évaluation
- CI102 Acidite Boisson ColaDocument16 pagesCI102 Acidite Boisson ColaChrist AngePas encore d'évaluation
- After Market Catalogue Edition2 2013 FRDocument226 pagesAfter Market Catalogue Edition2 2013 FRdiraw100% (2)
- Rapport Prelim RGPH3 2019 - Ver - FinalDocument98 pagesRapport Prelim RGPH3 2019 - Ver - FinalVololoniaina RAHOLISONPas encore d'évaluation
- 25goutte A GoutteDocument4 pages25goutte A GoutteDJIDJIKPas encore d'évaluation
- CorrigéOlympiades 7 C T1 M2020Document4 pagesCorrigéOlympiades 7 C T1 M2020Hmd SidiPas encore d'évaluation
- Groupe N°5 Exposé PVTDocument6 pagesGroupe N°5 Exposé PVTSani yaou AbdoullahiPas encore d'évaluation
- Fraisage S3 3Document4 pagesFraisage S3 3aiglePas encore d'évaluation
- TD 05Document1 pageTD 05SeVILLA8DzPas encore d'évaluation
- Jean Houssaye Triange PedagogiqueDocument18 pagesJean Houssaye Triange PedagogiqueL'As De Pique100% (1)
- TextesDocument16 pagesTextesDOULEZEROPas encore d'évaluation
- Rapport de Stage Probatoire Au Laboratoire de Suivi de La Qualité Des EauxDocument133 pagesRapport de Stage Probatoire Au Laboratoire de Suivi de La Qualité Des EauxBarthélemy Bawar Dit WarbiPas encore d'évaluation
- EMD1314Document5 pagesEMD1314mohammed8nizarPas encore d'évaluation
- Les Methodes DenseignementDocument8 pagesLes Methodes DenseignementAhmad KonyPas encore d'évaluation