Académique Documents
Professionnel Documents
Culture Documents
DM 1 Chap 2 3 4
Transféré par
Mattys TotoCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
DM 1 Chap 2 3 4
Transféré par
Mattys TotoDroits d'auteur :
Formats disponibles
DM 1 CHAP.
C2 – C3 – C4 Spé PHYS
RÉACTION RÉDOX – AVANCEMENT – TITRAGES COLORIMÉTRIQUES PREMIÈRE
1. Oxydation des ions ferreux. (11 pts)
Couples oxydant/réducteur :¿
1.1. A l’aide des observations, montrer qu’une transformation chimique a bien lieu.
1.2. Identifier les espèces chimiques qui réagissent : préciser s’il s’agit d’un oxydant ou d’un réducteur.
1.3. Identifier les produits formés. Justifier.
1.4. On souhaite modéliser la transformation par une réaction oxydant-réducteur.
1.4.1 Ecrire les demi-équations électroniques des couples mis en jeu.
1.4.2 Vérifier que l’équation de la réaction oxydant-réducteur modélisant la transformation chimique s’écrit :
1.4.3. Justifier, à l’aide des données, que MnO 4-(aq) et Fe2+(aq) sont introduits en proportions stœchiométriques dans le
mélange initial.
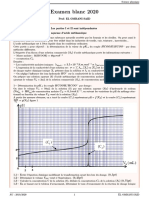
Un programme python permet de visualiser l’évolution des quantités de matière des ions permanganate et des ions ferreux dans
le système en fonction de l’avancement de la réaction noté x.
1.5. Etablir un tableau d’avancement de la réaction et vérifier que la valeur de l’avancement maximal est compatible avec le
tracé de la figure1 ci-dessus.
1.6. Déduire du tableau d’avancement l’expression de la quantité de matière des ions Fe 3+(aq) en fonction de l’avancement.
1.7. Reproduire sur la figure 1 la représentation graphique de l’évolution de la quantité de matière d’ions Mn 2+(aq) et celle de la
quantité de matière d’ions Fe3+(aq).
2. Titrage des ions ferreux. (9pts)
Le taux de fer dans le sang est normalement compris entre 5,0 et 15,0 mg.L-1 chez les femmes.
L’ion fer (II) ou ion ferreux Fe2+ est titré par l’ion péroxodisulfate S2O82-(aq). Pour repérer l’équivalence, il est nécessaire d’ajouter
quelques gouttes d’une solution d’orthophénantroline à l’échantillon titré.
Doc. 1 Couleur des solutions Doc.
2 Indicateur coloré Un indicateur coloré d’oxydoréduction est un couple oxydant-réducteur
Une dont les formes oxydée et réduite ont des couleurs différentes.
Par exemple, en présence d’ions Fe 2+ (aq) une
solution d’orthophénantroline est rouge ; une
fois le fer oxydé en ions Fe3+, la solution prend
solution contenant des ions Fe2+ est une couleur bleue.
très légèrement verte.
Une solution contenant des ions Fe 3+
est très légèrement orange.
Un échantillon de volume V1 = 10,0 mL de sang, contenant essentiellement du fer sous forme ferreuse, est versé dans un
erlenmeyer de 100 mL. Une solution incolore de péroxodisulfate de sodium de concentration c 2 = 100 μmol.L-1 est ajoutée
goutte à goutte jusqu’au changement de couleur de la solution.
L’équivalence est repérée pour un volume Ve = 9,5 mL.
2.1. Représenter un schéma légendé du dispositif expérimental du titrage. Préciser l’espèce titrée et titrante.
2.2. Préciser comment se fera le repérage de l’équivalence. Quel est l’intérêt d’utiliser un indicateur coloré d’oxydo-réduction au
cours de ce titrage.
2.3. Ecrire les demi-équations électroniques pour chacun des couples redox puis en déduire l’équation chimique modélisant la
réaction du titrage.
2.4. Définir l’équivalence.
2.5. Ecrire la relation entre les quantités de matière à l’équivalence.
2.6. Calculer la quantité de matière n(Fe2+) d’ions ferreux dans l’échantillon titré.
2.7. En déduire la masse de fer m(Fe2+) dans ce même échantillon. Conclure : le taux de fer dans cet échantillon est-il dans les
normes ?
Données : Masse d’une mole de fer M(Fe) = 55,8 g. mol-1.
1. Le changement de couleur observé montre qu’une transformation chimique a eu lieu. 0.5
2. MnO4- (oxydant) et Fe2+ (réducteur) sont les réactifs 1
3. La solution orangée montre que des ions Fe3+ sont apparus. L’ion Mn2+ est également formé. 1
2+¿ +4H O ¿
4.1 1
2
−¿=Mn ¿
−¿+8 H +¿+ 5e ¿
¿
et
MnO4 0.5
2+ ¿+ e −¿¿ ¿
3 +¿=Fe ¿
4.2 Fe (x5) 0.5
D’où le bilan donné.
4.3 n 0 ¿ ¿0,01 mol 1
¿
n 0(MnO )=c ×V =1,0× 10 × 20 ×10 =¿ ¿0,002 mol
−1 −3 1
4
1
Si les pptions sont stœchiométriques alors n 0 ¿ ¿ ¿= n 0 ¿ ¿ ¿ donc n 0 ¿ ¿
0,002 x 5 = 0.01 donc la relation est vérifiée !
5. Les réactifs sont introduits en proportions stœchiométriques donc ils sont tous les 2 limitants : 1
¿
On a n 0(MnO 4 )−×max =n 0 ¿ ¿ ¿ d’où ×max =2,00 mmol 1
6. n¿¿ × 0.5
7. 2+
Mn est un produit : sa représentation est une droite de pente >0 1
Fe3+ est un produit : sa représentation est une droite de pente >0 mais 5 fois plus élevée que pour Mn 2+
2.1 Voir leçon. Réactif titrant : le péroxodisulfate ; espèce titrée : l’ion ferreux 2
.
2.2 Les couleurs des espèces mises en jeu au cours de la réaction étant pâles, le changement de couleur à 1
. l’équivalence sera difficilement perceptible : l’orthophénantroline permet de former des complexes de couleurs 0.5
plus intenses afin de repérer l’équivalence plus facilement. La solution passera du rouge au bleu.
2.3
.
2
2.4 A l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques de la réaction support de 0.5
. titrage.
2.5 A l’équivalence, on a : n ¿ ¿ ¿ 0.5
.
2.6 n ¿ ¿100 x 10−6 × 9,5× 10−3=¿1,9x10−6 mol 1
.
2.7 D’où m ¿ ¿1,9x10−6 ×55,8=1,1× 10− 4 g = 0,11 mg 1
. −4 0.5
1,1 ×10 −1
Concentration en masse : Cm = =0,011 g . L soit 11 mg.L-1. Cohérent avec les normes.
10,0× 10−3
Vous aimerez peut-être aussi
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2D'EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Pas encore d'évaluation
- TPChi8 Corrige 1S4Document3 pagesTPChi8 Corrige 1S4Abdelkrim ABPas encore d'évaluation
- Objectif Bac2Document4 pagesObjectif Bac2Face2 BriochePas encore d'évaluation
- TP 2006-2007-Chimie 14Document2 pagesTP 2006-2007-Chimie 14Youcef LalaouiPas encore d'évaluation
- TP00 H2O2corr PDFDocument2 pagesTP00 H2O2corr PDFEl Ouahabi SoufyanePas encore d'évaluation
- DM5 Spé 2011 - Dosage + Formulation-CompletDocument5 pagesDM5 Spé 2011 - Dosage + Formulation-CompletSOULA CHAHINAZPas encore d'évaluation
- TP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrDocument15 pagesTP3 - Dosage de Fe2+ Par Du Permanganate de Potassium - CorrLawrence Mundene-timotheePas encore d'évaluation
- tp13 Dosage Sel de Mohr Corrige 2010-2011Document3 pagestp13 Dosage Sel de Mohr Corrige 2010-2011Abdelkrim AB100% (3)
- Série 5 Loi D'action de Masse 2022Document4 pagesSérie 5 Loi D'action de Masse 2022safouen mejbriPas encore d'évaluation
- Exercices C9: Les Complexes: + 4 NH ZN (NH)Document4 pagesExercices C9: Les Complexes: + 4 NH ZN (NH)Silento SwordPas encore d'évaluation
- Serie Dexercices Generalisation de Loxydoreduction en Solution Aqueuse - 1er S Sunudaara 0Document5 pagesSerie Dexercices Generalisation de Loxydoreduction en Solution Aqueuse - 1er S Sunudaara 0Aida MbodjiPas encore d'évaluation
- 2010 Asie Exo3 Correction QROCChimie 6 5pts - 2Document3 pages2010 Asie Exo3 Correction QROCChimie 6 5pts - 2Youssef DahaniPas encore d'évaluation
- TP Titrage RedoxDocument7 pagesTP Titrage RedoxmiyenadarliebellebellePas encore d'évaluation
- Dosage de Sel de MohrDocument3 pagesDosage de Sel de MohrPoké & YugiPas encore d'évaluation
- Dosage PotentiometriqueDocument11 pagesDosage Potentiometriquedjassa djassa80% (5)
- TP 8 Ox-RedDocument3 pagesTP 8 Ox-RedyassirPas encore d'évaluation
- Corrigé_titrages et tableau d'avcmtDocument4 pagesCorrigé_titrages et tableau d'avcmtDino Benoit-LouberePas encore d'évaluation
- Ch1 - Corr Transformations RapidesDocument9 pagesCh1 - Corr Transformations RapidesFaysal DouhdouhPas encore d'évaluation
- 1 CDocument9 pages1 Cأحمد الميميونيPas encore d'évaluation
- TP1 Chimie Rappels CorrectionDocument6 pagesTP1 Chimie Rappels Correctionأمال بلقاسمPas encore d'évaluation
- TP 2Document2 pagesTP 2Benhmida ChaimaPas encore d'évaluation
- 1 Ere S Eval Decembre 2014Document4 pages1 Ere S Eval Decembre 2014Hadri MohamedPas encore d'évaluation
- TD tc7 DosagesDocument11 pagesTD tc7 Dosagescours importantPas encore d'évaluation
- DS Chapitre 9-10-Corrigé 2022 - CompressedDocument4 pagesDS Chapitre 9-10-Corrigé 2022 - Compressedmube 75Pas encore d'évaluation
- PotentiométrieDocument11 pagesPotentiométrieKawtar Addal100% (3)
- 2006 - Contrôle 4Document1 page2006 - Contrôle 4Essaid AjanaPas encore d'évaluation
- 2020 sp1 Devoir05Document4 pages2020 sp1 Devoir05Kouassi Alain KoffiPas encore d'évaluation
- tp16 Dosage-PotentiometriqueDocument3 pagestp16 Dosage-PotentiometriquePassiPas encore d'évaluation
- Chapitre II. Thermodyn Électrochimi-Équilibre OxRedDocument5 pagesChapitre II. Thermodyn Électrochimi-Équilibre OxRedmiassachahdPas encore d'évaluation
- Decomposition KMnO4 (1)Document5 pagesDecomposition KMnO4 (1)andrianjarasoanoelyenauPas encore d'évaluation
- TD Oxydo-RedDocument4 pagesTD Oxydo-RedNesrıne BoumazaPas encore d'évaluation
- Corrige TP RedoxDocument5 pagesCorrige TP RedoxZakaria ZaynPas encore d'évaluation
- DS 7 E PH + Electrolyse + OrgaDocument10 pagesDS 7 E PH + Electrolyse + Orgavitalfire58Pas encore d'évaluation
- 06 Redox Titration Procedure 20231012Document8 pages06 Redox Titration Procedure 20231012fq.4m.fq.4mPas encore d'évaluation
- FTSCdevoirCinetique5 CorrigeDocument2 pagesFTSCdevoirCinetique5 CorrigeTay SsirPas encore d'évaluation
- Chapitre 2 PCDocument14 pagesChapitre 2 PCRAMDEPas encore d'évaluation
- 1ER-PC-CHAP 03 ExercicesDocument33 pages1ER-PC-CHAP 03 Exercicesarthur pasquet100% (1)
- TP MollDocument3 pagesTP MollMARIAM DERNAIKAPas encore d'évaluation
- TitrageDocument2 pagesTitrageRebecca JacksonPas encore d'évaluation
- Chimie SGDocument7 pagesChimie SGMalih ChebboPas encore d'évaluation
- Tp13 Dosage Sel de Mohr Corrige 2010-2011Document3 pagesTp13 Dosage Sel de Mohr Corrige 2010-2011pedro66100% (3)
- Chimie Bac - Transformations Chimiques - SpectrophotométrieDocument1 pageChimie Bac - Transformations Chimiques - SpectrophotométrieMohammed NiaguiPas encore d'évaluation
- SolubiDocument5 pagesSolubiAdil ELPas encore d'évaluation
- Dosage D'oxydo Reduction Complement Du CoursDocument16 pagesDosage D'oxydo Reduction Complement Du CoursAnonymous 83IGhG100% (1)
- TPRedoxDocument2 pagesTPRedoxAli GhaPas encore d'évaluation
- Correction Devoir No4 Equilibre Dosage NucleaireDocument6 pagesCorrection Devoir No4 Equilibre Dosage NucleaireridhajamelPas encore d'évaluation
- Chap 4 Reactions ChimiquesDocument5 pagesChap 4 Reactions Chimiquestoto TOTOROTO100% (1)
- Controle Dosage1sDocument2 pagesControle Dosage1sKhalid khalid100% (1)
- TP Potentio Corr PDFDocument4 pagesTP Potentio Corr PDFPS HadjerPas encore d'évaluation
- TP N° 5 - Oxydo-Réduction - PDFDocument7 pagesTP N° 5 - Oxydo-Réduction - PDFleilalargate_37809290% (1)
- Exem PCDocument6 pagesExem PCwfwgPas encore d'évaluation
- Masses Molaires Atomiques: M (H) 1,0 G Mol M (C) 12,0 G Mol M (O) 16,0 G Mol M (Ca) 40,0 G Mol M (CL) 35,5 G.mol M (Fe) 55,8 G MolDocument4 pagesMasses Molaires Atomiques: M (H) 1,0 G Mol M (C) 12,0 G Mol M (O) 16,0 G Mol M (Ca) 40,0 G Mol M (CL) 35,5 G.mol M (Fe) 55,8 G MolBesmaPas encore d'évaluation
- Correction DcoDocument3 pagesCorrection DcomohmedPas encore d'évaluation
- EXERCICES RESOLUS Concentration Solutions ÉlectrolytiquesDocument8 pagesEXERCICES RESOLUS Concentration Solutions ÉlectrolytiquesKenza TouizaPas encore d'évaluation
- 8 - DosageDocument4 pages8 - DosageWay to futurePas encore d'évaluation
- Serie 0 RévisionDocument1 pageSerie 0 RévisionAhmed ElhammadiPas encore d'évaluation
- Correction TP Dosage ColorimetriqueDocument2 pagesCorrection TP Dosage ColorimetriqueEl Mehdi AkhatarPas encore d'évaluation
- Système CW de LiebertDocument86 pagesSystème CW de LiebertJavier LunaPas encore d'évaluation
- Ifu - Lettre DgiDocument9 pagesIfu - Lettre Dgicomptabilité financière approfondiePas encore d'évaluation
- Les Obstacles A La CommunicationDocument3 pagesLes Obstacles A La CommunicationSissou Bello100% (2)
- CV Afiatou ToeDocument1 pageCV Afiatou ToeFranck AbPas encore d'évaluation
- PompageDocument14 pagesPompagewithe animalsPas encore d'évaluation
- L'Etat de Nature Chez Thomas HobbesDocument10 pagesL'Etat de Nature Chez Thomas HobbesDenisa Elena FocaruPas encore d'évaluation
- Theme 1 Le Corps HumainDocument65 pagesTheme 1 Le Corps Humainmagali2m100% (1)
- STA201 - Equations Structurelles - 1 - JakobowiczDocument65 pagesSTA201 - Equations Structurelles - 1 - JakobowicztchamPas encore d'évaluation
- Aide Memoire Tuyauterie - CompletDocument62 pagesAide Memoire Tuyauterie - CompletMars7695% (121)
- Mobiscript 3Document77 pagesMobiscript 3wukzPas encore d'évaluation
- Placard de Recrutement ATS FRDocument7 pagesPlacard de Recrutement ATS FRMarass-Tech AgadezPas encore d'évaluation
- Evangile Apocryphe de ThomasDocument10 pagesEvangile Apocryphe de ThomasYves MinougouPas encore d'évaluation
- Atd BasketballDocument20 pagesAtd BasketballelhanyPas encore d'évaluation
- Brochure SOBANE Incendie - FRDocument144 pagesBrochure SOBANE Incendie - FRLarmes de SangPas encore d'évaluation
- rapport_cc_MILKADocument21 pagesrapport_cc_MILKAfefeelbouzidiPas encore d'évaluation
- Partie II La Théorie Du Comportement de ConsommateurDocument77 pagesPartie II La Théorie Du Comportement de ConsommateuressalkagarmounePas encore d'évaluation
- LeadershipDocument6 pagesLeadershipEvodie WestPas encore d'évaluation
- Devoir de Controle +Liaisons+MécaniquesN2 1AS 2021Document4 pagesDevoir de Controle +Liaisons+MécaniquesN2 1AS 2021Razan KhPas encore d'évaluation
- SolfegeDocument24 pagesSolfegeDodaPas encore d'évaluation
- Jeu de L'oie Épisode 3Document5 pagesJeu de L'oie Épisode 3Mery MeryPas encore d'évaluation
- Bertrand Russell Théorie de La Connaissance - Le Manuscrit de 1913Document3 pagesBertrand Russell Théorie de La Connaissance - Le Manuscrit de 1913Ahmed KabilPas encore d'évaluation
- (CFT) Memento PDFDocument6 pages(CFT) Memento PDFlacoste123Pas encore d'évaluation
- Cours HDD ASSASNETDocument91 pagesCours HDD ASSASNETAlyssa PeixotoPas encore d'évaluation
- Programmation Didactique - Concours 10Document55 pagesProgrammation Didactique - Concours 10Miguel92% (13)
- Les Modes de Transferts Thermique Dons Les BatimentDocument6 pagesLes Modes de Transferts Thermique Dons Les Batimentfatiha100% (1)
- Physique StatistiqueDocument369 pagesPhysique StatistiqueAnas Hasni86% (7)
- LM Linear Range 12774 FRDocument248 pagesLM Linear Range 12774 FRAhmed MezniPas encore d'évaluation
- Guide Des Associations 2020 21Document88 pagesGuide Des Associations 2020 21David Avishaï CohenPas encore d'évaluation
- Examen de EntrepreneuriatDocument14 pagesExamen de EntrepreneuriatMamadou Gueye100% (1)
- Cas - Pratique - Conduite - Du - Changement - Jean-FrançoisDocument3 pagesCas - Pratique - Conduite - Du - Changement - Jean-FrançoisFérielPas encore d'évaluation
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- Puissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéD'EverandPuissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéÉvaluation : 3.5 sur 5 étoiles3.5/5 (3)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- La Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeD'EverandLa Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeÉvaluation : 5 sur 5 étoiles5/5 (1)